ERCP联合胆管腔内超声及胆管活检对胆管良恶性狭窄的诊断价值
王 伟 黄晓俊 王 祥 冯彦虎 郝晋雍
(兰州大学第二医院消化科,兰州 730030)
内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)是胆管良性和恶性狭窄的重要诊断方法,结合组织学活检有助于提高胆管恶性狭窄的定性诊断,但其阳性率报道差别较大。ERCP同时行胆管腔内超声(intraductal ultrasonography,IDUS)检查不仅可以在超声图像上提供良恶性依据,而且在X线引导下可以协助对病灶定位,以促进靶向活检,有可能提高诊断的阳性率[1]。本研究前瞻性对比ERCP联合IDUS活检与ERCP活检对胆管良恶性狭窄诊断的结果,报道如下。
1 临床资料与方法
1.1 一般资料
纳入标准:年龄>18岁;影像学(CT或MRI、MRCP)提示胆道狭窄伴近端胆管扩张;生化检查证实胆汁淤积,有ERCP适应证。
排除标准:胆道手术史、出血倾向等ERCP禁忌证。
2014年6月~2016年8月入选胆道狭窄100例,根据患者入院顺序按随机数字表编号,1∶1分配到ERCP联合IDUS组及ERCP组,2组一般资料比较差异无统计学意义(P>0.05),见表1。

表1 2组一般资料比较(n=50)
*上段病变测量肝门部胆管汇合部至病变远端距离
TB:总胆红素(正常值3.0~25.8 μmol/L);ALP:碱性磷酸酶(正常值0~120 U/L);CA19-9:糖类抗原19-9(正常值0~27.00 U/ml);CEA:癌胚抗原(正常值0~3.40 ng/ml)
1.2 器械
ERCP使用TJF-240电子十二指肠镜(Olympus),高频电发生器,三腔乳头切开刀(Olympus KD-310Q-0720),黄斑马导丝,活检钳(Olympus,FB-231K),其他ERCP附件,内镜主机及图文系统,X光机(Toshiba,Ultimax MDX-8000A)。IDUS使用胆管腔内超声微探头(Olympus,UM-DG20-31R,20 MHz),超声内镜主机(Olympus,EndoEcho EU-M2000)及MAJ935驱动。
1.3 操作方法
ERCP常规术前准备。行常规ERCP,胆管插管成功后胆道造影,判断胆管狭窄部位和性质。ERCP组用活检钳通过十二指肠乳头进入胆管,在X线定位部位取活检。ERCP联合IDUS组将胆管超声探头沿导丝插入胆管至肝总管,向乳头处自上而下缓慢探查并留取胆管内超声声像图,根据IDUS及X线定位处取活检。2组均取活检2~3块,置于10%福尔马林溶液中送检。器械进入胆道过程均在X线监视下进行。如器械通过乳头困难,可酌情行十二指肠乳头括约肌切开,或用活检钳夹取导丝法进入胆管。活检结束后放置鼻胆管引流。
1.4 胆管良恶性判断标准
ERCP判断标准:恶性狭窄胆道造影时显示长度>10 mm、不对称及不规则狭窄。良性病变显示狭窄长度短、规则和对称性狭窄。
IDUS判断标准:恶性狭窄表现为正常胆管壁三层结构破坏,低回声浸润性病变边缘不规则,回声不均匀,或浸润至周围组织。良性狭窄胆管壁三层结构存在,管壁光滑,或有回声均匀的管壁增厚但无低回声病变浸润征象。
最终诊断标准:恶性狭窄为活检病理或者手术病理证实恶性,或者影像学检查提示恶性且随访过程中发现临床经过呈恶性疾病病程。良性狭窄为手术病理证实,或者各种细胞学检查阴性且至少随访12个月以上未见恶性征象。
1.5 观察指标及统计学处理
观察2组ERCP联合或不联合IDUS诊断良恶性狭窄的敏感性、特异性、阳性/阴性预测值、诊断准确性及并发症。观察两组活检阳性率。
2 结果
ERCP联合IDUS组插管及活检失败各1例,ERCP组插管及活检失败各1例、失访1例,以上均退出研究。通过活检病理、手术及随访确定诊断,ERCP联合IDUS组48例中恶性狭窄30例,良性狭窄18例,恶性狭窄中胆管癌26例(下段11例、中段10例、上段/肝门部5例),胰腺癌4例。ERCP组中恶性狭窄30例,良性狭窄17例,恶性狭窄中胆管癌25例(下段10例、中段8例、上段/肝门部7例),胰腺癌5例。图1为胆管上段(肝门部)癌ERCP联合IDUS及活检。
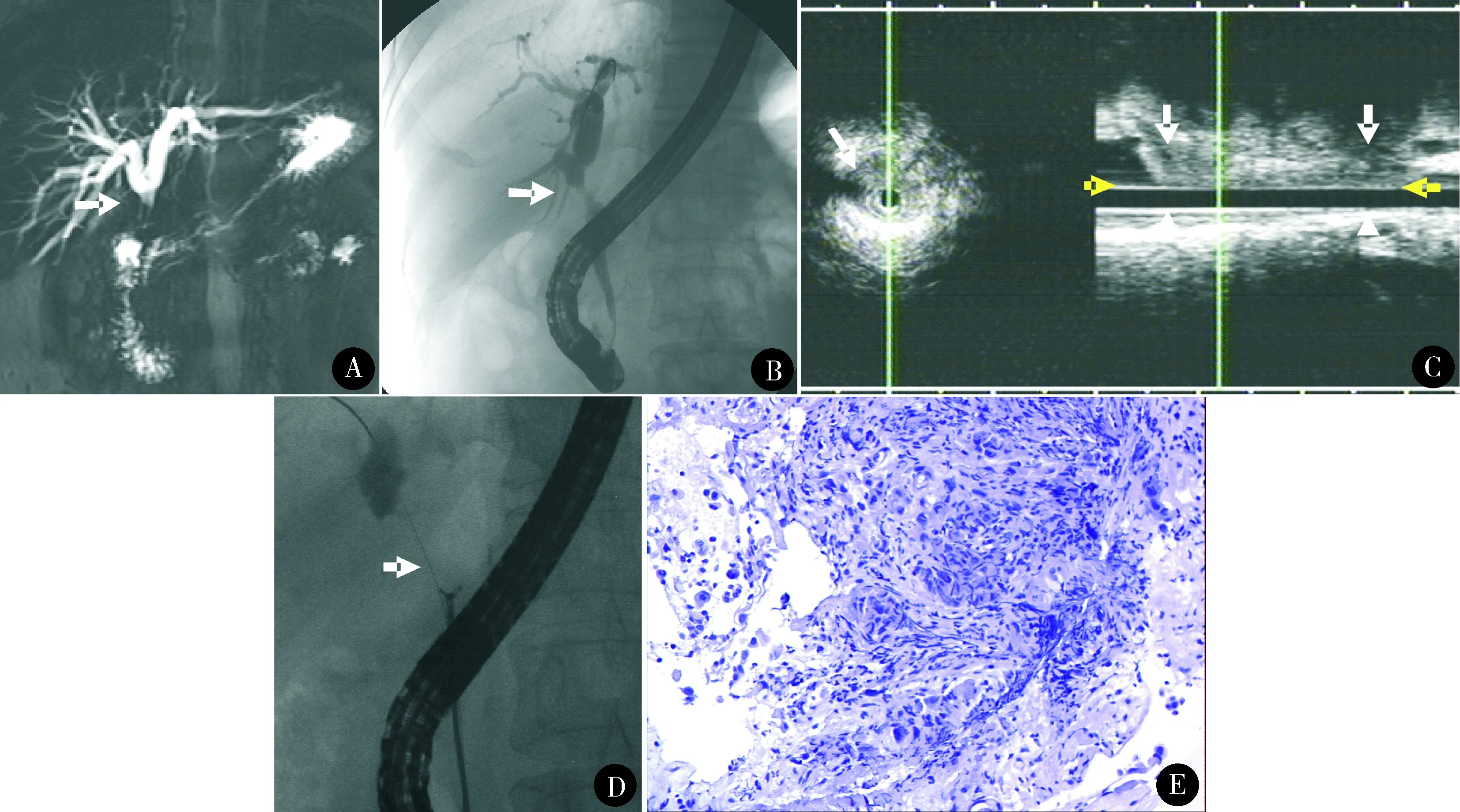
图1 胆管上段(肝门部)癌行ERCP联合IDUS活检。A:MRCP示肝总管狭窄(箭头),狭窄以上胆管扩张;B:ERCP显示肝总管狭窄(箭头);C:IDUS及3D-IDUS显示低回声病变胆管壁浸润征象(白色箭头)及病变长度(黄色箭头间,标尺间距10 mm);D:经乳头胆管活检(箭头所示);E:活检病理示中低分化腺癌(HE染色 ×200)
2.1 不同方法对胆管良恶性的诊断价值
ERCP联合IDUS对胆管良恶性狭窄诊断的敏感性93.3%(28/30)、特异性88.9%(16/18)、阳性预测值93.3%(28/30)、阴性预测值88.9%(16/18)、准确性91.7%(44/48),ERCP组分别为73.3%(22/30)、76.5%(13/17)、84.6%(22/26)、61.9%(13/21)、74.5%(35/47)。ERCP联合IDUS诊断的敏感性及准确性高于单纯ERCP,差异有统计学意义(P<0.05),见表2。
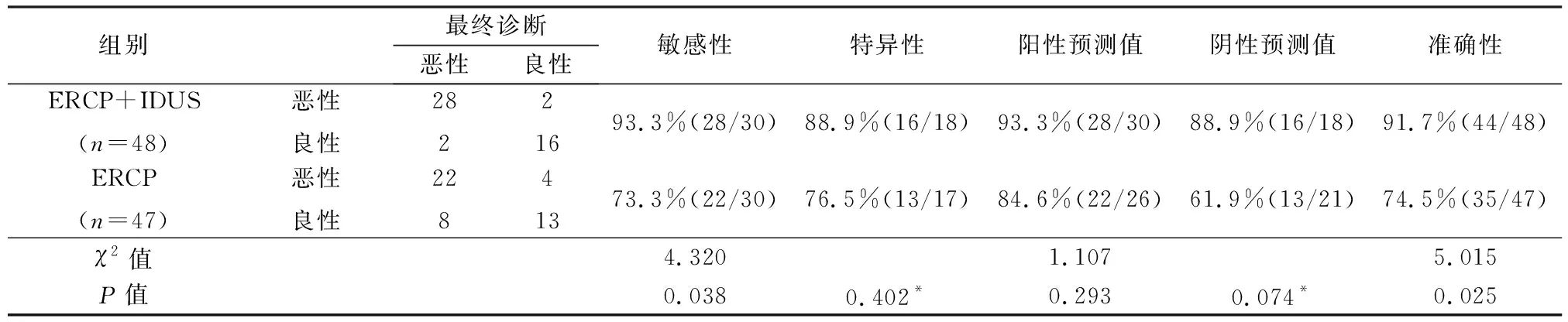
表2 2种方法对胆管良恶性狭窄诊断的比较
*Fisher确切概率法
2.2 2组活检阳性率对比
ERCP联合IDUS组活检恶性狭窄中胆管癌阳性率为80.8%(21/26),胰腺癌为50.0%(2/4),ERCP组分别为52.0%(13/25)、40.0%(2/5)。ERCP联合IDUS组胆管癌活检阳性率高于ERCP组(P<0.05),2组不同部位胆管癌活检阳性率差异无统计学意义(P>0.05),胰腺癌活检阳性率2组差异无统计学意义(P>0.05),见表3。ERCP联合IDUS组2例胰腺癌活检阳性病例IDUS均提示有肿瘤胆管浸润征象。
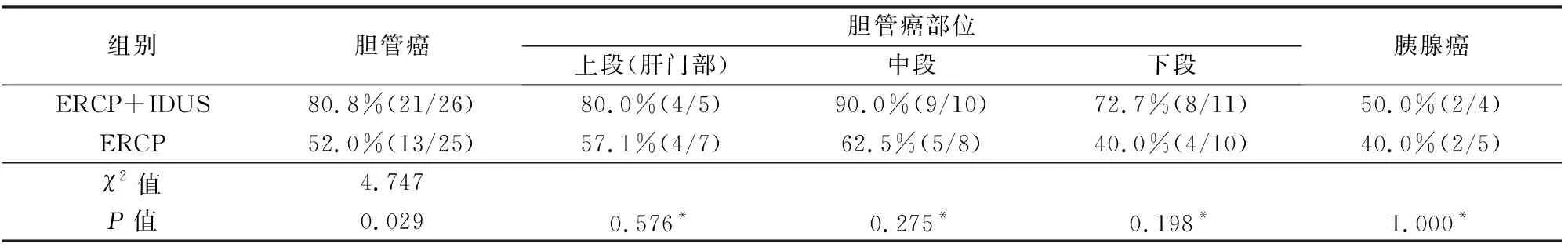
表3 2组胆管恶性狭窄活检阳性率的比较
*Fisher确切概率法
2.3 术后并发症
ERCP联合IDUS组并发术后胰腺炎2例(4.2%,2/48),ERCP组为3例(6.4%,3/47),差异无统计学意义(χ2=0.234,P=0.629),均为轻症胰腺炎,均治愈。2组均无术后出血、胆道继发感染、穿孔及与操作相关死亡。
3 讨论
胆管良恶性疾病均可导致胆管狭窄,其病因诊断是临床上的难题,尤其恶性胆道狭窄患者被诊断时往往已经处于疾病进展期,预后较差[2,3]。传统的体外超声、CT对胆管扩张诊断的敏感性很高,但对狭窄性质判断仍存在一定的困难。Park等[4]研究显示在胆管良恶性狭窄诊断中MRCP与ERCP作用相当,MRCP的敏感性、特异性及准确性分别为81%、70%和76%,ERCP为74%、70%和72%。然而胆管狭窄者常伴有梗阻性黄疸及胆管炎,作为无创检查的MRCP在诊疗上尚不能取代ERCP[5]。
IDUS是通过ERCP途径将微型超声探头插入胆管内进行检查,在导丝引导下将微型高频率超声探头插入胆管内,大多数无需十二指肠乳头切开,可提供详细的高分辨率胆道超声图像。胆管狭窄于IDUS图像上具有特征性表现,恶性狭窄表现为正常胆管壁三层结构破坏,低回声浸润性病变边缘不规则,回声不均匀,或浸润至周围组织[6]。研究[7~10]表明IDUS的应用使ERCP对良恶性胆管狭窄诊断的准确性上升至90%以上。本研究中ERCP对胆管恶性狭窄敏感性、特异性及准确性分别为73.3%、76.5%和74.5%,联合IDUS提高至93.3%、88.9%和91.7%。
虽然IDUS对胆管癌的诊断有较高的准确性和敏感性,但其不能取得组织细胞学诊断。胆道镜或Spyglass系统[11,12]的应用可以对胆管病变进行直视下诊断及活检,但存在成像质量不佳及临床普及的问题。目前获取胆管组织细胞标本的常见途径为ERCP胆管刷检、活检或两者联合应用。研究表明ERCP胆管刷检或活检对胆管癌诊断的特异性可达100%,而敏感性差异较大,胆管刷检在30%~60%,胆管活检则高于刷检,为43%~81%[13],原因在于胆管刷检所获取细胞数量较少及获取细胞存在细胞分裂。Navaneethan等[14]的meta分析显示,胆管刷检及活检对胆管恶性狭窄诊断的敏感性分别为45%和48%,两者联合可提高至59.4%。
IDUS不仅可以在超声图像上提供良恶性依据,而且在X线引导下可以协助对病灶定位,以促进靶向活检,有可能提高诊断的阳性率。Kim等[15]的研究中,IDUS引导下经乳头胆管活检诊断胆管恶性狭窄准确性为90.8%,而传统活检为76.9%。本研究中联合IDUS及X线定位胆管活检阳性率为80.8%,高于ERCP活检(52%),而对胰腺癌活检2组差异无显著性,胰腺癌活检阳性与肿瘤浸润胆管有关。本研究显示胆管下段癌活检阳性率低于中上段,但无统计学差异,与Domagk等[16]的报道相近,分析原因与活检钳易于获得胆管狭窄下缘组织,而下段癌活检钳在狭窄处难以充分张开及钳取组织困难有关。
胆管活检难点还有活检钳如何经过十二指肠乳头进入胆管,这亦是活检成功的关键。Yamashita等[17]认为经导丝辅助胆道活检可以提高活检成功率及阳性率,操作中选择超细活检钳及根据术中情况适时行乳头括约肌预切开,或经活检钳夹取导丝,经导丝引导进入胆道。本研究2组各有1例因活检钳难以进入胆管致活检失败。另外,操作需在X线监视下进行,以免穿孔及活检钳误入胰管等并发症的发生。经乳头胆管活检的并发症主要有胆管穿孔、胰腺炎,相关文献报道其发生率较低。Kitajima等[18]报道胆管穿孔发生率2.0%(1/51),经胆管引流后很快愈合。Tanaka等[19]报道术后胰腺炎发生率为3.7%(5/136)。术后胰腺炎是ERCP的最常见并发症,其发生率在5%~10%[20]。本研究无出血及穿孔发生,术后胰腺炎均为轻症,IDUS组发生率为4.2%,ERCP组为6.4%。
综上所述,ERCP联合IDUS胆管活检对胆管良恶性狭窄有较高的诊断价值,IDUS结合X线进行定位活检有助于提高活检阳性率,其操作安全、可靠。此外,胆管活检操作有一定难度,需有经验医师进行。

