甘氨酸通过抑制大鼠创伤性脑损伤后炎症反应来发挥神经保护作用
唐俊春 潘梦鲜 刘瑞 万芪
创伤性脑损伤(Traumatic brain injury, TBI)是导致人类死亡及残疾的重要原因[1]。炎症反应是TBI后继发的神经功能损伤的重要原因。TBI后可发生炎症反应,释放大量的炎症因子[1]。很多证据表明TBI后神经细胞死亡和神经功能缺损与炎症反应有关[2]。甘氨酸(Glycine)是最简单的氨基酸,为人体非必需氨基酸。近年研究表明甘氨酸具有神经保护作用,能明显改善缺血再灌注损伤、脑出血等多种神经系统疾病[3]。但甘氨酸对TBI是否也具有神经保护作用,是否调节炎症反应过程目前尚不清楚。本研究建立大鼠脑损伤模型,探讨甘氨酸对TBI后脑水肿、神经细胞损伤及炎症反应的影响,为甘氨酸对TBI的治疗提供理论依据。
1 材料与方法
1.1 实验动物及模型
50只SPF级SD雄性大鼠购自武汉大学动物实验研究中心,体重250~280 g;按数字表法随机分为对照(Sham)组、脑损伤+溶剂(TBI+Vehicle)组和脑损伤+甘氨酸(TBI+Glycine)组,TBI模型参照Feeney’s自由落体打击法[4];10%水合氯醛(3.5 mL/kg)腹腔注射麻醉后局部皮肤消毒、切开,暴露颅骨,找到前囟点;将大鼠固定于立体定位仪,以前囟后1.5 mm,中线右侧2.5 mm处为中心,用牙科钻钻一直径5 mm骨窗,暴露硬脑膜,注意保持硬脑膜完整;安装固定颅脑损伤打击器,将20 g打击锤从硬脑膜上方20 cm处自由落下,打击后骨蜡封闭伤口,缝合皮肤;对照组仅去骨瓣后骨蜡封闭。
术后1 h侧脑室注射甘氨酸(购自美国Sigma公司),注射剂量为2 mg/kg;甘氨酸溶于生理盐水中;脑损伤+溶剂组注射等体积的生理盐水;术后24 h取脑,用于脑含水量的测定、蛋白免疫印迹检测,冰冻切片进行Fluoro-Jade C染色和炎症因子水平检测。
1.2 脑含水量的测定
TBI后24 h用10%水合氯醛腹腔麻醉后断头取脑,取创伤灶附近的脑皮层1块,约(200±20)mg,电子分析天平上称湿重后将脑组织置于100 ℃烘箱烘烤24 h,再测干重,脑组织含水量(%)=[(湿重-干重)/湿重]×100%。
1.3 蛋白免疫印迹
10%水合氯醛腹腔注射麻醉,生理盐水灌注后分离损伤侧附近皮层组织,加入含磷酸酶抑制剂和蛋白酶抑制剂的裂解液匀浆,12000 r/min 4 ℃ 离心15 min,取上清液;BCA法检测蛋白水平;10% SDS-PAGE分离胶电泳,转膜,5%脱脂牛奶封闭1 h,加一抗4 ℃孵育过夜;TBST洗3次后加入相应的二抗室温孵育1 h,TBST漂洗后加入ECL显色液,荧光成像仪成像;蛋白检测所用一抗:anti-Neun(Monoclonal,1∶500),anti-GAPDH(Cell signaling technology,1∶2000)。
1.4 Fluoro-Jade C(FJC)染色
大鼠麻醉后分别用生理盐水、4%多聚甲醛灌注;取脑后冰冻切片,厚度为15 μm;用PBS洗去多聚甲醛5次,乙醇浸洗,0.06%高锰酸钾摇床震摇10 min,蒸馏水洗涤2次;FJC染液避光染色20 min,蒸馏水洗涤3次,50 ℃烘烤玻片10 min;二甲苯透明2 min后中性树脂封片;荧光显微镜下观察,并在400倍视野下随机选取5个视野计数阳性细胞数。
1.5 ELISA实验
取创伤灶附近的脑皮层少量,制备脑组织匀浆10 min,4000 r/min,离心10 min,取上清液,采用ELISA试剂盒(大连美仑生物技术有限公司)检测损伤侧大脑皮层中炎症因子白介素1β(IL-1β),白介素6(IL-6)和肿瘤坏死因子α(TNF-α)的表达水平。按试剂盒说明书操作。
1.6 统计学处理
2 结 果
2.1 Glycine可减轻TBI后脑水肿
TBI后可引起脑组织发生水肿,表现脑含水量增加。如图1所示,TBI+Vehicle组含水量明显高于Sham组(P<0.05),而TBI+Glycine组含水量低于TBI+Vehicle组(P<0.05)。
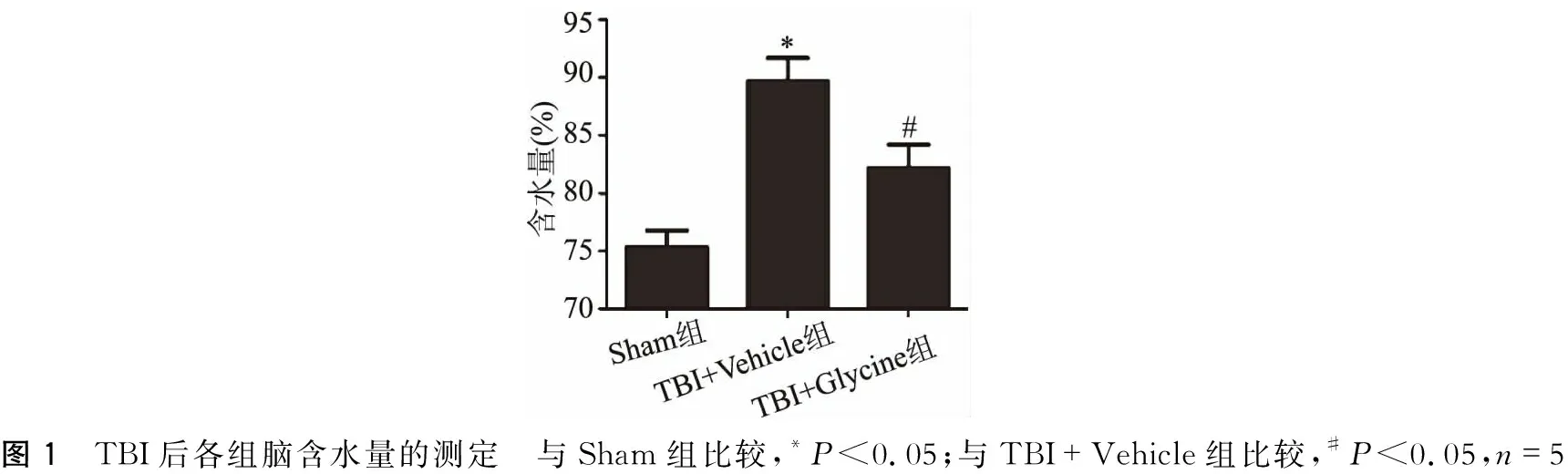
图1 TBI后各组脑含水量的测定 与Sham组比较,*P<0.05;与TBI+Vehicle组比较,#P<0.05,n=5
2.2 Glycine减轻皮层神经元损伤
TBI后可诱发或加重神经元损伤。Neun是神经元特异性表达蛋白,其含量可间接反映神经元数量的变化。免疫印迹显示,TBI+Vehicle组Neun的表达水平显著低于Sham组(P<0.05),而TBI+Glycine组Neun表达水平显著高于TBI+Vehicle组(P<0.05)(图2)。
2.3 Glycine降低神经元的退化
为进一步研究Glycine对TBI后具有神经保护作用,在TBI后24 h用FJC染色,FJC标记大量退化的神经元(绿色)出现在损伤病灶区的周围组织中;TBI+Vehicle组退化神经元的数量高于Sham组,TBI+Glycine组退化神经元的数量较TBI+Vehicle组下降(图3)。
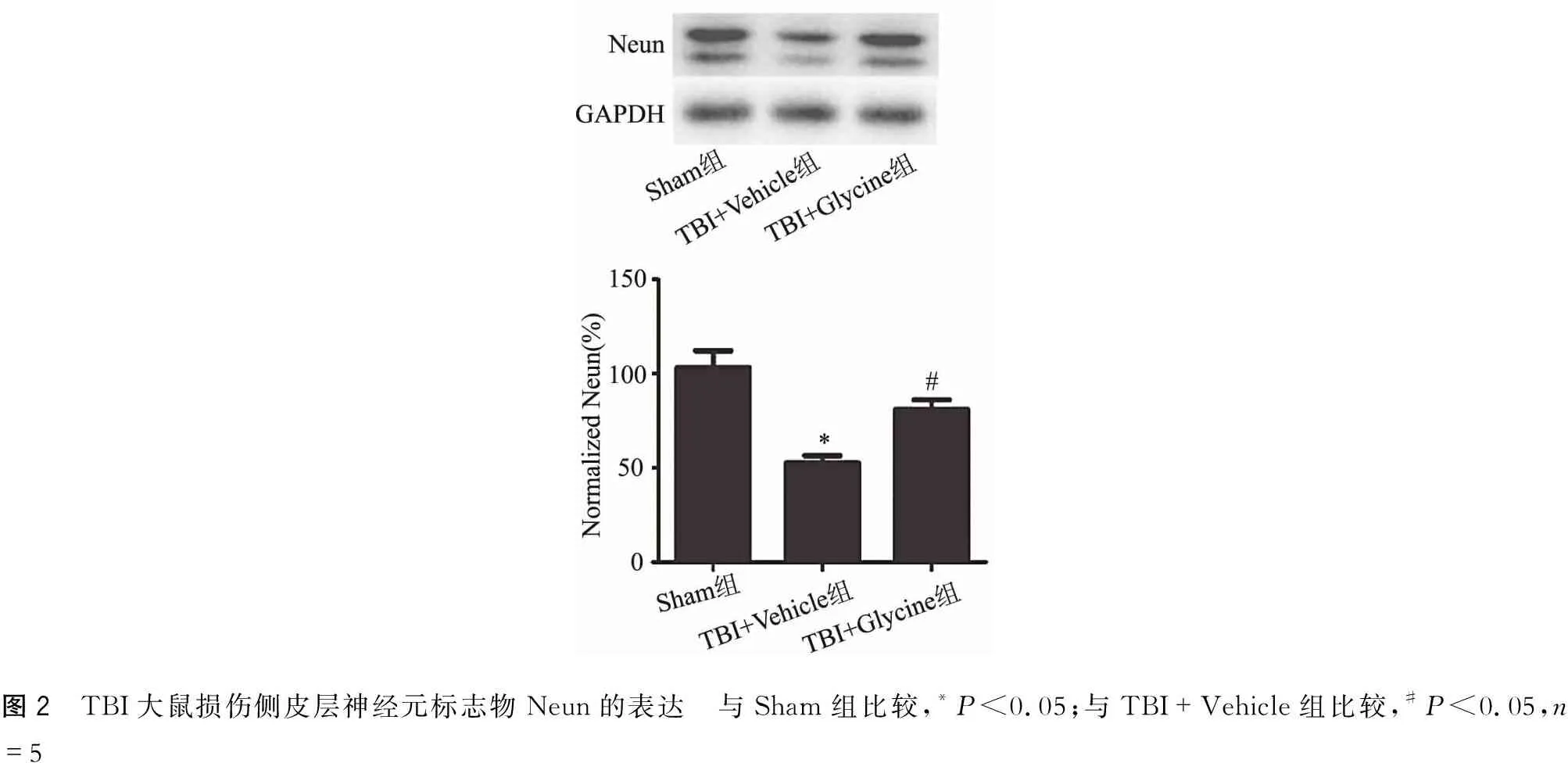
图2 TBI大鼠损伤侧皮层神经元标志物Neun的表达 与Sham组比较,*P<0.05;与TBI+Vehicle组比较,#P<0.05,n=5
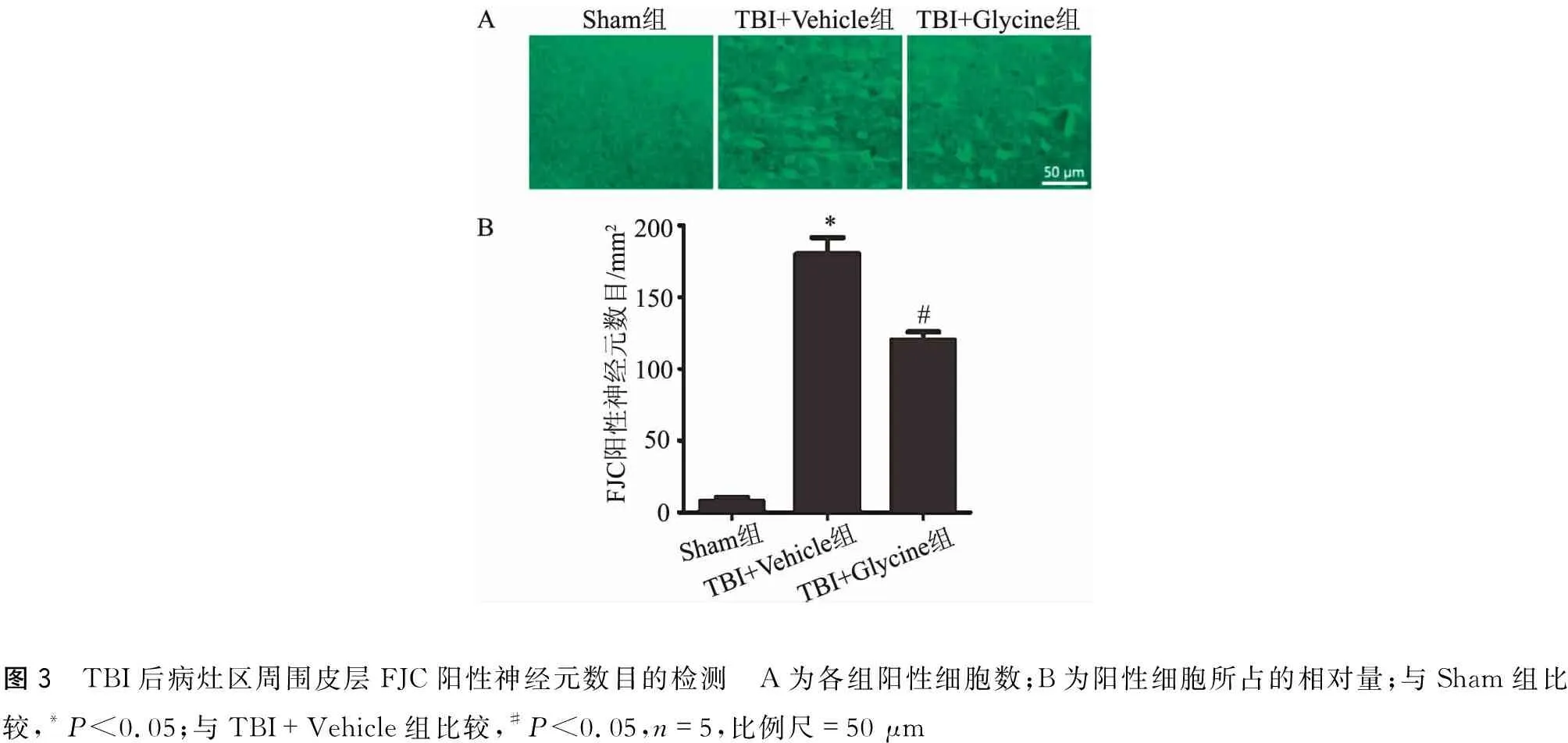
图3 TBI后病灶区周围皮层FJC阳性神经元数目的检测 A为各组阳性细胞数;B为阳性细胞所占的相对量;与Sham组比较,*P<0.05;与TBI+Vehicle组比较,#P<0.05,n=5,比例尺=50 μm
2.4 Glycine抑制TBI后炎症因子的表达
采用ELISA法检测TBI 24 h后损伤周围区皮层组织匀浆中炎症因子的表达水平,TBI+Vehicle组炎症因子的表达水平显著高于Sham组,TBI+Glycine组炎症因子的表达水平低于TBI+Vehicle组(图4)。
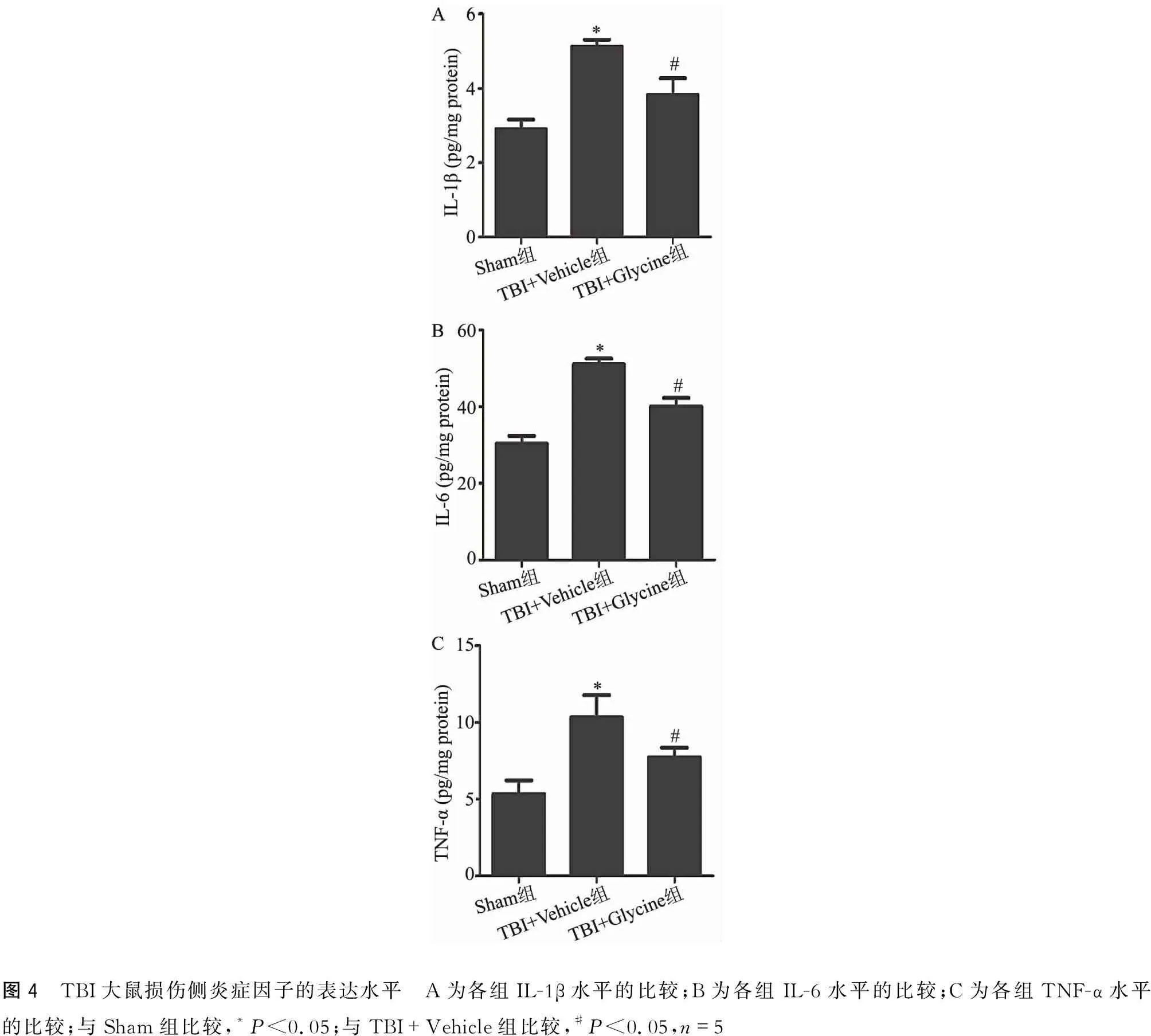
图4 TBI大鼠损伤侧炎症因子的表达水平 A为各组IL-1β水平的比较;B为各组IL-6水平的比较;C为各组TNF-α水平的比较;与Sham组比较,*P<0.05;与TBI+Vehicle组比较,#P<0.05,n=5
3 讨 论
有研究发现TBI大鼠脑损伤后可引起损伤周围区发生炎症反应,炎症因子的表达水平升高[5]。甘氨酸又称氨基乙酸,是一种化学结构最简单的氨基酸,也是人体内的一种非必需氨基酸[6],能被生物体自主合成,为合成其他氨基酸提供氮源。在中枢神经系统中甘氨酸是一个抑制性神经递质。研究表明甘氨酸在体外和体内的实验条件下均具有细胞保护和免疫调节的作用[7-8]。重要的是,临床试验显示甘氨酸治疗可改善缺血性脑卒中患者的预后[9]。然而,目前还没有关于甘氨酸与TBI关系的报道。本研究采用Feeney法建立大鼠TBI模型,依据研究报道选取2 mg/kg剂量的甘氨酸在大鼠TBI后1 h给予侧脑室注射治疗[10],选择TBI后24 h取材进行指标测定,结果显示甘氨酸可减轻大鼠TBI后脑水肿,降低神经元的损伤程度。这些结果提示了甘氨酸对大鼠TBI后有一定的神经保护作用,但其保护机制特别是TBI后炎症反应是否参与此过程不明确。
炎症反应对TBI后神经功能的损伤起着重要的作用。有研究表明TBI后脑组织局部发生炎症反应,释放大量的炎症因子如IL-1β、IL-6和TNF-α,破坏了血脑屏障,增加其通透性,进而加剧了脑水肿和神经细胞损伤[11-12]。本研究结果证实大鼠TBI后24 h病灶区周围皮层的炎症因子IL-1β、IL-6和TNF-α表达水平明显增高,与脑水肿、神经细胞损伤有一定的关系。这提示了炎症反应在TBI后脑水肿和神经细胞的恢复起着重要作用。与脑损伤+溶剂组相比,脑损伤+甘氨酸组能明显降低炎症因子IL-1β、IL-6和TNF-α的表达水平,降低TBI后炎症反应,这表明了甘氨酸可通过抑制TBI后炎症反应来起到神经保护作用。但是甘氨酸是如何调控TBI后炎症因子表达水平的分子机制仍需进一步研究。
综上所述,甘氨酸对大鼠TBI后具有神经保护作用,其机制可能是通过抑制炎症因子IL-1β、IL-6和TNF-α的表达水平来减轻TBI后继发的炎症反应。

