1例多系统萎缩伴周期性腿动病例报道并文献复习
梅俊华 陈国华 徐金梅 刘敏珍 张忠文 龚雪
多系统萎缩(Multiple System Atrophy,MSA)是一散发性、成人起病的运动障碍疾病,也是一种神经退行性疾,其临床表现复杂多变,以帕金森综合征、小脑性共济失调、自主神经功能障碍为主要表现。近年研究表明,该病也常常合并睡眠障碍,包括失眠、快速眼动期睡眠行为障碍(REM Sleep Behavior Disorder,RBD)、阻塞性睡眠呼吸暂停综合征(Obstructive Sleep Apnea-hypopnea Syndrome,OSAS)、日间过度嗜睡(Excessive Daytime Sleepiness,EDS)、周期性腿动(Periodic Limb Movement During Sleep,PLMS)、不宁腿综合征(Restless Legs Syndrome,RLS)等。其中文献报道MSA患者中RBD的发生率高达80%~100%;合并PLMS的发病率达44%[4]。但关于MSA并PLMS的病例国内外鲜有报道。本研究现将本院PSG诊断的1例的多系统萎缩并PLMS的临床资料进行分析,并文献复习,以提高对本病特点的认识。
1 临床资料
患者,女,60岁,因“渐起四肢僵硬、行动迟缓、吐词不清2年余”于2016年11月29日收入神经内科。
现病史:患者于2013年11月渐起出现左下肢、右下肢、右上肢无力,伴行动迟缓,未予以重视及就医治疗,症状渐行性加重;于2014年初开始出现说话吐词不清、书写困难、写字歪歪扭扭,伴有头部震颤、四肢僵硬、行动迟缓,但此时尚能缓慢行走,曾门诊初步诊断“帕金森病”,予以口服多巴丝肼片(0.125 g,tid)及吡贝地尔缓释片(50 mg,bid),治疗效果欠佳;2015年5月开始出现面部肌肉力弱、进食咀嚼费力,行动明显迟缓,易跌倒(行走时向后倾明显)、需扶行;伴有大便便秘,小便失禁及小便潴留。发病以来,患者睡眠欠佳,家属诉夜间睡觉时有大声喊叫症状。既往史:冠心病史3年,浅表性胃炎病史4年。
诊断及治疗经过:查体BP平卧位110/80 mmHg,站立位85/50 mmHg;HR75次/min,T36.5 ℃;神志清楚,头部可及震颤;认知粗测正常,言语不清,构音障碍;双侧瞳孔等大等圆,光反射灵敏,双侧眼球活动自如,双侧鼻唇沟对称,伸舌居中,感觉功能粗查正常;行走困难,不稳并步基增宽,四肢肌力5级,四肢肌张力增高,四肢腱反射活跃,病理征阴性,指鼻及双侧轮替试验均笨拙。心肺等一般检查无异常。
入院后辅助检查:颅脑(MRI+SWAN)显示(1)左侧颞叶深部囊性信号灶大致同前,可能为脉络膜裂囊肿或小软化灶;(2)颅内SWAN检查双侧脑实质内未见明显异常低信号影(图1)。心电图及心脏彩超正常。膀胱残余尿检查残余尿60 mL。血常规、凝血功能、肝肾功能、血脂分析、糖化血红蛋白、HCY、肿瘤标志物、血清维生素B1,B12,叶酸测定、ENA4+7,ANCA未见明显异常。MMSE评分26分,MCAO评分25分。PSG检查显示(1)睡眠效率下降,睡眠潜伏期正常,睡眠中觉醒时间增多、觉醒次数增多;(2)睡眠结构紊乱,Ⅰ期睡眠比例增多,Ⅱ期睡眠比例增多,深睡眠比例减少,REM期比例减少,REM潜伏期正常;(3)睡眠监测中未见异常行为发作;(4)睡眠中可见少许睡眠呼吸暂停低通气事件,以低通气为主,AHI为3.2,最低SPO2为91%;(5)睡眠监测中可见重度周期性腿动事件,PLM指数为115.2;(6)REM睡眠期可见阵发性肌电活动增高(图2)。

图1 患者的头颅Flair像未见明显异常
诊疗过程及病情演变:结合患者病史特点,即自主神经功能失调(小便失禁、体位性低血压)、小脑性共济失调(行走向后倾倒,宽基底步态)、锥体外系症状(震颤、肌张力增高)左旋多巴治疗不佳,考虑多系统萎缩诊断很可能。患者睡眠障碍(PSG检查示重度周期性腿动),考虑患者多系统萎缩并PLMS明确,结合患者症状,考虑患者也同时存在RBD,但PSG监测中仅仅见到REM期阵发性肌电活动增高,未见到异常行为发作,若延长监测时间有助于诊断明确,但患者拒绝进一步检查。治疗方面:针对睡眠障碍予以小剂量氯硝西泮口服,予以加吧喷丁口服,患者自诉睡眠质量较前明显改善。
2 讨 论
多系统萎缩(MSA)是一种临床罕见的散发性、进行性神经变性疾病,多于50~60岁发病,男性发病率高于女性。欧美人群每年发病率约为0.60/10万,在50岁以上人群中则为 3/10万;其主要病变部位累及黑质—纹状体系统、橄榄脑桥小脑、大脑皮质、脊髓中间外侧核;目前对于MSA的发病机制尚无统一定论,病理机制多考虑为以α-突触共核蛋白阳性包涵体为特征的少突胶质细胞变性,继而诱发神经元变性或者神经元本身α-突触共核蛋白异常聚集、造成神经元变性死亡。其病理产物为广泛密集分布的α-突触共核蛋白阳性少突胶质细胞胞质包涵体。
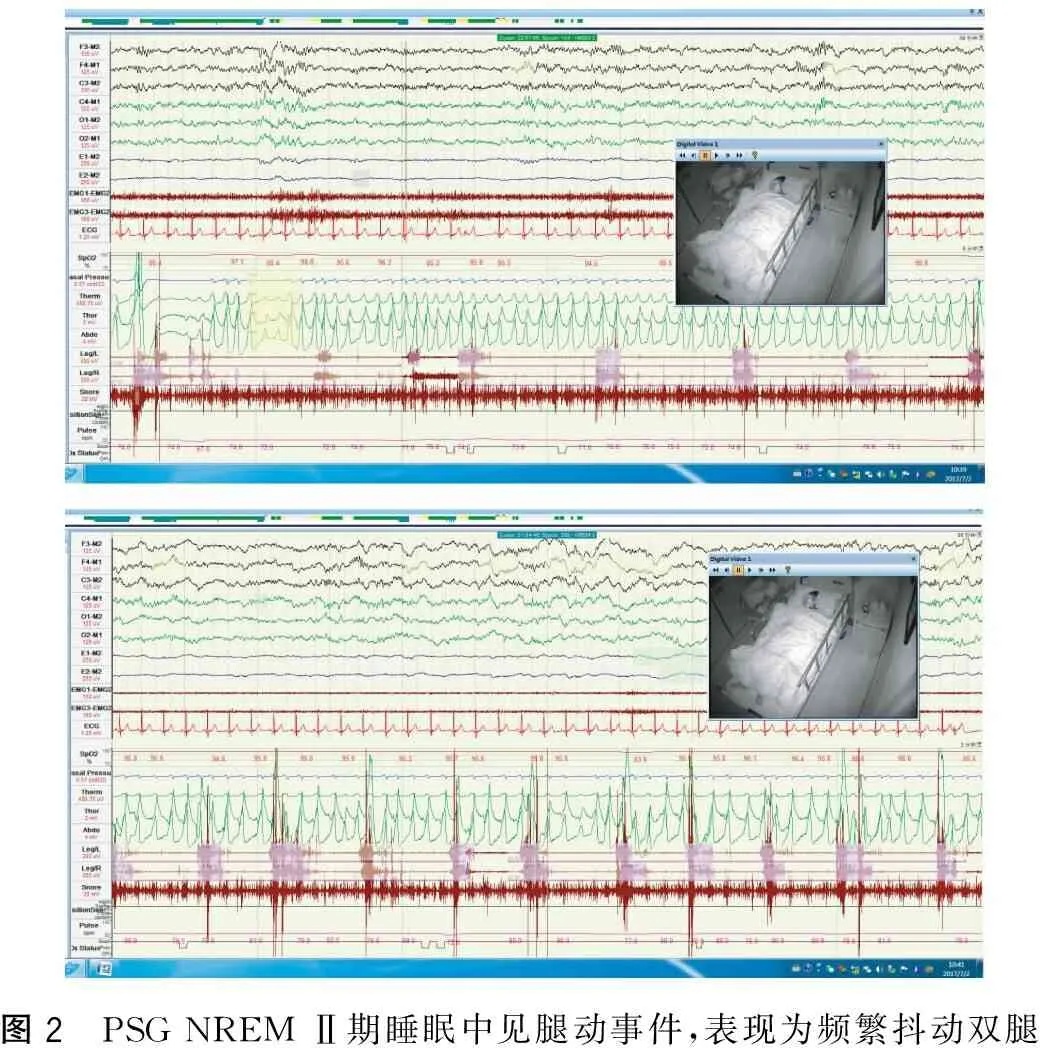
图2 PSG NREM Ⅱ期睡眠中见腿动事件,表现为频繁抖动双腿
PLMD是下肢在睡眠中反复周期性发生的一种异常运动,常常伴随出现在RLS中。发病机制尚不明确,多考虑与多巴胺能神经元受损、缺铁及周围神经调节异常相关。
MSA也常常合并睡眠障碍,文献报道MSA患者多存在睡眠结构改变,包括总睡眠时间减少、睡眠效率下降;表现为失眠、快速眼动期睡眠行为障碍(RBD)、阻塞性睡眠呼吸暂停综合征(OSAS)、日间多度嗜睡(EDS)、周期性腿动(PLMD)、不宁腿综合征(RLS)等;国内关于MSA睡眠障碍的报道较少,研究关注MSA中PLMD更少。虽然MSA的PLMD机制尚不明确,但有研究显示MSA患者出现PLMS的发生率较高,且程度往往较重;MSA的病理产物是α-突触核蛋白的异常积聚,α-突触核蛋白分布于突触前神经末梢,其功能与突触前神经末梢功能相关,参与神经系统的发育。现有资料表明α-突触核蛋白的功能之一就是通过调节多巴胺转运体在细胞膜上穿梭影响多巴胺在神经末梢摄取的效率,参与多巴胺(Dopamine,DA)的生物合成调节。大量研究证据表明,α-突触核蛋白(a-syn)的异常聚集可能是导致多巴胺能神经元变性死亡的重要原因。也有研究报道基于左旋多巴及多巴胺激动剂的减少,多巴胺能发射系统可能参与了PLMS的病理生理学机制;异常聚集的α-突触核蛋白影响多巴胺能受体激动剂的水平,导致DA水平明显下降,推测这可能是MSA的PLMS存在的机制。因此,关于MSA的PLMS的研究有助于我们更好地认识神经变性疾病的睡眠障碍问题。本例患者的睡眠多导检测证实了该多系统萎缩患者合并PLMS,结合患者既往有睡眠中喊叫等异常行为的病史及PSG中REM期阵发性肌电活动增高,考虑该患者也同时合并RBD,通过本例有助于我们更清晰地了解该类患者睡眠障碍的特点。睡眠问题的及时诊治也为MSA综合诊治提供帮助,同时通过对睡眠障碍的及时诊治也有助于改善患者的生活质量。

