活化转录因子3对绿脓杆菌致急性肺损伤小鼠肺组织核因子-κB表达的影响
吴秀琳 李明霞 钱斓兰 郭亮 吴学玲
急性肺损伤/急性呼吸窘迫综合征(acute lung injury/acute respiratory distress syndrome, ALI/ARDS)是由各种致病因素直接或间接损伤导致弥漫性肺间质及肺泡水肿,最终因炎症反应失控而发生急性呼吸困难、低氧血症和非心源性肺水肿的临床危重症,为常见的进展迅速的炎症性肺疾病,是脓毒血症、爆发性流感、严重急性呼吸综合征(severe acute respiratory syndrome, SARS)、重症肺炎等疾病的主要死亡原因[1-2]。近年来,虽然ALI/ARDS发病机制和临床治疗研究已取得了很大的进展,然而其发病机制复杂,尚无有效的治疗方案,其发病率及病死率高居不下,病死率仍高达40%左右[3-4]。因此对ALI/ARDS发病机制及其防治的研究就具有重要的临床意义。
近年来研究证实,ALI/ARDS本质是炎症反应失控,但其发病机制尚不完全明确。其中,细菌感染是引发ALI的常见病因,绿脓杆菌(Pseudomonas aeruginosa, PA)是院内感染最常见的致病菌之一。内毒素(LPS,革兰氏阴性菌外膜的主要成分)可与脂多糖结合蛋白(lipopolysaccharide binding protein, LBP)不同位点结合后形成LPS/LBP/mCD4复合物,发挥致炎或抗炎双重生物学效应[5-8]。LPS的类脂A与LBP的致炎位点结合,经CD14和TLR4信号跨膜转导,可使NF-κB激活移位入核向胞内传递信号,启动炎症级联反应导致炎症过度表达,发挥其致炎作用;LPS的类脂A与LBP的抗炎位点结合,则促进LPS与HDL结合,对“持续的过激的炎症反应”起到灭火作用[9]。活化转录因子3(activated translating factor 3, ATF3)即是近年新发现的一个炎症调控因子,发现其与“高密度脂蛋白(high density lipoprotein, HDL)”结合是调控炎症反应的关键[10]。在非感染性疾病,如呼吸机相关肺损伤(ventilator-induced lung injury, VILI),ATF3亦可通过降低炎症反应对肺损伤有保护作用,说明ATF3对炎症反应可能有“刹车”作用[11]。本课题组前期实验研究已证实ATF3对绿脓杆菌所致急性肺损伤小鼠的炎症反应有抑制作用,表明其对TLR4介导的信号通路有负性调控作用[12]。因此本研究继续采用绿脓杆菌所致急性肺损伤模型,探讨ATF3对绿脓杆菌所致急性肺损伤小鼠肺组织NF-κB表达的影响,为ALI/ARDS的发病机制提供理论依据,并提供可能的新的治疗靶点。
材料与方法
一、实验材料
荧光标记的绿脓杆菌,系复旦大学中山医院呼吸科宋元林教授赠送。C57BL/6(17.8~26.25 g)小鼠,SPF级,系于陆军军医大学(第三军医大学)实验动物中心购买。ATF3敲基因小鼠(18.9~24.91 g),系经美国俄亥俄州立大学Tsonwin Hai教授同意,由武汉大学模式动物协同创新中心李红良教授赠送,于陆军军医大学(第三军医大学)新桥医院动物中心饲养。小鼠适应3~4 d,随机将小鼠分为4组,分别为野生型小鼠对照组(WC组,即予野生型小鼠滴入生理盐水)、野生型小鼠急性肺损伤组(WA组,即予野生型小鼠滴入绿脓杆菌)统称WT小鼠、ATF3-KO敲基因小鼠对照组(KC组,即予敲基因小鼠滴入生理盐水)、ATF3-KO敲基因急性肺损伤组(KA组,即予敲基因小鼠滴入绿脓杆菌),统称ATF3-KO小鼠。PA滴入后分别于0、3、6、12及24 h(每个时相点5只小鼠)处理小鼠。
二、研究方法
1. 急性肺损伤小鼠模型的建立及实验设计: ①绿脓杆菌菌液的配制:从-80 ℃冰箱取出并解冻原始菌种,并接种于哥伦比亚血平板,普通三区划线后放入37 ℃孵箱中,24 h后可长出大量菌落。用接种环取适量1~2个菌落,置于无菌生理盐水中,用DL-ZD1浊度计调至0.5个麦氏单位,相当于1.5×108cfu/ml(引自卫生部规范教材《微生物学和微生物检验》第二版);②小鼠置于秤盘中称重;③麻醉小鼠:将乙醚瓶口小心打开后,取医用棉球一朵用乙醚沾湿,置于密闭的烧瓶内,随之小鼠置入烧瓶内约1 min,见小鼠被乙醚麻醉后立即取出小鼠,进行后续滴鼻操作。乙醚麻醉过程中需注意掌握时间,若麻醉时间过短则在后续操作过程中小鼠易醒影响操作,若时间过长则小鼠容易死亡;④绿脓杆菌或生理盐水滴鼻:乙醚麻醉满意后,用左手提起小鼠头颈部皮肤,头部垂直向上,右手用10 μl移液器将绿脓杆菌菌液(1.5×108cfu/ml的浓度)或生理盐水共50 μl经鼻滴入肺内,滴注过程中可见小鼠鼻孔处有气泡产生,但嘴内无液体流出,表明绿脓杆菌经过呼吸道到达小鼠肺内;⑤全身麻醉小鼠:实验设置时间点后,分别在相应时间点进行全身麻醉,用左手拇指和食指抓住颈部皮肤,固定并提起小鼠头部,小指夹住尾巴,用戊巴比妥250 mg/kg以45 ℃方向进针进行腹腔注射麻醉小鼠。小鼠皮肤较薄,在注射时注意观察药物是否外漏;⑥肺泡灌洗:待麻醉成功后,将小鼠固定于操作板上,解剖颈部以暴露气管,于气管上端剪一小口,置入气管导管,用生理盐水1 ml反复灌洗3次,留取约0.7~0.8 ml左右灌洗液于EP管中,做好标记,放置于冰箱(-80 ℃)备用;⑦收集肺组织标本:将小鼠固定于操作板上,打开胸腔,暴露肺组织,小心取下肺组织,部分肺组织行石蜡包埋、切片及HE染色,部分用于提取蛋白。
2. 小鼠肺组织病理学检查: 小鼠处理及实验分组同前。(1)肺组织石蜡包埋及切片:酒精脱水:将肺组织从4%多聚甲醛(paraformaldehyde, PFA)中取出进行梯度酒精脱水:75%乙醇、80%乙醇、90%乙醇分别脱水30 min,100%乙醇脱水两次,每次30 min;脱水透明:将肺组织置于透明剂二甲苯中进行透明两次,每次30 min,以脱出组织中酒精;浸蜡与包埋:将已透明的肺组织置于已溶化的石蜡中,随之放入60 ℃烤箱中。待肺组织完全浸于石蜡后,用石蜡包埋机进行包埋。放置于4 ℃冰箱过夜,待冷却凝固成块;切片:将包埋好的蜡块固定于切片机上,用切片机切成薄片,切片厚度约为5 μm;(2)HE染色:将切下的薄片贴到载玻片上,置于45 ℃恒温箱中烘干;脱蜡:染色前使用二甲苯脱蜡2次,每次10 min;由高到低浓度酒精梯度水化:分别于100%酒精,100%酒精,95%酒精,95%酒精水化各10 min,最后用ddH2O冲洗;苏木素水溶液中染色3 min,用ddH2O冲洗3 min;用0.5%盐酸酒精分色20 s,ddH2O冲洗1 min;用0.5%伊红染色3 min,ddH2O冲洗2 min;60 ℃恒温箱中将切片烘干,过夜;经纯酒精脱水、二甲苯透明后的切片,滴上中性树胶,盖上盖玻片封片,显微镜观察切片。
肺损伤评分按照以下三项标准进行: ①肺泡和间质水肿;②肺泡出血;③中性粒细胞浸润或聚集。每项标准又分四个等级:0=正常,1=轻度变化,2=中度变化,3=重度变化。最终的肺损伤得分为:三项标准评分的总和(总分为9)。
3. Western blot实验检测小鼠肺组织中ATF3的表达,以及检测WT小鼠和ATF3-KO小鼠分别吸入生理盐水、绿脓杆菌后6h 时肺组织P-P65、P-65、IKB-α表达的变化。
①提取总蛋白;②制胶;③上样;④蛋白电泳;⑤切胶;⑥转膜;⑦杂交(蛋白印迹):湿转后,取出PVDF膜,做好标记,进行Western blot;⑧封闭:电转结束后,将PVDF膜放入装有5%BSA的盘内进行室温下封闭,摇床上进行1 h;⑨孵育一抗;⑩孵育二抗;洗膜;显影:配制ECL发光液,取100 μl ECL显色液A液与等体积B液混匀,然后滴加至PVDF膜上,并把显色液在膜上铺匀,用凝胶成像仪进行曝光显影,并保存图像。结果统计:用Photoshop软件分析图像,以β-actin作为内参进行标准化,用Quantity One对图像进行灰度值统计。
三、统计学方法
运用SPSS13.0统计软件进行数据分析。所有数据均以均数±标准差表示。用单因素方差分析进行多组间的比较,组间的两两比较采用SNK检验。P<0.05为具有统计学意义。
结 果
一、肺组织病理变化
肺组织切片HE染色结果显示:在WT小鼠(WC组)及ATF3-KO小鼠(KC组)吸入生理盐水后,两组小鼠肺组织病理变化不明显:肺泡间隔增厚不明显,中性粒细胞浸润亦不明显,无肺泡出血。WT小鼠(WA组)及ATF3-KO小鼠(KA组)在吸入绿脓杆菌后6 h后,肺组织出现典型急性肺损伤病理变化,表现为:中性粒细胞大量浸润、肺泡结构破坏、肺泡出血、肺间质水肿。按照实验方法部分的标准进行肺组织损伤病理评分,结果显示KA组的得分要高于WA组,提示吸入绿脓杆菌后ATF3-KO小鼠(KA组)肺组织病变程度较WT小鼠(WA组)明显重。
二、WT小鼠吸入生理盐水及绿脓杆菌后时间梯度其肺组织ATF3蛋白量的表达
为了明确ATF3对于绿脓杆菌诱导的肺损伤中的作用机制,我们采用了Western biot的方法检测了ATF3在小鼠肺组织中的表达。结果显示,WT小鼠(WC组)吸入生理盐水后肺组织中ATF3各时相点表达与空白组无明显差异(P>0.05);WT小鼠(WA组)吸入绿脓杆菌后肺组织中ATF3分别于3 h及24 h处高峰,其中24 h峰值高于3 h峰值,均较空白组存在显著差异(P<0.05),见图1。

图1 WT小鼠吸入生理盐水及绿脓杆菌后时间梯度其肺组织ATF3蛋白量的表达(a,b,c,d,P<0.05)
三、WT小鼠及ATF3-KO小鼠分别吸入生理盐水、绿脓杆菌后6 h 时P-P65、P-65、IKB-α表达
为明确ATF3对绿脓杆菌诱导的ALI中肺组织NF-κB表达的影响,采用了Western biot的方法检测取6h时相点对比P65、P-P65、IKB-α的蛋白表达。ATF3-KO小鼠(KA组)吸入绿脓杆菌6 h后P-P65、IKB-α表达显著高于KC组及WA组、WC组,存在显著差异(P<0.05)。结果显示,吸入绿脓杆菌后ATF3-KO小鼠NF-κB活性表达明显增加,见图2。
讨 论
ALI/ARDS是由于各种肺内外致病因素导致的以严重呼吸困难和顽固性低氧血症和非心源性肺水肿为特征的机体炎症失控性急性临床综合征[1-2]。重度细菌感染造成的脓毒血症是ALI最常见死亡原因之一,而绿脓杆菌是导致脓毒血症中最主要的革兰氏阴性杆菌细菌,其细菌内毒素的活性成分脂多糖(lipopolysaccharide, LPS)则是ALI首位危险因素[13]。虽然通过有效抗生素及机械通气等手段治疗,但疗效欠佳,病死率仍高。ALI/ARDS发病机制尚不完全明确,其中TLR信号通路的过度激活可能是其发病机制之一,因此寻找新的针对TLR信号通路的负性调控因子非常必要。
通过借助基因组分析和生物信息学手段,从大量调控基因中筛选出的一个具有负性调控作用的转录调节基因就是ATF3,其是一个应激反应诱导下的快反应基因,在炎症信号通路中具有重要调控作用。根据既往研究报道及本研究前期实验证实,ATF3敲基因小鼠巨噬细胞可释放大量多种炎症因子(如IL-1β、IL-6、TNF-α),明显高于WT小鼠及KC对照组,提示LPS与TLR4结合时会诱导ATF3的表达,故推测ATF3对TLR4介导的信号通路有负性调控作用[12,14-16]。据最新的研究表明,巨噬细胞产生的ATF3可抑制中性粒细胞在肺内的迁移,亦提示ATF3是TLR4信号通路中的重要的负性调节蛋白,其作用的发挥可能是通过Tiam2途径[17]。在小鼠巨噬细胞中,ATF3能抑制趋化因子CCL4的表达和分泌,控制过度的炎症反应[18]。ATF3可抗衡环切力(CS)和高通气带来的炎症反应,提示其对VILI亦有保护作用[11]。上述结果及很多文献均提示ATF3可降低炎症反应,对炎症反应有“刹车”作用,是TLR4信号通路中重要的负性调控基因[14,19]。基于文献报道和前期研究结果,我们有理由相信上调ATF3的表达对急性肺损伤小鼠有保护作用,且推测ATF3可能通过负性调控炎症损伤而参与调节ALI的发生发展。
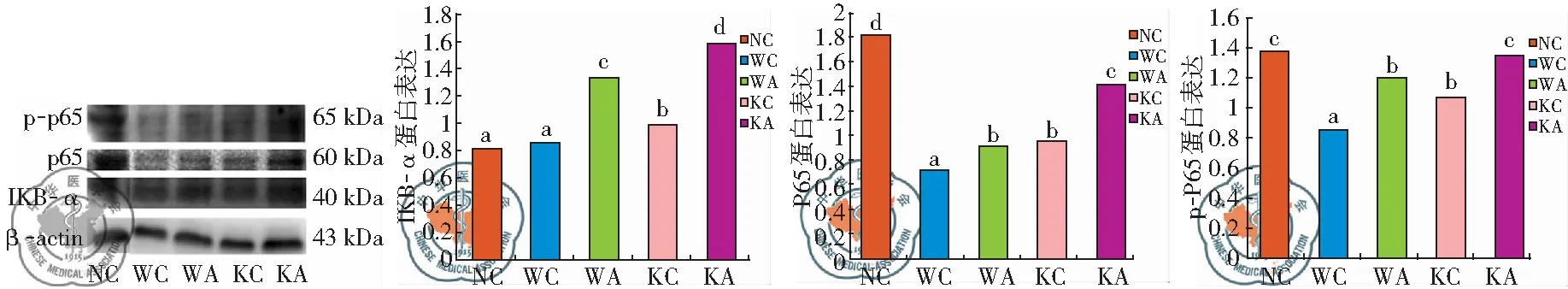
图2 WT小鼠及ATF3-KO小鼠分别吸入生理盐水、绿脓杆菌后6 h时P-P65、P-65、IKB-α表达对比(a,b,c,P<0.05)
本实验结果显示,吸入PA后肺组织炎症病理改变明显,说明本研究中采用吸入绿脓杆菌悬液诱导建立的内毒素性ALI模型是成功的。本研究的前期预实验结果发现,给予LPS腹腔注射后,ATF3 mRNA及蛋白表达高峰水平在2 h时相点,且6 h、12 h、24 h时相点表达水平仍是高于正常水平的。本试验中WT小鼠吸入生理盐水及绿脓杆菌均能诱导ATF3蛋白表达明显增加,其中生理盐水组在3 h时相点达最高峰,绿脓杆菌组在3 h、24 h时相点达最高峰,其中24 h较3 h峰值还高,均较空白组存在显著差异,上述研究结果与文献报道相一致[15,20-22]。再次证实了ATF3在应激信号出现后其mRNA水平能迅速提高这一现象,存在ATF3表达上调的适应性反应[23-27]。前期研究亦提示ATF3在绿脓杆菌诱导的ALI小鼠肺泡灌洗液中能够抑制炎症因子的表达,均证实了上调ATF3能负性调控绿脓杆菌诱导的ALI的肺组织炎症损伤[12]。
以上的实验结果提示ATF3对ALI有保护作用,而ATF3对ALI的保护作用则应归因于其对TLR4信号通路的负调控作用。ATF3诱导机制较复杂,涉及多种信号转导途径。而氧化应激和TLR4信号通路是急性肺损伤发生发展的关键途径[28]。Nguyen等[29]研究证实,ATF3被诱导而表达上调是通过TLR4下游的JNK/c-jun信号通路。为了进一步探讨ATF3对于绿脓杆菌诱导的ALI的作用机制,我们采用了Western biot的方法检测了NF-κB在小鼠肺组织中的活性表达。本文结果显示,吸入绿脓杆菌后ATF3-KO小鼠NF-κB的活性表达明显增加,且在6 h时相点达高峰,与既往报道相一致[15,21]。本文上述结果提示在绿脓杆菌诱导所致ALI中,ATF3负性调控炎症反应可能是通过TLR4/NF-κB信号通路所完成。鉴于以上结果和文献报道,提示TLR4/NF-κB信号通路可能是ATF3调控ALI肺部炎症损伤的途径之一[30]。
综上所述,前期研究证实了ATF3对绿脓杆菌所致ALI小鼠有保护作用,即对过激炎症反应有负性调控作用,而本研究则证实其作用机制可能是ATF3作用于巨噬细胞TLR4/NF-κB信号通道,从而发挥负性调控作用。这些结果提示上调ATF3的表达有望成为治疗ALI的潜在靶点。
致谢:感谢复旦大学中山医院呼吸科宋元林教授赠送的荧光标记的绿脓杆菌,感谢武汉大学李红良教授赠送的ATF3敲基因小鼠。

