开菲尔粒中干酪乳杆菌的分离鉴定及发酵性能分析
巩小芬,严琪钰,王雨童,王江月,高恩燕,张恩鹏,刘朋龙,王亮
(1.江苏大学食品与生物工程学院,江苏镇江212013,2.新疆天润生物科技股份有限公司,乌鲁木齐830088)
0 引 言
干酪乳杆菌最初是由日本学者从健康人体肠道中分离,是国际上公认的益生菌,早在2001年就被我国卫生部列为可食用菌种[1]。研究表明干酪乳杆菌发酵乳能够维持肠道益生菌群多样性[4],改善便秘[5]、提高人体免疫力[6],治疗迟发型超敏反应[7]。目前我国在优良干酪乳杆菌选育方面的文献报道较少,市场缺乏具有自主知识产权干酪乳杆菌,因此开展野生干酪乳杆菌的分离鉴定及选育具有重要的意义。开菲尔粒[8]
是由乳酸菌、酵母菌、醋酸菌等菌种组成的共生体系,干酪乳杆菌是开菲尔粒中的优势菌种[9,10]。本研究以新疆不同地区来源的开菲尔粒为分离源,分离鉴定干酪乳杆菌,并通过对其发酵性能的分析进行逐级筛选,以期为益生菌发酵乳的生产提供优质干酪乳杆菌。
1 实验
1.1 材料与试剂
材料:开菲尔粒,采集于新疆乌鲁木齐、喀什、伊犁等地区;生牛乳,本地农户采集。
试剂:琼脂糖,引物,LA酶M ix,溴化乙锭,TE缓冲液,细菌DNA提取试剂盒;邻苯二甲醛;邻苯二胺,亮氨酸,双乙酰;MRS培养基;LC培养基。
1.2 仪器与设备
541 8R小型高速离心机,PCR仪,琼脂糖凝胶电泳仪,N i全自动正置荧光显微镜,UV-1601紫外分光光度计,Syngene GeneGenius凝胶成像系统,H-1580R高速冷冻离心机,HP6890/5973气相色谱-质谱联用仪,SPMC-57328顶空固相微萃取,TA.XT plus质构仪。
1.3 方法
1.3.1 开菲尔粒的活化
将采集的开菲尔粒滤去培养液,无菌生理盐水冲洗干净,以质量浓度为50 g/L的接种量接种于95℃(30 min)灭菌的脱脂乳中[11],转速为140 r/m in,28℃培养24 h。循环培养6次至pH值稳定[12]。
1.3.2 稀释液的制备
取上述pH值稳定的开菲尔培养液5 m L注入45 m L灭菌生理盐水中,同时将活化后的一粒开菲尔粒(约1cm3)经无菌研磨后置入灭菌生理盐水;溶液加入玻璃珠并用旋涡混匀器将充分混匀,制成初次稀释液。取初次稀释液1 m L注入9 m L灭菌生理盐水中,用吸管反复吹打,使菌体分布均匀。重复上述操作步骤,直至稀释倍数达到105~107,作为菌种接种液备用[13]。
1.3.3 干酪乳杆菌的分离
将上述接种液涂布于LC培养基,27℃厌氧培养72 h[14],镜检后挑取革兰氏染色阳性、过氧化氢阴性的杆状细菌菌落转接到M RS固体培养基,37℃培养72 h。选择白色圆形、表面光滑湿润、边缘整齐、中间凸起的菌落作为实验目标菌落。
1.3.4 干酪乳杆菌的分子生物学鉴定
将目标菌落扩培,用Ezup柱式细菌基因组抽提试剂盒提取其总DNA。对提取的DNA进行16S rDNA PCR扩增。引物为细菌通用引物:27F(agagtttgatcctggctcag);1492R(tacggctaccttgttacgactt)。PCR反应条件如表1所示。

表1 PCR反应条件
PCR扩增产物用1.0%琼脂糖凝胶进行电泳检测,选择M arker基因1500bp位置有清晰条带的待测菌株扩增产物送生物公司进行基因测序。将基因测序结果在Genbank检索系统,进行基因序列BLAST比对和同源性分析,软件M EGA 5.10构建系统发育进化树。
1.3.5 发酵乳的制备
生牛乳→灭菌→冷却→添加7%蔗糖→接种3%待测菌种接种液→37℃静置培养至凝乳→4℃后熟24 h→发酵性能指标测定。
1.3.6 干酪乳杆菌的初筛
1.3.6.1 发酵乳酸度及活菌数测定
参照国标GB5413.34-2010和GB4789.35-2016规定的检测方法,测定发酵乳酸度及活菌数。
1.3.6.2 持水力测定
取10 g发酵乳,4℃条件下,转速为10 000 r/m in离心20 min,上清液称重。发酵乳4℃贮藏0,7,14,21 d测定其持水力数值变化。持水力为

式中;W1为上清液质量;W2为样品质量。
1.3.7 干酪乳杆菌的复筛
实验以发酵乳中乙醛[15]、双乙酰[16]、氨基氮[17-18]质量浓度作为评价指标,对初筛选定的干酪乳杆菌进行发酵性能评估,进一步筛选优质干酪乳杆菌菌株。
1.3.8 干酪乳杆菌的第三次筛选
1.3.8.1 干酪乳杆菌发酵乳质构特性的测定
发酵乳质构特性包括硬度、稠度、凝聚性、黏性指数等指标,实验选用质构仪对干酪乳杆菌发酵乳进行测定[19]。测定条件如表2所示。

表2 发酵乳质构特性测定条件
1.3.8.2 干酪乳杆菌发酵乳挥发性香气成分测定
实验采用固相微萃取-气相色谱-质谱联用法(SPM E-GC-M S)测定[20]。
GC条件:程序升温方式,由常温升至40℃,40℃保持2.5 min,后以5℃/m in升温速率至200℃,再以10℃/m in速率升至230℃,230℃保持5 min。进样口温度250℃;传输线温度230℃;载气为He气,流速1.0m L/m in;不分流进样。
M S条件:电离方式EI,70 eV;离子源温度为230℃,质量扫描范围35~400 am u;发射电流100μA,检测电压1.4 kV。
1.3.8.3 干酪乳杆菌发酵乳感官评价
针对不同干酪乳杆菌的发酵乳,邀请具有专业经验的20名人员,进行感官评定分析,评价标准[12]见表3。
1.4 数据处理
每个实验重复3次,实验结果取三次的平均值,数据采用SPSS 19.0进行统计分析,Excel2010作图。
2 结果与分析
2.1 干酪乳杆菌形态学鉴定
分离得到15株乳酸菌,其菌落均为白色圆形、表面光滑湿润、边缘整齐、菌体形状为短杆状,革兰氏染色阳性、过氧化氢酶阴性,镜检后初步判定为干酪乳杆菌,形态特征如图1所示。
图1中,图A为目标菌在LC培养基菌落形态图;图B为目标菌在M RS培养基形态图;图C为目标菌革兰氏染色图400×。

表3 感官评定细则

图1 目标菌形态特征
2.2 干酪乳杆菌分子生物学鉴定
15株乳酸菌DNA PCR扩增,扩增产物1.0%琼脂糖凝胶电泳,如图2所示,目标菌DNA扩增条带均在1400~1600bp之间,与干酪乳杆菌DNA通用引物PCR扩增结果相同,说明15株乳酸菌扩增成功,可用于序列测定。

图2 16S rDNA片段PCR扩增产物琼脂糖凝胶电泳结果
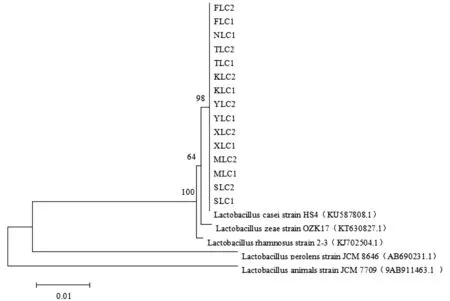
图3 15株干酪乳杆菌系统发育树
将15株乳酸菌测序结果与GenBank中已知序列进行基因BLAST比对,15株菌与Lactobacillus casei strain HS4(KU 587808.1)的亲缘关系较近,基因序列同源性均达到100%,因此15株菌确定为干酪乳杆菌。系统发育树构建如图3所示。
2.3 优良干酪乳杆菌菌株的筛选
2.3.1 优良干酪乳杆菌的初筛
2.3.1.1 发酵乳酸度及活菌数测定
酸度是影响发酵乳品质的最重要因素,酸度70~110°T为最佳。发酵乳的酸度及活菌数测定结果如表4所示。由表4可以看出,干酪乳杆菌菌株M LC 2,YLC 1,TLC 1,FLC 1的发酵乳;其酸度均超过110°T,严重影响了发酵乳的品质。其余11株干酪乳杆菌发酵乳的酸度范围均在最佳酸度范围之内,实际酸度测定结果为82.01~101.17°T。15种干酪乳杆菌发酵乳的活菌数均达到了108m L-1,均符合国标对发酵乳中最低活菌数的规定(106m L-1)。
2.3.1.2 发酵乳持水力的测定
持水力同样也是发酵乳品质的一个重要评价指标。持水力与发酵乳的粘度成正比,胞外多糖产量高的菌株粘度高,持水力强;发酵乳持水力过低或贮藏期间持水力下降会导致乳清析出,从而直接影响发酵乳的组织状态与口感[21]。图4显示,除M LC 2,XLC 1,TLC 1,TLC 2,FLC 1外,剩余10株菌的发酵乳在21天贮藏期内持水力均无显著性降低且保持在50%以上,优于高微娟[22]、张睿[23]的文献报道,说明持水力较好,可用于发酵乳制品的生产[22]。
图4中,a,b,c,d字母不同表示差异显著(P<0.05)。综合发酵乳酸度、活菌数以及贮藏期间持水力变化三个指标,9株干酪乳杆菌发酵乳酸度在最佳酸度范围内,活菌数符合国标要求,持水力较高且贮藏期间稳定,因此选择这9株干酪乳杆菌SLC 1,SLC 2,M LC 1,XLC 2,YLC 2,KLC 1,KLC 2,N LC 1,FLC 2用于后续发酵性能的研究。

表4 发酵乳的酸度及活菌数测定结果
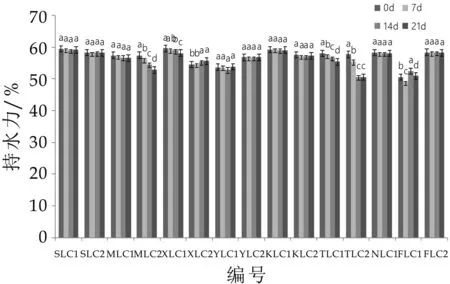
图4 发酵乳贮藏期间持水力变化
2.3.2 优良干酪乳杆菌的复筛
2.3.2.1 乙醛、双乙酰质量浓度测定
乙醛、双乙酰是发酵乳香气成分两个最重要的评价指标,研究表明[24]发酵乳中乙醛和双乙酰质量浓度分别达到5 m g·L-1和1 m g·L-1时,发酵乳呈现出特有的香味。乙醛质量浓度在5~21 m g·L-1范围内,质量浓度越高发酵乳风味越好[25];然而当发酵乳中乙醛质量浓度超过30 m g·L-1时会产生令人不愉的气味,同时双乙酰质量浓度过高也会使发酵乳风味不佳[24]。乙醛、双乙酰质量浓度在最佳浓度范围内,乙醛与双乙酰比例大于3:1时,比例越大发酵乳风味越优[26]。图5表明,除N LC 1外,有8株发酵菌发酵乳乙醛与双乙酰的质量浓度比例均大于3:1,其中4株干酪乳杆菌SLC 1、XLC 2、KLC 1、KLC 2发酵乳乙醛质量浓度均在5~21 m g·L-1范围内,说明这4株菌具有较好的产香能力。
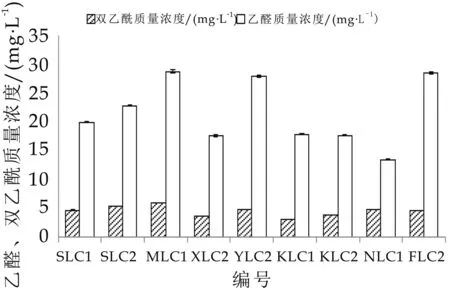
图5 乙醛、双乙酰质量浓度
2.3.2.2 氨基氮质量浓度测定
氨基氮质量浓度是衡量发酵乳营养成分重要指标,直接反映了发酵乳中小分子肽和游离氨基酸的质量浓度,质量浓度越高,表明发酵乳营养成分越易于被人体吸收,同时也间接影响发酵乳的口感和风味[27]。由图6可以看出,9株干酪乳杆菌中,4株菌SLC 1,XLC 2,KLC 1,KLC 2发酵乳的氨基氮质量浓度为621.40~684.90 mg/L,远优于传统乳酸菌发酵乳的氨基氮质量浓度409.50 m g·L-1[27],也优于药璐等人将传统乳酸菌发酵剂与干酪乳杆菌混合发酵的发酵乳氨基氮质量浓度500.88 mg/L[28],表明上述4株干酪乳杆菌具有较强的乳蛋白分解能力。而其余5株干酪乳杆菌SLC 2,M LC 1,YLC 2,N LC 1,FLC 2发酵乳氨基氮质量浓度为390.40~497.40 m g/L,蛋白质分解能力虽与文献报道[27-28]的菌株相近,但低于最优的4株干酪乳杆菌分离菌株,这种蛋白质分解能力的差异,可能源于菌株的来源、生长环境不同,从而菌株产生的蛋白酶活力或浓度不同造成的。
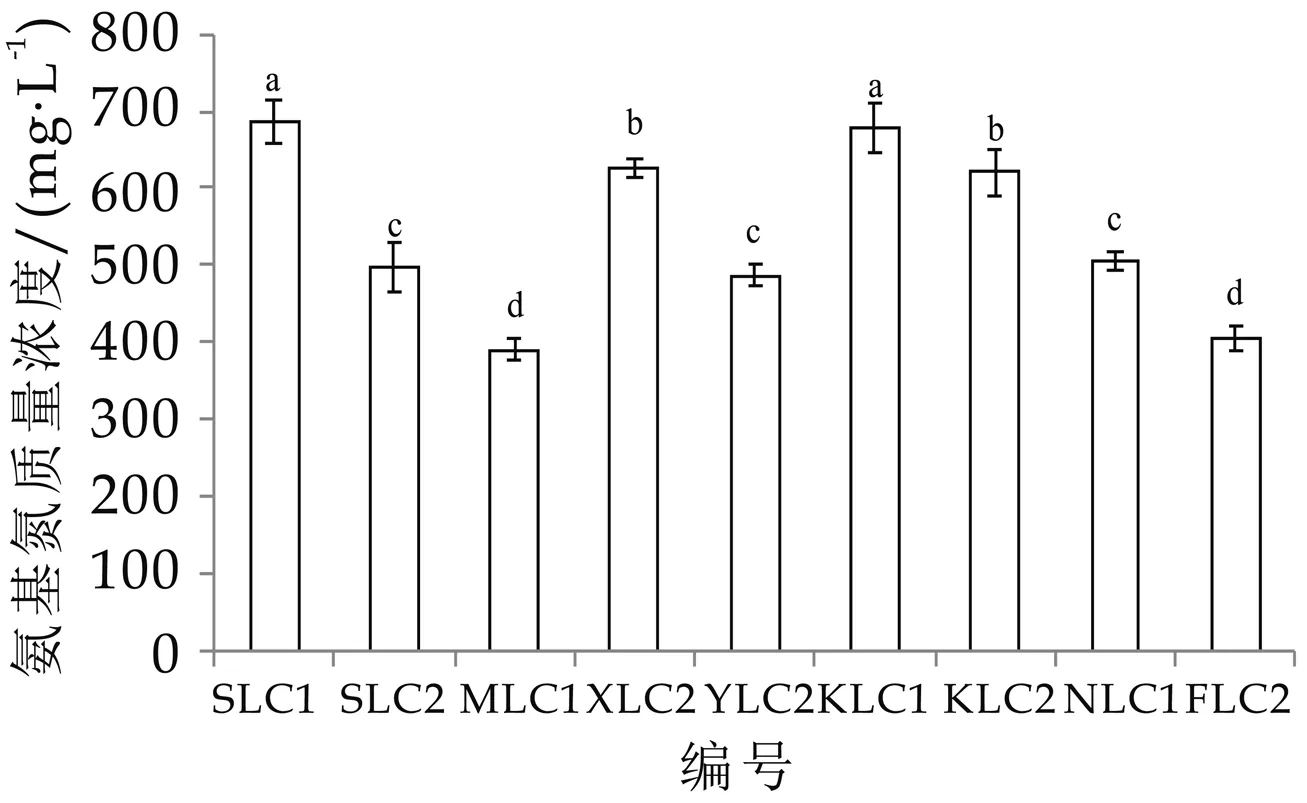
图6 氨基氮质量浓度
4株干酪乳杆菌SLC 1,XLC 2,KLC 1,KLC 2发酵乳在主要风味成分乙醛、双乙酰质量浓度以及氨基氮质量浓度方面指标较好,因此选取以上4株干酪乳杆菌进行发酵乳质构测定及挥发性香气成分分析。
2.3.3 优质干酪乳杆菌第三次筛选
2.3.3.1 发酵乳质构特性测定
利用质构仪可以对发酵乳的硬度、稠度、凝聚性及黏性指数等指标进行量化性的测定,测定结果具有较高的灵敏度、客观性及可比性。四种发酵乳的质构特性如表5所示,可以看出,4种发酵乳的硬度无显著差异(P>0.05),均处于发酵乳较佳的硬度范围[29]33.9~39.9 g,这个范围的发酵乳硬度最容易为消费者所接受。KLC 2的稠度显著高于另外三种,说明该菌株发酵过程中产胞外多糖少,发酵乳爽滑性和细腻度较差[30-31]。菌株SLC 1和KLC 1发酵乳的凝聚性与黏性指数均高于XLC 2与KLC 2,差异显著(P<0.05),表明SLC 1与KLC 1产胞外多糖较多、凝胶网络结构较好[29],从而判定这两株菌的发酵乳在质构方面优于XLC 2与KLC 2。
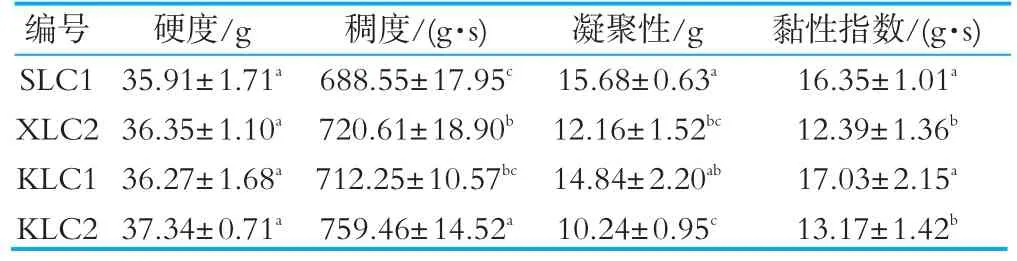
表5 不同发酵乳的质构特性
2.3.3.2 发酵乳挥发性香气成分分析
挥发性香气成分是影响发酵乳风味重要因素之一,香气成分丰富[32]与否在一定程度上决定发酵乳的风味优劣。王伟君[33]等人报道发酵乳中主要的挥发性成分有酸类、酮类、醛类、酯类、醇类五种。干酪乳杆菌发酵乳的挥发性香气成分测定结果如表6所示,4种发酵乳挥发性香气成分除常见的5种物质成分外,还有烯烃类。
挥发性酸的种类影响发酵乳的爽口感,干酪乳杆菌SLC 1、XLC 2的发酵乳均含有四种酸,比KLC 1、KLC 2丰富。酮类赋予发酵乳浓郁的奶香味和黄油味,使发酵乳整体风味丰满。4株干酪乳杆菌发酵乳中,SLC 1酮类物质相对质量分数高、种类多,共检测出七种酮类物质,其余3株干酪乳杆菌发酵乳最多检测出4种(XLC 2、KLC 2四种,KLC 1三种),说明菌株SLC 1比其他3株干酪乳杆菌发酵乳酮类物质种类更丰富。醛类物质是发酵乳中非常重要的风味物质,其感知阈值较低。由表6可以看出,4株干酪乳杆菌发酵乳中醛类物质相对质量分数都达到了10%以上,其中干酪乳杆菌SLC 1、KLC 1发酵乳中醛类物质种类较丰富,均含有乙醛、2-甲基丁醛、苯甲醛三种醛类,优于XLC 2与KLC 2。酯类物质感知阈值较低,大都表现出果香味。由表6可知,4株干酪乳杆菌发酵乳中所含酯类的种类差别很大,SLC 1发酵乳所含酯类种类较多,相对质量分数较高,优于XLC 2、KLC 1、KLC 2。发酵乳中的醇类主要来源于糖类、氨基酸以及醛类的还原反应。干酪乳杆菌体内含有的乙醛脱氢酶能将乙醛转化为乙醇,乙醇具有特殊的、令人愉快的酒香味。3-甲基丁醇检测阈值较低,具有白兰地的味道,是国标GB2760-86中规定的可以食用的香料。由表6可知,SLC 1发酵乳中检测到了乙醇、3-甲基丁醇、三乙二醇和2-乙烯氧基乙醇四种醇类物质,在4株干酪乳杆菌发酵乳中所含醇类物质种类最丰富,而菌株KLC 1发酵乳中仅检测到了乙醇和戊乙二醇,菌株KLC 2只检测到了乙醇,菌株XLC 2发酵乳未检测到醇类物质。烯烃类物质α柏木烯和α-蒎烯可用作香料成分,菌株XLC 2发酵乳仅含有α柏木烯,其余3株干酪乳杆菌发酵乳均检测到了α柏木烯和α-蒎烯,其中菌株SLC 1发酵乳烯烃类物质相对质量分数最高。

表6 发酵乳中挥发性成分的GC-MS分析结果
综上所述挥发性香味成分对比分析中,SLC 1发酵乳所含挥发性香味成分(酸类、酮类、醛类、酯类、醇类、烯烃类物质)的种类最为丰富。
2.3.3.3 发酵乳感官评价
感官评价主要从颜色、组织状态、口感、风味4个方面对发酵乳的品质进行综合评价,4株干酪乳杆菌发酵乳感官评价结果如表7所示。

表7 发酵乳感官评价结果
4株干酪乳杆菌发酵乳的颜色均呈乳白色且无乳清析出和气泡产生,因此颜色、组织状态差异不显著,均达到国标对发酵乳品质感官评价的要求。口感方面,针对爽口、酸甜两个指标,SLC1、KLC1具有较好的爽口感,酸甜适宜,口感表现最优,XLC 2、KLC 2则与之差异显著,口感表现不突出。4株干酪乳杆菌发酵乳口感表现为SLC 1>KLC1>XLC 2>KLC 2,SLC 1口感最好。香气成分方面,SLC 1发酵乳香气成分层次最为丰富,与其他3株干酪乳杆菌发酵乳相比,具有显著性差异,SLC 1发酵乳风味表现最优,与GC-M S测定结果相吻合,表明发酵乳中挥发性香气成分种类越丰富,发酵乳的风味越好。综合上述结果,菌株SLC 1发酵乳在颜色、组织状态、风味、口感等方面总体表现最佳。
2.4 4种发酵乳主成分分析及评价
以发酵乳的香气成分(乙醛、双乙酰、酸类、酮类、醛类、酯类、烯烃)和口感(酸度、持水力、氨基氮、硬度、稠度、凝聚性、黏性指数)为指标进行主成分分析。提取前3个主成分的特征值和贡献率(如表8所示),累计贡献率可达到100%。前3个主成分代替原有14个指标可充分评价发酵乳的综合品质[34],每个主成分占3个主成分总贡献率的多少(%)作为权数,按照公式

计算主成分综合得分,F=0.4626F1+0.2889F2+0.2184F3;其中 F1,F2,F3分别为前3个主成分得分值。发酵乳综合得分如表9所示,4株干酪乳杆菌发酵乳的综合得分由高到低依次为SLC 1>KLC 1>XLC 2>KLC 2,与感官评价结果一致,说明该综合评价模型可靠,表明SLC 1综合指标最优。

表8 提取主成分的特征值及贡献率
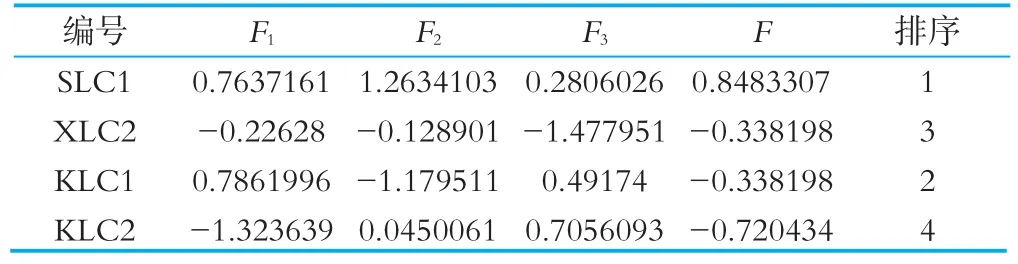
表9 发酵乳综合评价得分
3 结 论
来源于新疆不同地区的8种开菲尔粒,从中分离鉴定出15株干酪乳杆菌。针对15株菌进行了发酵乳的酸度、活菌数、持水力、乙醛、双乙酰、氨基氮等指标的分析,初步筛选出4株发酵性能较好的干酪乳杆菌,分别为SLC 1,XLC 2,KLC 1,KLC 2;4株菌各项发酵性能指标均符合国标要求,蛋白质分解能力尤其突出,远优于现有文献报道的干酪乳杆菌[28]。而后针对4株干酪乳杆菌进行了发酵乳的硬度、稠度、凝聚性、黏性指数等质构特性测定,发现菌株SLC 1和KLC 1发酵乳的的质构特性指标较为突出;挥发性香气成分分析、SLC 1香气成分最为丰富。最后通过主成分分析建立了发酵乳香气成分与口感指标的综合评价模型F=0.6128F1+0.2764F2+0.1109F3,4株干酪乳杆菌发酵乳综合得分从高到低依次为SLC 1>KLC 1>XLC 2>KLC 2,与感官评价结果一致,从而表明15株干酪乳杆菌中菌株SLC 1综合发酵性能最优,可用于发酵乳制品工业化生产,或作为益生乳制品复合发酵剂的配伍菌种用于工业化生产。

