繁殖群体量及种子老化对红麻种质遗传完整性的影响
戴志刚,王凤敏,杨泽茂,卢瑞克,粟建光*
(1.中国农业科学院麻类研究所,长沙410205;2.河北省农林科学院粮油作物研究所,石家庄050035)
红麻(Hibiscus cɑnnɑbinus L.)属锦葵科木槿属一年生草本植物,重要的韧皮纤维作物。据报道,红麻自然杂交率在1.8%~23.7%之间[1],属于常异花授粉作物,在其繁殖更新过程中比自花授粉作物更易受到繁殖群体大小、繁殖种质生活力、繁殖世代数和授粉方式等因素的影响,从而失去原有种质的遗传完整性[2-3]。红麻种子中富含蛋白质(26.1%~29.9%)和脂肪(21.3%~24.2%)[4],与其它作物种子相比更易发生劣变[5]。因此,红麻在贮存和更新过程中易受低发芽率、高异交率、繁殖群体量、授粉方式、收获方式、繁殖世代数和选择压力等因素的影响而使其遗传完整性发生改变。随着贮存时间的延长,确保库存种质的安全保存是种质库管理者面临的最大难题,而安全保存的最核心课题是确保种质及时更新并维持其遗传完整性[6]。目前在大豆[5,7]、蚕豆[2]、玉米[8-9]、高粱[10]、烟草[11]、棉花[12-13]、牧草[14]、小麦[15]、黑麦[15]、花椰菜[16]等作物中关于繁殖群体量和种子老化对种质遗传完整性影响方面的研究报道较多,而关于红麻种子老化机理仅有不同湿度贮藏的研究报道[17]。关于红麻种质资源繁殖更新理论及其技术标准,国内外尚没有明确规定,对于红麻种子贮存过程中一些生理生化指标、遗传完整性影响因子等方面的研究甚少。因此,开展更新过程中繁殖群体量及种子老化对红麻种质遗传完整性的影响研究,具有非常重要的理论和实践意义。
本研究首先利用形态标记的方法,对不同繁殖群体量更新子代样本与原样本的叶形和茎色两个特异标记性状进行表型遗传完整性分析,初步拟定适宜的繁殖群体量,其次通过人工加速老化的方法模拟种子自然劣变老化,分析老化处理后种子生活力的变化和RAPD分子标记检测不同老化处理材料的等位基因频率,探究贮藏过程中红麻种子生活力变化规律及其遗传完整性的变化,旨在为红麻种质的安全保存、科学更新和品种提纯提供参考。
1 材料与方法
1.1 试验材料
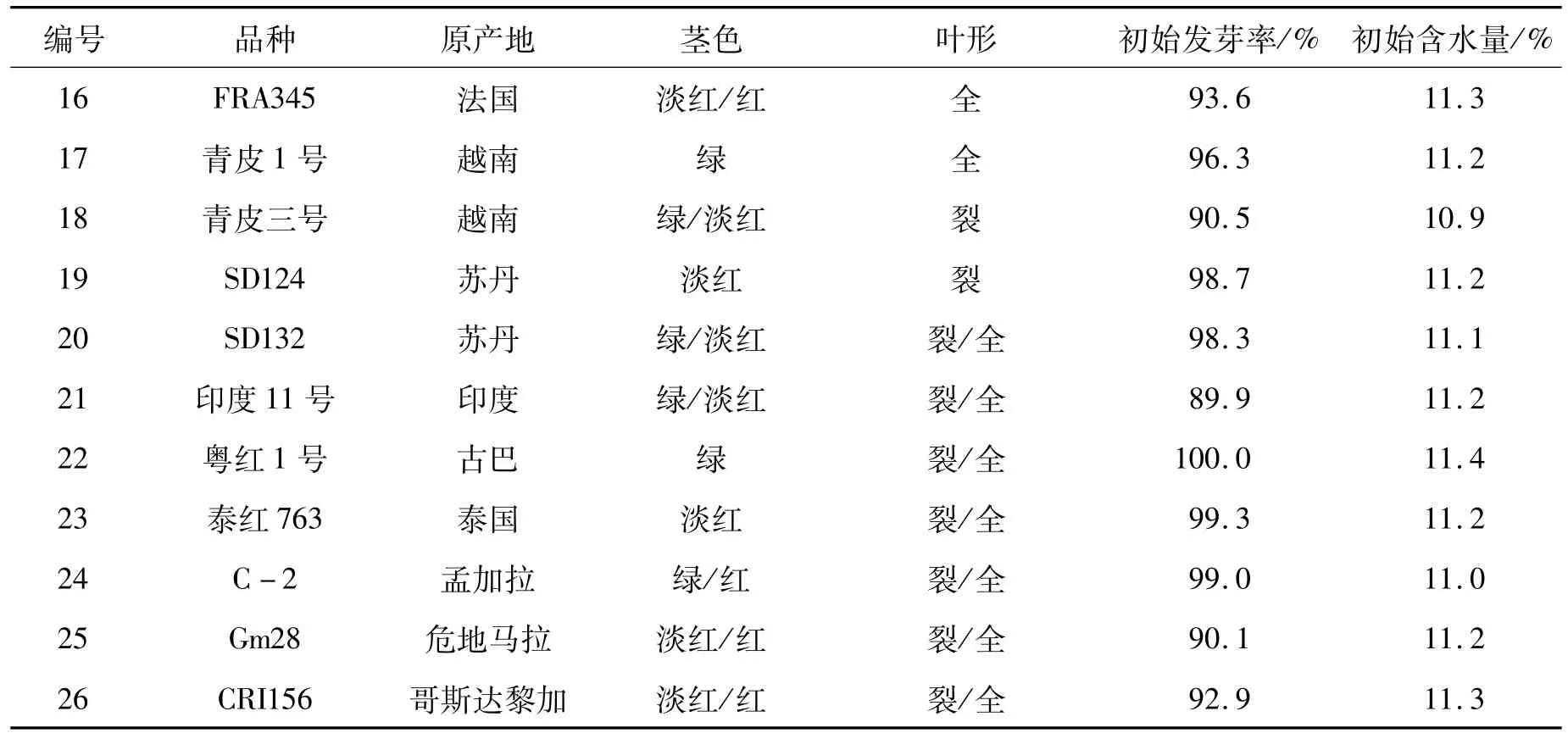
本试验于2009年11月至2010年4月在海南三亚完成不同繁殖群体样本的繁种试验,参试种质26份,均由国家麻类种质资源中期库(国家麻类种质资源平台)提供,基本信息见表1。每份种质设立50、100、150、200株4个繁殖群体量,获得不同繁殖群体的更新子代样本。2010年5月至9月在中国农业科学院麻类研究所沅江实验基地完成了不同繁殖群体更新子代样本与原样本的叶形和茎色两个形态性状的调查与分析。
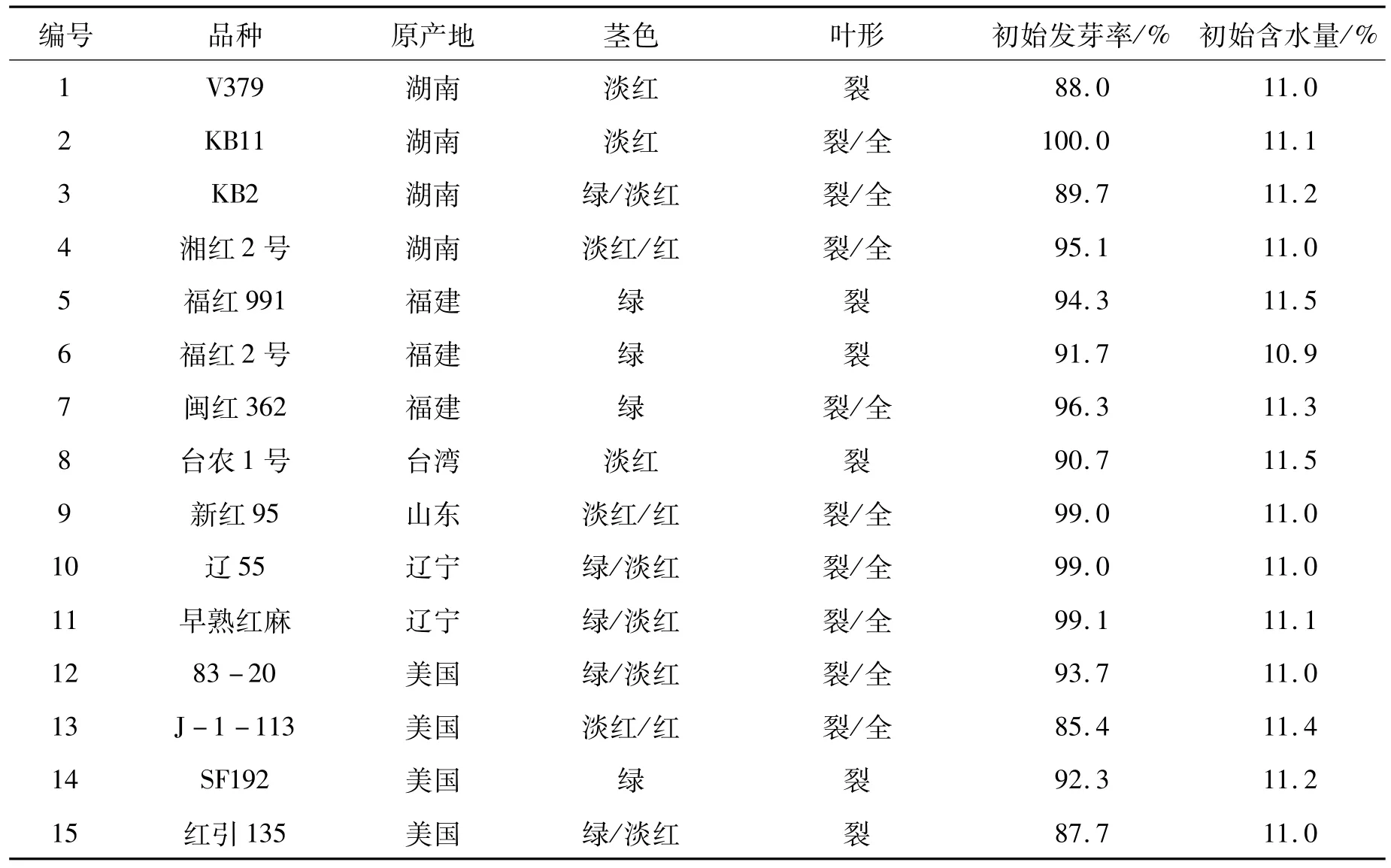
表1 供试材料的基本信息Tab.1 Basic information of tested materials
续表1
1.2 试验方法
试验材料中选取15份做老化处理,利用烘干法测定红麻种子的初始含水量。用LH-150S种子老化箱采用高温高湿的方法进行老化处理,温度为(44±1)℃,箱体内相对湿度95%。老化时间分别为0、20、40、60、80、100、120、140 h,处理完毕取出种子在室温下晾 3~4 d,使种子含水量降至初始含水量后进行各项发芽指标测定。发芽试验参照GB/T3543-1995。种子每皿100粒,3次重复,发芽温度为25℃。第2 d统计发芽势,第8 d统计发芽率。
各指标计算公式如下[18]:
发芽指数(GI)=Σ(Gt/Dt)
活力指数(VI)=GI×Sx
其中Gt为t天后的发芽数,Dt为发芽天数,Sx为发芽x天后的幼苗干重。
从老化处理材料中选取辽55、83-20和台农1号3份种质,利用RAPD标记检测不同老化处理与对照的遗传完整性差异。RAPD扩增体系为反应总体积25μL,各反应组分的终浓度如下:Buffle缓冲液(Mg+)2.0 mmol/L,dNTPs 0.2 mmol/L,Taq酶 0.04 U/μL,引物 0.4μmol/L,模板DNA 50 ng。扩增程序如下:94℃预变性5 min,94℃变性30 s,38℃退火45 s,72℃延伸90 s,40个循环,72℃终延伸7 min,4℃保存。
经PCR扩增后,产物用1.5%琼脂糖凝胶电泳分离,电泳缓冲液为1×TAE,用EB染色,最后用凝胶成像系统观察并拍照记录。筛选出23条引物序列。以辽55、83-20和台农1号3份材料的基因组DNA为模板,利用筛选出的23条RAPD标记引物对3份种质老化后的材料和对照进行扩增。记录扩增的条带数(1个条带为1个等位基因),以同一种质未老化的材料作对照(等位基因频率为100%),计算不同处理材料的等位基因频率,并用t-测验进行差异显著性分析。
1.3 数据处理
采用统计分析软件Excel、SAS对数据进行分析。
2 结果与分析
2.1 繁殖更新的适宜群体数量
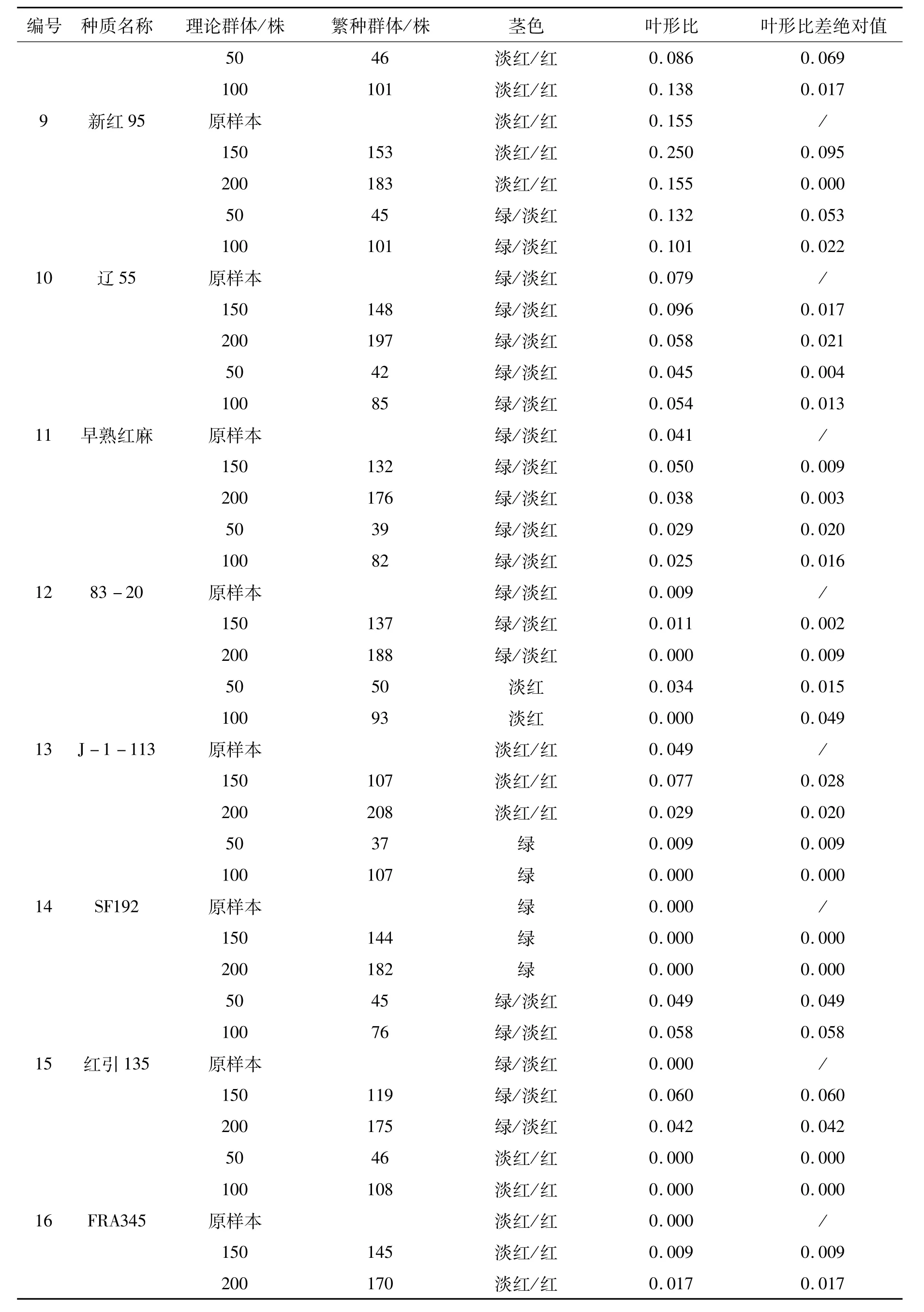
在大田繁殖更新过程中,受种子生活力、病虫危害、环境等因素影响,难以使实际繁殖群体量和设计值一致,但差异不大(见表2)。
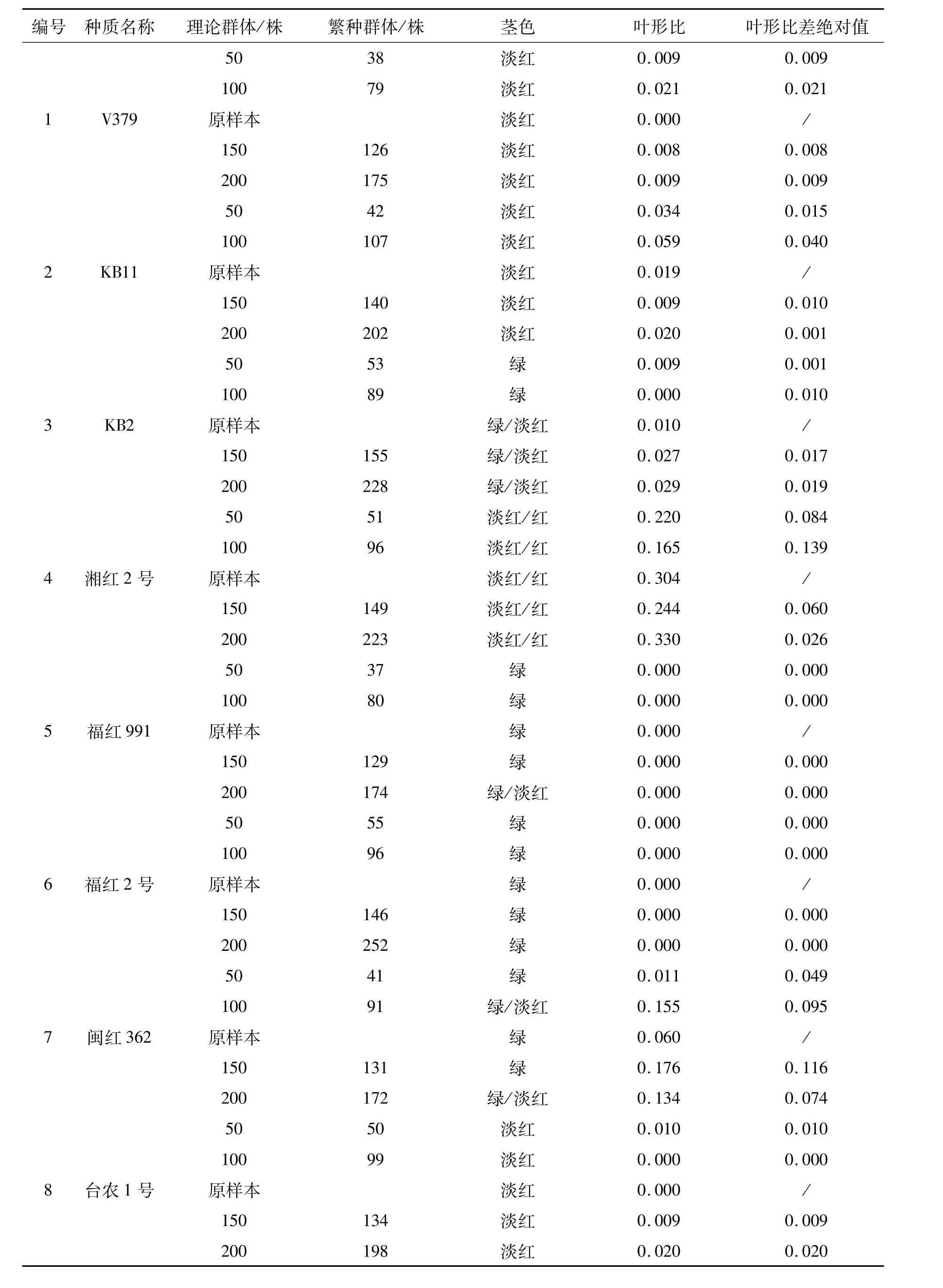
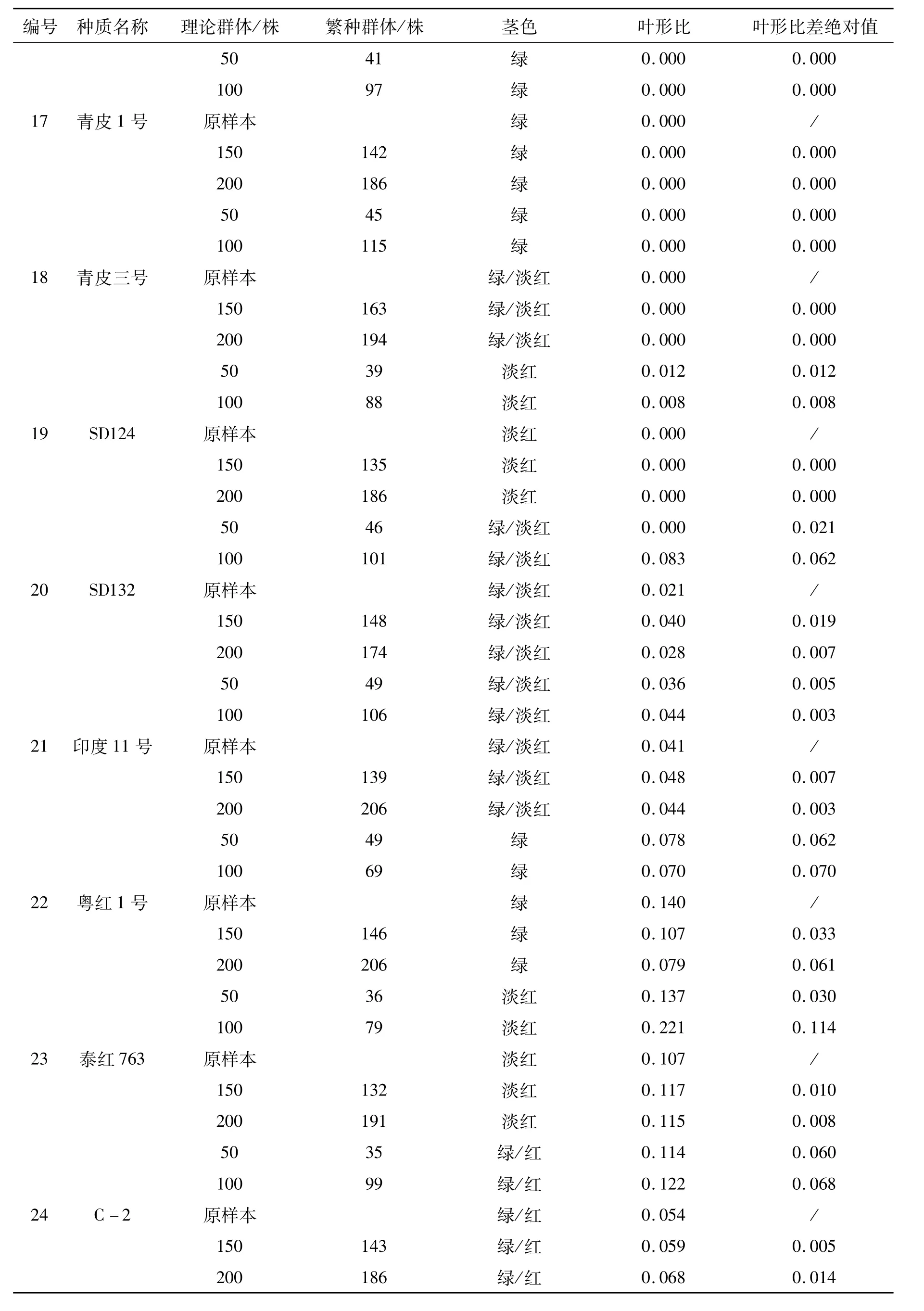
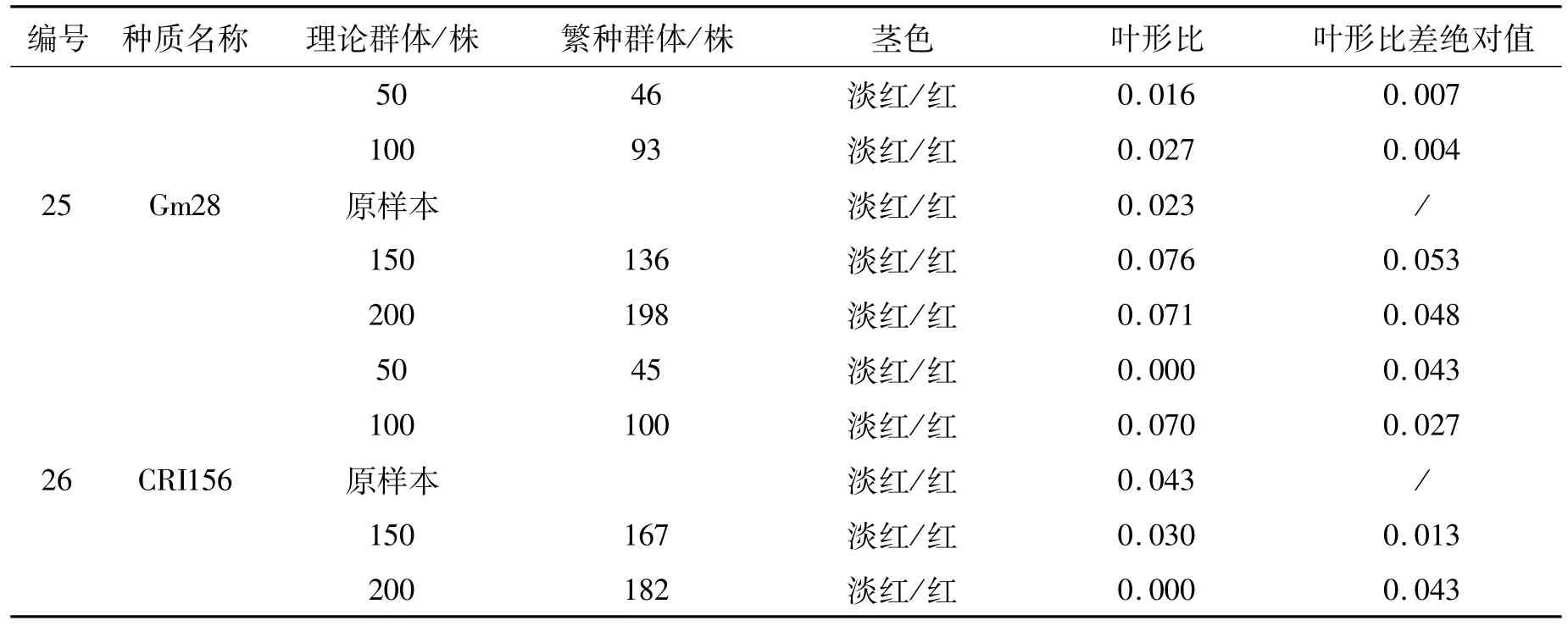
表2 26份红麻种质更新子代与原样本农艺性状Tab.2 Agronomic characteristics of progeny and original sample from 26 accessions of kenaf germplasm
续表2
续表2
续表2
红麻叶形分为全叶和裂叶两种类型,小区内两种叶形株数的比值(叶形比)反映了群体的遗传结构。叶形比差绝对值是指各更新子代与原样本叶形比差值的绝对值,该值越小,表明更新子代样本与原样本的遗传完整性越接近。因此,通过叶形比差绝对值可以判断各更新子代群体与原样本群体遗传结构的一致程度。通过表1、2的比较,26份材料原样本的茎色和叶形原始数据与2010年沅江田间鉴定数据一致,表明原样本在表型上保持了原始种质的遗传完整性。从表2可以看出,叶形比差绝对值范围在0.000~0.139之间。其中:福红2号、福红991、青皮三号和青皮1号4份材料各更新子代叶形比差绝对值均为0.000,表明遗传完整性没有改变;V379、KB11、湘红2号、SF192、早熟红麻、83-20、J-1-113、C-2、新红 95、辽 55、SD124、SD132、泰红 763和粤红 1号14份材料200株和150株群体的叶形比差绝对值较100株和50株群体的小,表明200株和150株更新子代群体的遗传结构较100株和50株更接近原样本;而红引135、CRI156、闽红362和印度11号4份材料不同繁殖群体的叶形比差绝对值没有规律,以及KB2、FRA345、Gm28和台农1号4份材料200株和150株群体的叶形比差绝对值较100株和50株群体的大,这可能是红麻的高异交率特性导致群体内含有杂株造成的。
红麻茎色有红色、淡红、绿色等类型。结果表明V379、KB11、红引135、CRI156、Gm28等21份材料各更新子代群体茎色与原样本一致,遗传完整性没有改变;KB2、J-1-113和青皮三号3份材料200株和150株更新子代群体茎色与原样本一致,而100株和50株更新子代群体茎色类型减少,发生了基因丢失,表明200株和150株更新子代群体较100株和50株更能保持原样本的遗传结构,即更接近原样本群体的遗传完整性;福红991的200株更新子代群体较原样本茎色类型出现增加现象,可能是外源花粉串粉所导致;闽红362的茎色类型变化无规律,可能是异交杂株或机械混杂造成的。因此,从茎色和叶形两个表型性状分析得出,随着繁殖群体量的增加,更新子代群体的遗传结构更为接近原种质(原样本)。
通过以上分析可初步得出同一种质不同处理之间(不同繁殖群体)在表型上发生了基因丢失和漂移,遗传完整性受到了影响,且繁殖群体为200株和150株的更新子代样本,其原样本种质遗传完整性的保持优于群体量为100株和50株的。
2.2 老化对红麻种子生活力及其遗传完整性的影响
利用人工加速老化法对红麻种子生活力变化及其遗传完整性进行研究,以探究种子劣变的发生发展规律,为红麻种质资源的安全保存与更新提供理论依据。
2.2.1 老化对红麻种子生活力的影响
由图1可知,15个品种在老化处理过程中,随着老化时间的延长,种子的发芽率逐渐降低(图1),且发芽率下降的速率在品种之间有明显差异,即有的品种经过7个老化水平的处理后发芽率降到0,而有的品种发芽率仍在40%以上。处理过程中,多数同一品种的发芽率在不同处理间存在显著差异(表3),尤其是后期处理与前期处理间差异显著。种子活力指数也随老化时间的增加逐渐降低(图2),活力指数的降低速率在不同处理间有差异,从而说明红麻种子生活力的丧失不是等速率的,同一品种处理前期和后期存在显著差异(表4)。
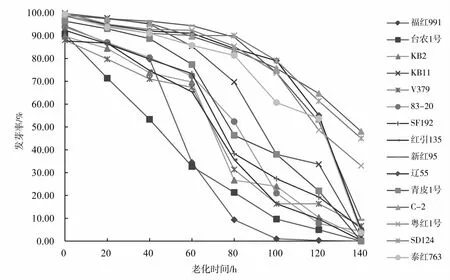
图1 老化处理下15个品种发芽率的变化曲线Fig.1 The germination rate changes of 15 kenaf varieties under aging treatment
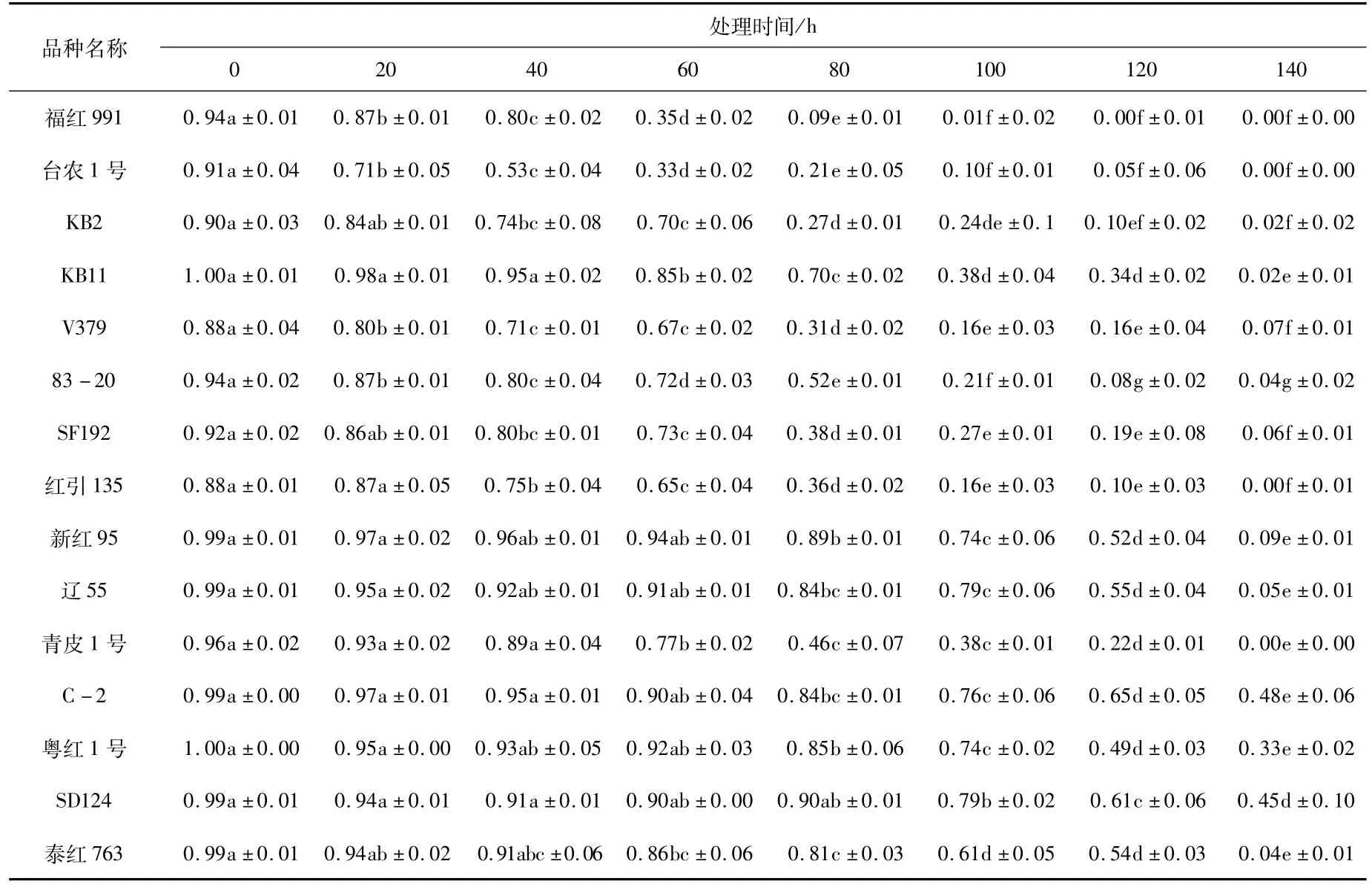
表3 老化处理下15个品种发芽率的方差分析Tab.3 The germination rate variance analysis of 15 kenaf varieties under aging treatment
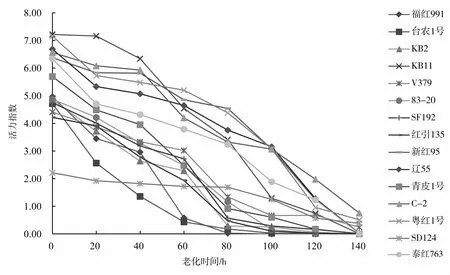
图2 老化处理下15个品种活力指数的变化曲线Fig.2 The vigor changes of 15 kenaf varieties under aging treatment
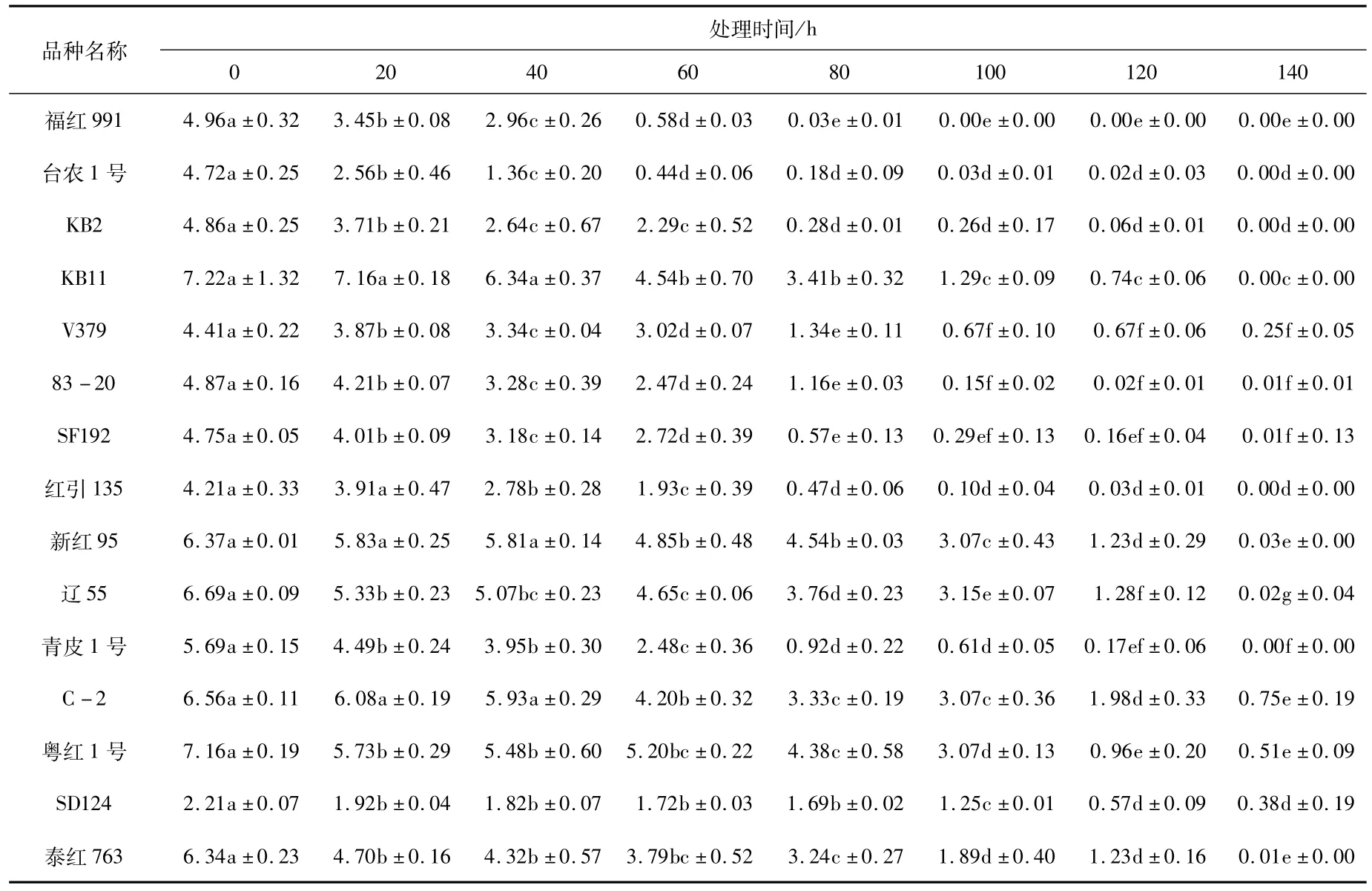
表4 老化处理下15个品种活力指数的方差分析Tab.4 The vigor variance analysis of 15 kenaf varieties under aging treatment
2.2.2 老化对红麻种质遗传完整性的影响
3份红麻材料经RAPD标记检测,台农1号、83-20经过不同老化处理后,等位基因频率都是100%,均未检测到差异;辽55等位基因频率检测结果为100.85%。进一步对同一种质不同老化处理的等位基因频率进行t-测验差异显著性分析,结果表明这3份种质的不同老化处理之间等位基因频率差异不显著(表5),表明不同老化处理对红麻这种高异交率的常异花授粉作物的种质遗传完整性影响不显著。
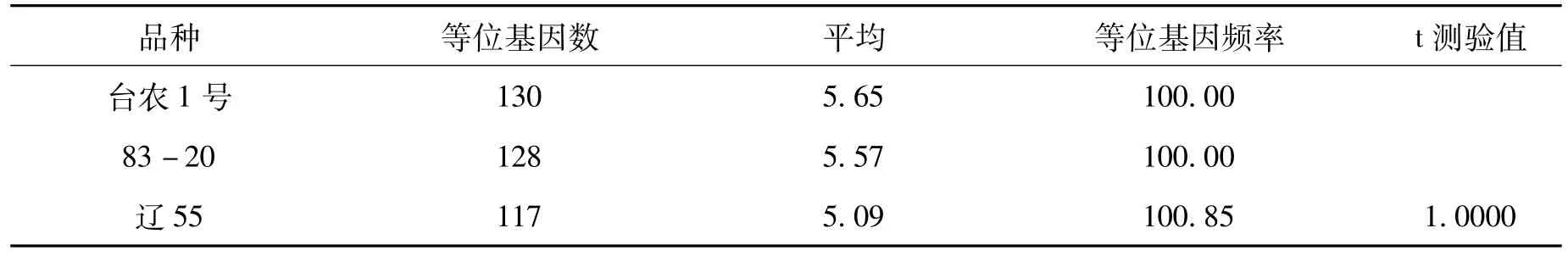
表5 同一红麻种质不同老化水平RAPD分析Tab.5 RAPD analysis of kenaf gerplasm under different aging treatments
3 讨论
种质库中种质资源在贮存及更新过程中维持其遗传完整性,是种质安全保存的热点和难点。遗传完整性指在贮藏种质的过程中,保持其群体的原始遗传结构,即基因型频率分布及等位基因频率分布与其原始群体一致[19]。维持种质的遗传完整性是指种质在贮藏的过程中,只发生最小程度的遗传变化,在繁殖过程中使子代和亲代保持最大的遗传相似性。遗传完整性变化有两方面含义:一是贮藏过程中遗传物质发生改变,如基因突变、染色体畸变等遗传变化;二是子代群体结构与亲代群体结构相比发生了改变[20]。本研究以来源不同的26份红麻种质为材料,通过形态标记和分子标记的方法,探讨了种子老化和繁殖群体大小对种质遗传完整性的影响,并初步提出更新技术指标,为红麻种质繁殖更新及安全保护提供参考。繁殖更新群体大小是影响种质遗传完整性的重要因素[21]。目前,已在多花菜豆[22]、菜薹[23]、大豆[24]、大白菜[25]和芝麻[26]等作物中开展了适宜繁殖群体量的研究,得出适宜繁殖群体量从24到200不等。本研究通过对26份红麻种质不同繁殖群体量的更新子代样本与原样本的表型遗传完整性分析,初步得出适宜繁殖群体量为150~200株。但这一结果仅基于表型鉴定分析,应结合分子检测手段进一步验证繁殖群体大小对其遗传完整性的影响,提出论据更为充分的适宜更新群体指标。
大量研究资料[5,8,12,13,15]表明,将种子进行人工老化处理,可以模拟种子的自然老化或劣变过程。因此,通过对老化处理群体与对照群体遗传结构比较分析,可探讨种子自然老化对种质遗传完整性的影响。周国栋[27]对不同老化程度的3份老芒麦种质群体进行检测,发现老化处理后的种质有的DNA片段消失或含量减少,甚至出现新的特异DNA片段;宿宇[28]开展的人工老化处理扁蓿豆研究表明,老化后种质的遗传多样性水平有所下降,但对其遗传完整性没有显著影响;潘应花[29]利用SSR分子标记对经人工老化处理后不同发芽率的野生种Nicotiɑnɑɑlɑtɑ进行遗传完整性分析,结果表明随发芽率的下降,群体遗传多样性参数均有下降,老化处理后群体的遗传完整性降低。本研究表明人工老化对红麻种质遗传完整性的影响不显著,但随着贮存时间的延长,老化不断加深,种子生活力逐渐下降,导致库存种质样本的有效群体数量下降。这与宿宇[29]的研究结果一致。根据《农作物种质资源整理技术规程》[30]和“国家麻类作物种质中期库管理细则”的有关规定,结合本研究结果,建议在生产实际中,当红麻库存种质生活力(发芽率)低于70%或库存种子有效数量低于入库数量一半时,就必须进行繁殖更新。
红麻种质属异质群体,影响其遗传完整性的因素较多,如低发芽率、高异交率、繁殖群体量、授粉方式、收获方式、繁殖世代数和选择压力等。红麻植株高大,花大而艳丽,且有蜜腺,由于昆虫等影响极易发生自然异交,高异交率是影响红麻繁殖更新过程中遗传完整性的最主要因素之一,本文的表型鉴定结果验证了这一点,因此红麻种质资源在繁殖更新过程中必须采取套袋或空间隔离等措施,以确保最大程度保持其遗传完整性。红麻种质资源在贮存及更新过程中影响其遗传完整性的因素较多,对每个因子进行科学试验与研究是一项长期系统的工作。因此,构建一套完善的、科学的红麻种质资源安全保存和繁殖更新理论与技术体系有待进一步研究。

