不同湿重诱导对毕赤酵母发酵生产植酸酶的影响
赵凯,葛菁华,王海
(青岛蔚蓝生物集团有限公司,山东 青岛 266101)
植酸酶是一类特殊的磷酸单酯酶,能够将植酸和植酸盐中的磷酸基团逐一水解,最终释放出肌醇和无机磷。饲料中磷以植酸磷的形式存在[1],植酸磷很难被动物分解利用,未利用的磷从粪便中排出,不仅造成磷资源的浪费,而且对周围的水体和环境造成污染。同时,植酸磷是一种抗营养因子,能降低动物对营养物质的利用[2-4]。在动物饲料中添加植酸酶能够降解植酸盐,从而改善磷和其他养分的消化吸收,减少养分排泄。植酸酶在饲料养殖中的应用,能够增加磷的利用率,增加养殖户的经济效益,对提高畜禽生产效益及降低植酸磷对环境的污染有重要作用。
巴斯德毕赤酵母是被广泛用来表达外源蛋白的甲醇营养型酵母表达系统。周晨研等[5]将黑曲霉XZ-3S木聚糖酶Xyn43A成熟肽基因通过表达载体转化毕赤酵母,获得两株重组菌GS115/Xyn43A(Mut~+)和KM71/Xyn43A(Mut~s),并对其发酵条件进行了初步优化。王停停等[6]将来源于PaenibacilluscampinasensisG1-1的木聚糖酶编码基因成功整合到毕赤酵母GS115基因组上,构建了高产木聚糖酶XynG1-1的毕赤酵母工程菌,采用响应面法对该工程菌的发酵条件进行优化。孙玮遥等[7]以甲醇诱导型重组毕赤酵母NCY-2为研究菌株,在摇瓶水平上首先考察了诱导时间、甲醇含量、诱导pH及诱导温度对蛋清溶菌酶表达的影响,然后通过正交试验设计优化出了该菌株的最佳发酵条件,并进一步研究了摇瓶发酵过程中的菌体生长和酶活力随时间的变化规律。
通过重组毕赤酵母高密度发酵生产植酸酶以提高其发酵酶活是目前植酸酶研究的热点之一。宋玛丽等[8]对来源于大肠杆菌的植酸酶基因appA 进行突变获得植酸酶基因突变体appA-2QN,为提高该植酸酶的表达量,降低植酸酶的生产成本,对表达该酶的重组酵母菌GS115 /appA-2QN 进行了高密度发酵研究。黄魁英等[9]对植酸酶毕赤酵母基因工程菌PEY-2的发酵条件进行研究,在摇瓶中对发酵条件进行了优化,并在此基础上实现了50 L发酵罐的高密度发酵。Meenakshisundaram等[10]将来源于AspergillusficuumNRRL 3135的植酸酶基因 PhyA整合到毕赤酵母GS115上,初步优化后,在4 L发酵罐上进行发酵,酶活是野生型菌的509倍。武婕等[11]对近年毕赤酵母工程菌高密度发酵研究做了综述报道,并对毕赤酵母工程菌高密度发酵进行了展望。从已发表的文献中可以看到,毕赤酵母高密度发酵表达外源蛋白已成为大多数研究者的共识并被广为采用,然而对不同菌密度对毕赤酵母表达植酸酶的影响的相关研究未见报道。本文对诱导前不同菌密度对发酵产植酸酶的影响进行了优化,旨在找到最优发酵菌密度。
1 研究方法
1.1 实验材料
1.1.1 菌株
重组毕赤酵母基因工程菌(Mut+),由本公司自行构建,分泌表达植酸酶。
1.1.2 培养基
种子培养基为YPD培养基,发酵培养基为BSM培养基(用葡萄糖替换甘油)。
1.2 方法
1.2.1 种子培养
将保藏菌种接种到50 mL的YPD培养基中培养18~24 h,再按照10%接种量接种YPD培养基扩培16~24 h,然后按照8%接种量接入发酵罐BSM培养基中发酵培养。
1.2.2 发酵控制
发酵实验在50 L发酵罐中进行,流加氨水控制pH 5.0,底糖耗尽后通过流加糖(60%葡萄糖,含12 mL/L PTM1)增加湿重,根据实验需求分别将湿重增加至180、240、300、350 g/L,随后以相同方式流加甲醇诱导植酸酶表达。
1.2.3 分析方法
细胞湿重测定:10 mL发酵液10 000 r/min离心10 min后弃上清称重;植酸酶酶活测定:GB/T 18634—2009饲用植酸酶活性的测定分光光度法[12]。
2 结果与讨论
2.1 对照180 g/L湿重开始甲醇诱导
发酵液底料中含有30 g/L葡萄糖,葡萄糖耗尽之后溶氧回升,此时开始流加60%的葡萄糖直至诱导所需湿重180 g/L(大约发酵时间24 h),之后停止流加葡萄糖,饥饿30 min左右,开始流加甲醇诱导产酶。甲醇流加速度从1 g/(L·h)开始,每两小时提高0.5 g/(L·h),直到甲醇流加速度为4.5 g/(L·h)时,停止继续提高,并以该流速至发酵结束。
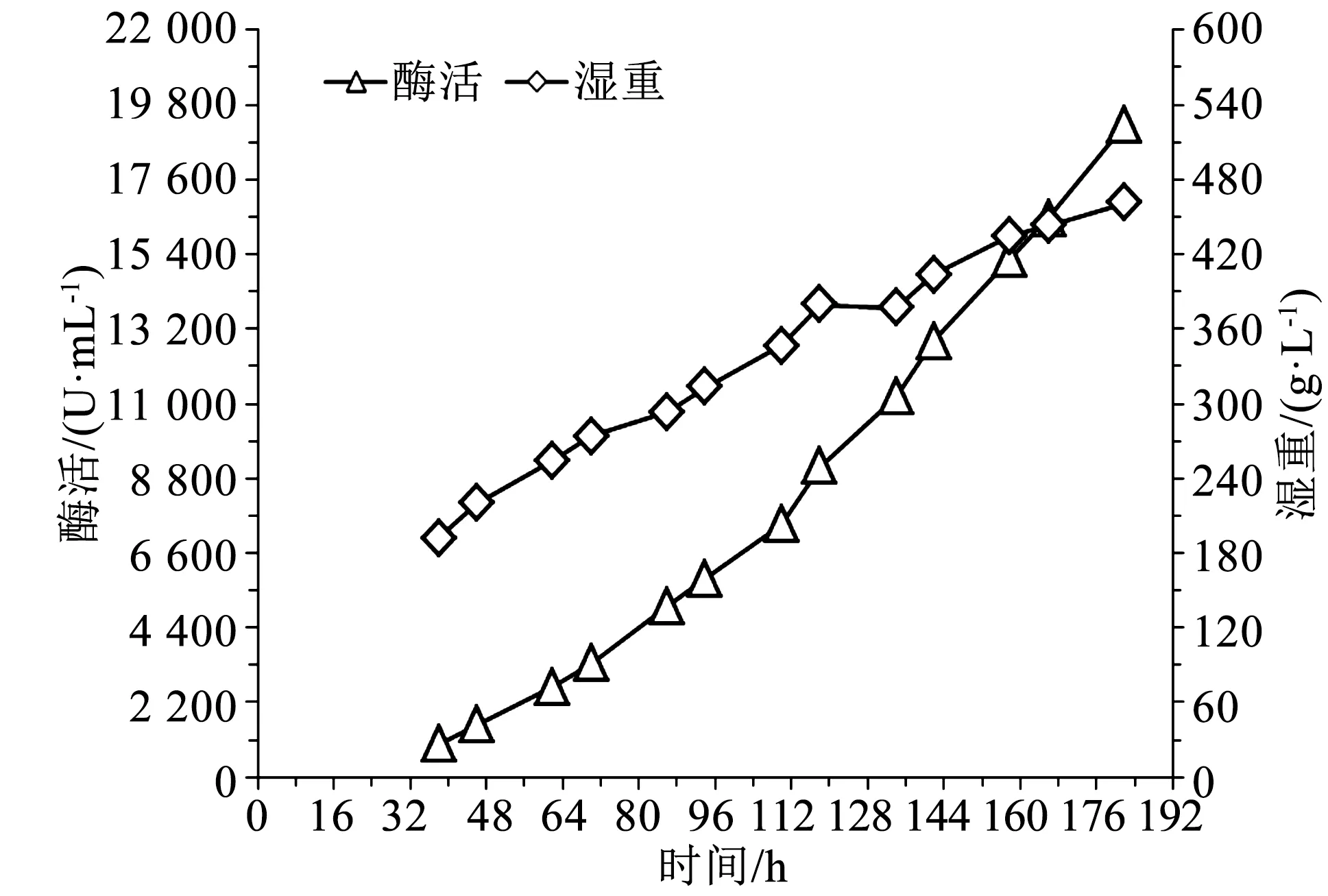
图1 对照酶活湿重曲线Fig.1 Enzyme activity and wet cell weight profile of the control group
由图1可知,发酵38 h时(大约诱导后12 h左右),湿重192 g/L,酶活963 U/mL,随后酶活和湿重随发酵时间一直增加,至发酵182 h时下罐,此时湿重461 g/L,酶活19 222 U/mL。
2.2 240 g/L湿重开始甲醇诱导
底糖及流加糖阶段与180 g/L相同,流加60%的葡萄糖直至诱导所需湿重240 g/L,之后诱导阶段调控策略与180 g/L相同。
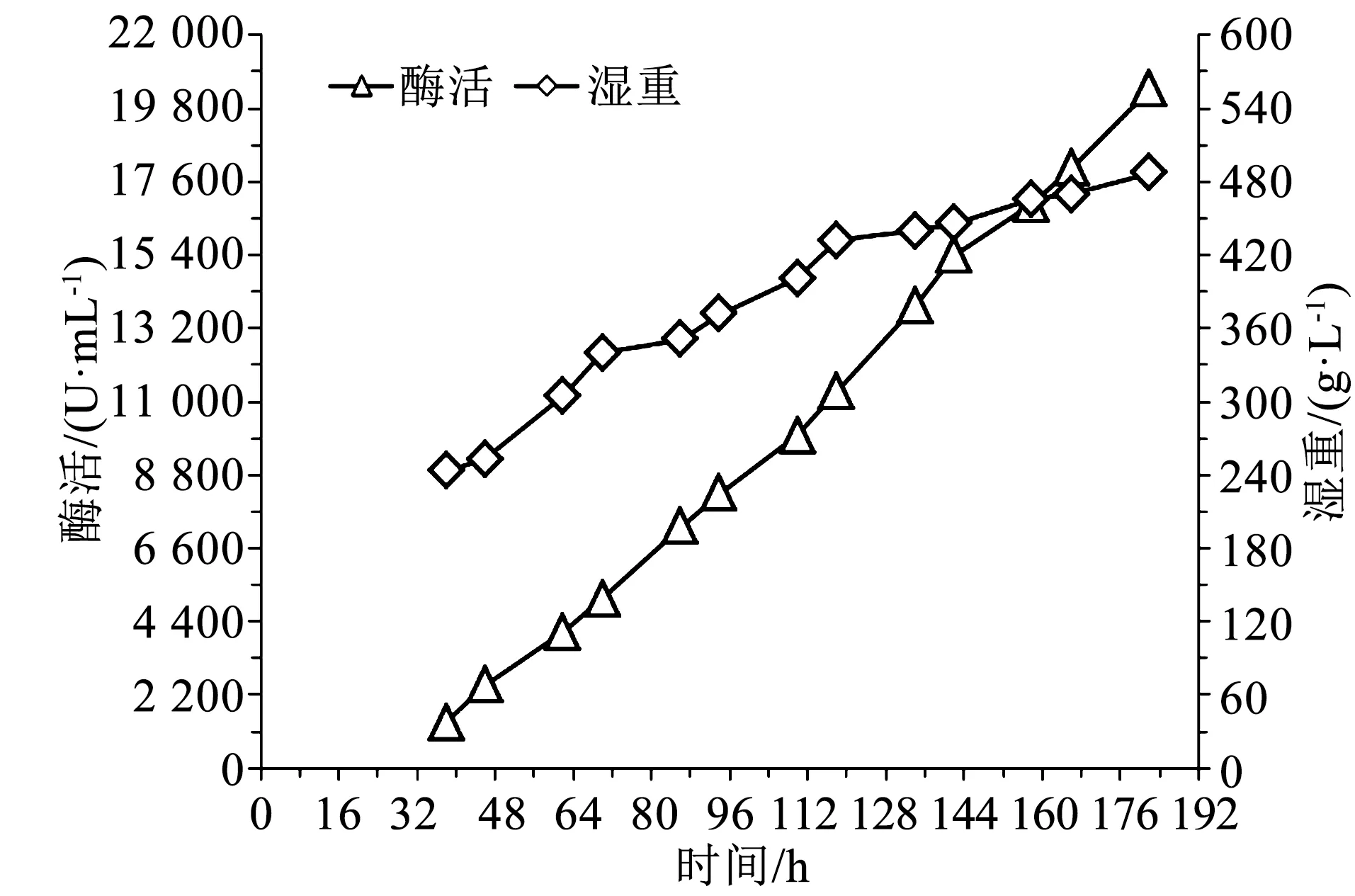
图2 240 g/L湿重开始甲醇诱导时的酶活湿重曲线Fig.2 Enzyme activity and wet cell weight profile under the condition of initial methanol induction wet cell weight of 240 g/L
由图2可知,发酵38 h时,湿重243 g/L,酶活1 377 U/mL,随后酶活和湿重随发酵时间一直增加,至发酵182 h时下罐,此时湿重487 g/L,酶活20 383 U/mL。
2.3 300 g/L湿重开始甲醇诱导
底糖及流加糖阶段与180 g/L相同,流加60%的葡萄糖直至诱导所需湿重300 g/L,之后诱导阶段调控策略与180 g/L相同。
由图3可知,发酵38 h时,湿重294 g/L,酶活1 726 U/mL,随后酶活和湿重随发酵时间一直增加,至发酵182 h时下罐,此时湿重506 g/L,酶活21 666 U/mL。
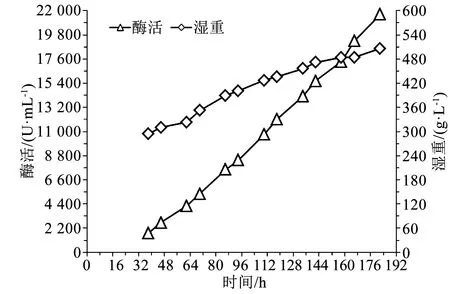
图3 300 g/L湿重开始甲醇诱导时的酶活湿重曲线Fig.3 Enzyme activity and wet cell weight profile under the condition of initial methanol induction wet cell weight of 300 g/L
2.4 350 g/L湿重开始甲醇诱导
底糖及流加糖阶段与180 g/L相同,流加60%的葡萄糖直至诱导所需湿重350 g/L,之后诱导阶段调控策略与180 g/L相同。
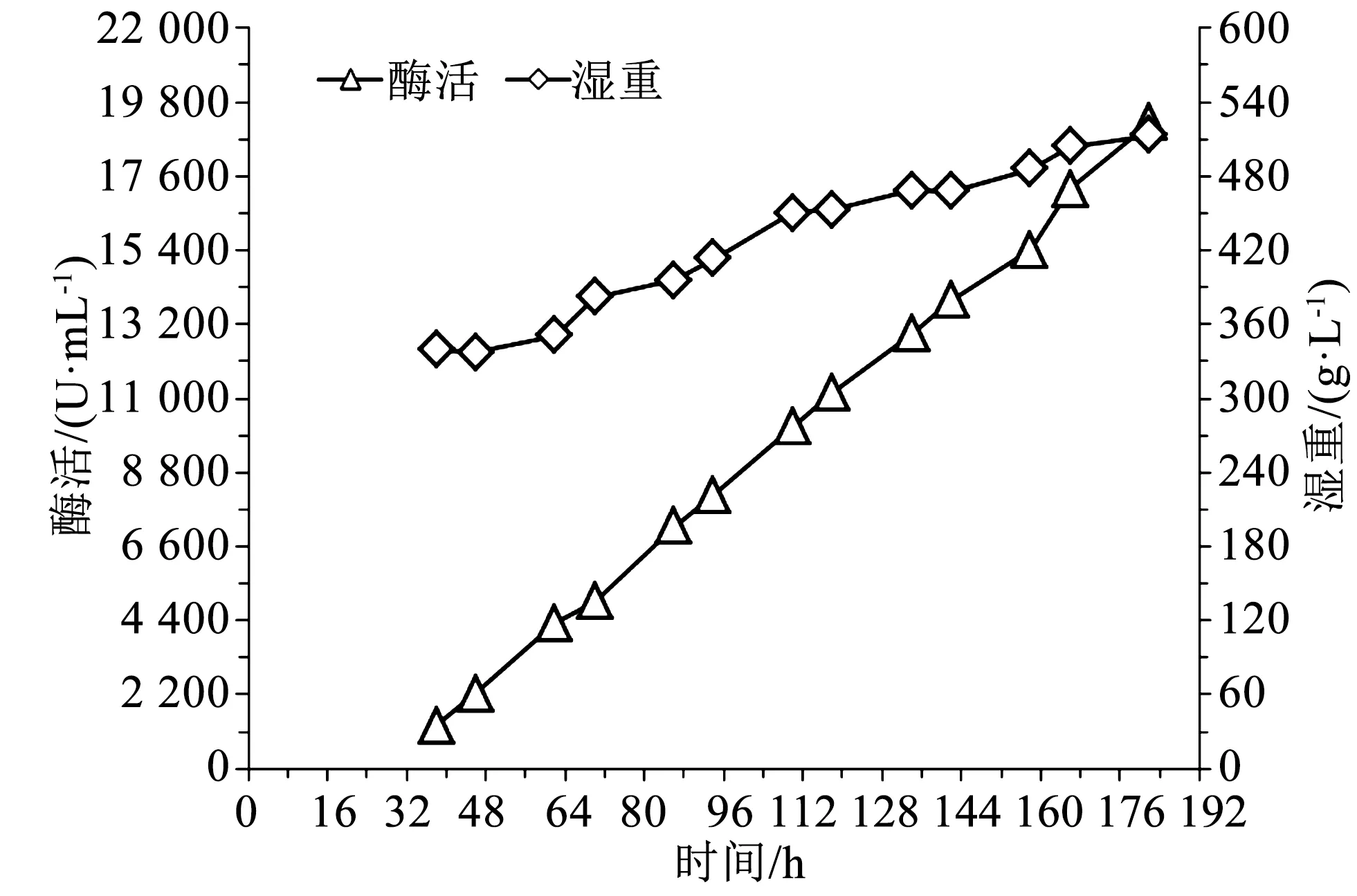
图4 350 g/L湿重开始甲醇诱导时的酶活湿重曲线Fig.4 Enzyme activity and wet cell weight profile under the condition of initial methanol induction wet cell weight of 350 g/L
由图4可知,发酵38 h时,湿重340 g/L,酶活1 285 U/mL,随后酶活和湿重随发酵时间一直增加,至发酵182 h时下罐,此时湿重513 g/L,酶活19 194 U/mL。
3 结论
随着初始诱导湿重的增加,最终发酵酶活呈现出先增后降的抛物线趋势,以180、240、300、350 g/L初始诱导湿重诱导,最终下罐酶活分别为19 222、20 383、21 666、19 194 U/mL,最终下罐湿重分别为461、487、506、513 g/L。本文初始诱导湿重300 g/L时,发酵酶活最高,达到21 666 U/mL,分别比180、240、350 g/L高12.7%、6.3%、12.9%。由此可以推测该菌最适诱导湿重在240~350 g/L之间,而考虑到初始诱导湿重越高,最终发酵液中菌体含量越高,相应发酵上清酶液越少,植酸酶收率越低,所以应该平衡好酶活提高及湿重增加之间的关系,本文最适诱导湿重300 g/L,建议最适诱导湿重范围240~300 g/L。
初始诱导湿重的不同,影响发酵过程中菌体密度,而高密度发酵是毕赤酵母基因工程菌提高外源表达量的重要策略之一。从本文结果来看,菌体发酵密度也并不是越高越好,而是有一个最适湿重区间,而发酵结束时的高湿重对后处理及酶的收率也有很大的影响。因此,对不同的菌种采用不同的诱导湿重是很有必要的,应在菌体生长和产酶之间找到最优的发酵方案。

