CCT2和Galectin-3在胰腺良恶性病变中的表达及其临床意义
刘光耀
胰腺癌是目前治疗效果最差的恶性肿瘤之一,亟需一种早期诊疗新方法[1]。人含TCP1伴侣蛋白亚基2(chaperonin containing TCP1 subunit 2,CCT2)是热休克蛋白60在真核细胞中的一个亚型,参与多种细胞的代谢,在许多恶性肿瘤组织中高表达,和肿瘤的发生、发展及预后紧密相关[2-5]。半乳糖凝集素3(Galectin-3)为一种β半乳糖苷结合蛋白,参与细胞诸多的生理功能。多项研究发现Galectin-3与恶性肿瘤关系密切[6-9]。本研究检测胰腺导管腺癌组织、癌旁组织、良性病变及正常胰腺组织CCT2和Galectin-3的表达,分析其临床病理学意义,探讨其与胰腺导管腺癌患者预后的关系。
资料与方法
一、一般资料
收集2002年1月至2012年12月间中南大学湘雅第二医院肝胆外科和湘雅第三医院普外科行胰腺导管腺癌手术切除的140例患者资料,通过电话或信件回访及登门回访,剔除失访、术前和术后行辅助化疗者,共106例纳入本研究。同期收集距癌组织≥2 cm处癌旁组织35例、胰腺良性病变组织55例(慢性胰腺炎20例、腺瘤20例、上皮内瘤变15例)、正常胰腺组织13例作为对照。记录胰腺导管腺癌患者的性别、年龄及肿瘤最大径、分化程度、TNM分期、有无淋巴结转移和周围组织浸润。随访2年,生存时间>2年者作为删失病例纳入统计。
二、CCT2和Galectin-3蛋白表达检测
采用EnVision免疫组织化学法检测CCT2和Galectin-3蛋白表达。兔抗人CCT2和Galectin-3多克隆抗体购自美国Abgent 公司,EnVisionTM检测试剂盒购自美国Dako实验室,严格按说明书操作。以一抗试剂盒中乳腺癌阳性切片作为染色的阳性对照,以磷酸盐缓冲液(pH7.4)替代一抗作为染色的阴性对照。细胞质和(或)细胞膜中出现黄色至棕黄色颗粒定为CCT2和Galectin-3阳性细胞。随机观察10个高倍镜视野的阳性细胞,根据染色强度给予0~3分(无,0分;弱,1分;中,2分;强,3分),根据阳性细胞占总细胞数的百分比给予0~4分(<5%,0分;5%~10%,1分;11%~20%,2分;21%~50%,3分;>50%,4分),两者之和为总评分。总评分值0~2分为阴性,≥3分为阳性。
三、统计学处理
采用SPPSS13.0统计软件行数据分析。计数数据以百分率表示,各变量组间比较采用χ2检验或Fisher′s确切概率法;单因素生存分析采用Kaplan-Meier法,生存期差别采用Log-Rank时序检验;多因素分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
结 果
一、胰腺良恶性病变及正常胰腺组织CCT2和Galectin-3蛋白表达
106例胰腺导管腺癌组织CCT2、Galectin-3阳性表达率分别为54.7%(58例)和50.9%(54例),35例癌旁组织CCT2、Galectin-3阳性表达率分别为25.7%(9例)和28.6%(10例),55例胰腺良性病变组织CCT2、Galectin-3阳性表达率分别为23.6%(13例)和20.0%(11例), 13例正常胰腺组织均无CCT2、Galectin-3表达(图1、2)。胰腺导管腺癌组织CCT2、Galectin-3阳性表达率显著高于癌旁、慢性胰腺炎、腺瘤、上皮内瘤变及正常胰腺组织,差异均有统计学意义(P值均<0.05)。癌旁组织和良性病变组织CCT2、Galectin-3阳性表达的导管上皮均呈轻至重度非典型增生或Ⅱ、Ⅲ级上皮内瘤变。
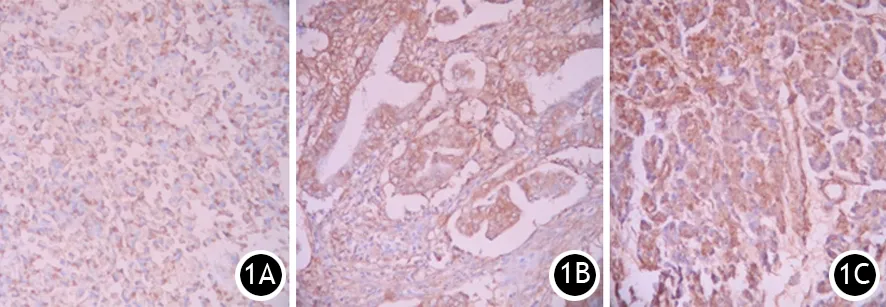
图1 腺癌(1A)、腺瘤(1B)、慢性胰腺炎(1C)组织CCT2蛋白表达(免疫组化染色 ×200)

图2 腺癌(2A)、癌旁(2B)、上皮内瘤变(2C)组织Galectin-3蛋白表达(免疫组化染色 ×200)
良性病例中慢性胰腺炎、腺瘤及上皮内瘤变的CCT2阳性表达率分别为20.0%(4/20)、25.0%(5/20)和26.7%(4/15);Galectin-3阳性表达率分别为15.0%(3/20)、25.0%(5/20)和20.0%(3/15),组间差异均无统计学意义。
二、胰腺导管腺癌组织CCT2和Galectin-3表达与临床病理参数的关系
淋巴结转移及TNMⅢ+Ⅳ期的胰腺导管腺癌患者的CCT2、Galactin-3阳性表达率显著高于无淋巴结转移及TNMⅠ+Ⅱ期患者,周围组织器官浸润的胰腺导管腺癌CCT2阳性表达率显著高于未浸润周围组织器官者,低分化腺癌Galactin-3阳性表达率显著高于高分化者,差异均有统计学意义;而患者年龄、性别及肿瘤最大径与CCT2、Galectin-3阳性表达无明显相关性(表1)。
58例胰腺导管腺癌CCT2阳性中40例Galectin-3阳性,48例CCT2阴性中39例Galectin-3阴性,CCT2与Galectin-3表达显著相关(χ2=16.646,P=0.000)。
三、影响胰腺导管腺癌患者生存因素的单因素及多因素分析
106例胰腺导管腺癌患者的生存期为2~24个月,平均(9.4±0.7)个月,术后1、2年生存率分别为 27.3%(29例)、 2.8%(3例)。肿瘤分化程度低、肿瘤直径大、TNM分期晚、有淋巴结转移及周围组织浸润、CCT2及Galactin-3 阳性患者的平均生存期均显著短于分化程度高、肿瘤直径小、TNM分期早、无淋巴结转移及周围组织浸润、CCT2及Galactin-3阴性患者,差异均有统计学意义(表2,图3)。Cox多因素分析结果显示,肿瘤分化程度低、肿瘤最大径≥5 cm、TNMⅢ或Ⅳ期、有淋巴结转移及周围组织浸润、CCT2和Galectin-3表达阳性为影响患者预后的独立危险因素(表3)。
讨 论
近些年胰腺癌发生率逐年升高,大多数患者确诊时已到晚期。目前临床上常用的肿瘤标志物敏感性和特异性均不能满足早期胰腺癌的诊断,因此亟需寻找一种新的肿瘤标志物[1]。CCT2作为一种分子伴侣,参与多种细胞代谢,在蛋白质合成中参与多种蛋白(如肌动蛋白和微管蛋白)的折叠以及真核细胞中蛋白质的装配[10]。近年研究发现,CCT2在肝细胞癌、结肠癌、肝外胆管癌、胆囊癌、胃癌表达水平明显高于其良性病变,而正常组织表达阴性。进一步的研究发现,CCT2的表达水平与肿瘤的分化程度、进展、转移及预后密切相关[2-5]。Galectin-3主要存在于细胞质中,参与肿瘤发生和发展的各个方面,包括促进肿瘤细胞的增殖、黏附、分化、转移及新生血管生成等[6-9]。恶性肿瘤患者血清Galectin-3水平明显升高,且发生转移患者的血清Galectin-3水平又往往高于未发生转移者[11]。
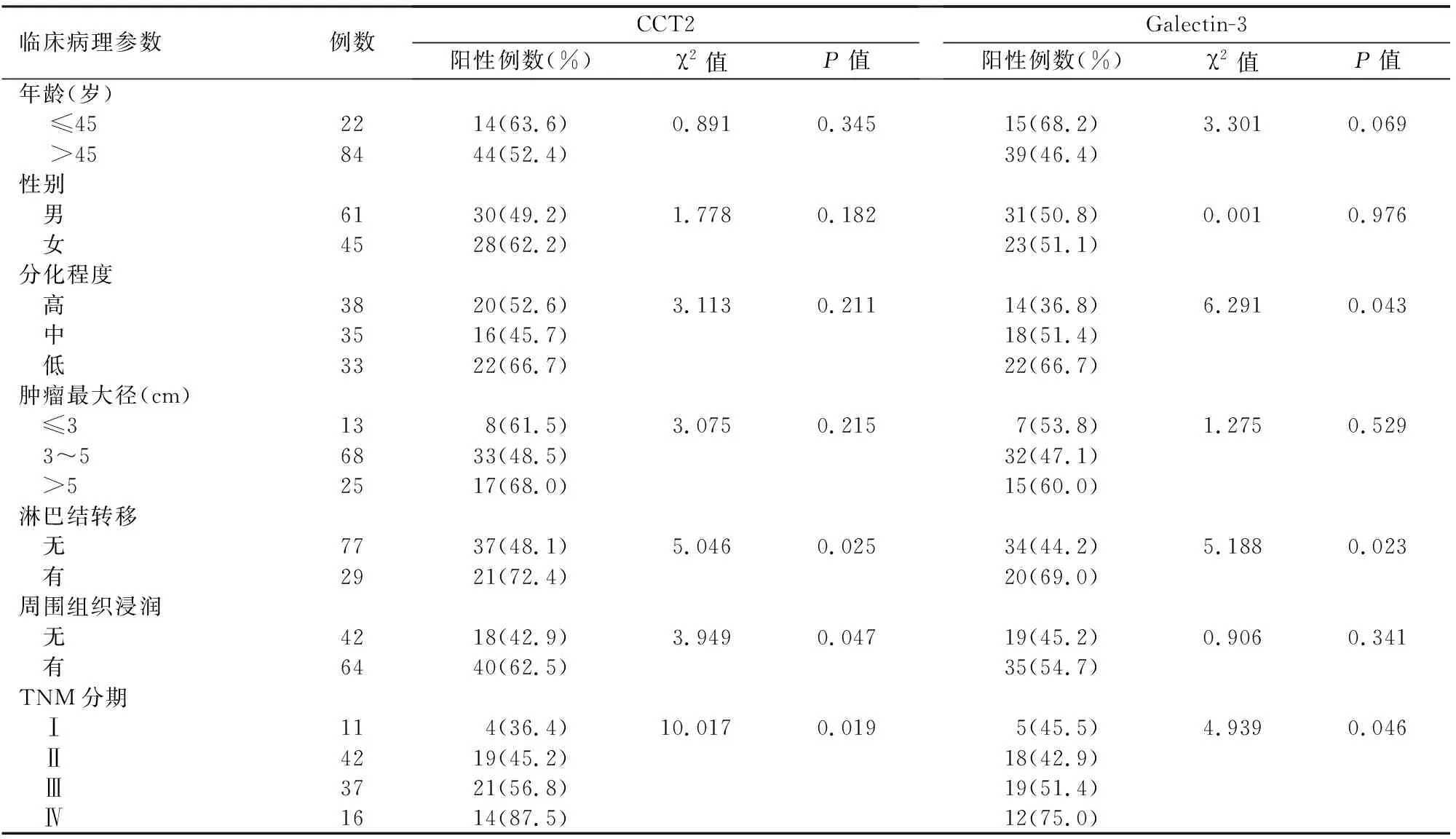
表1 胰腺导管腺癌组织CCT2、Galectin-3阳性表达与临床病理参数的关系

表2 影响胰腺导管腺癌患者生存的单因素分析

图3 CCT2阳性与阴性(3A)、Galectin-3阳性与阴性(3B)患者的生存曲线
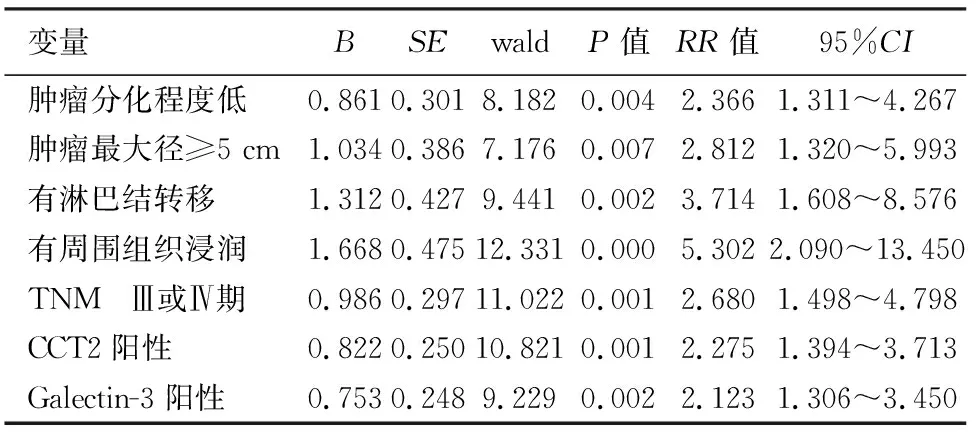
表3 影响胰腺导管腺癌患者预后的多因素分析
本研究结果显示,胰腺癌组织CCT2、Galactin-3高表达,其表达量显著高于匹配的癌旁组织、胰腺良性病变和正常胰腺组织。胰腺癌组织CCT2、Galactin-3表达量与肿瘤的分化、浸润、转移密切相关,且癌旁组织和良性病变CCT2、Galectin-3阳性表达的导管上皮均呈轻至重度非典型增生或Ⅱ、Ⅲ级上皮内瘤变,提示CCT2和Galectin-3可能参与了胰腺腺瘤从轻度非典型增生到恶变这一过程。此外,CCT2和Galectin-3表达阳性与患者术后生存期呈负相关,是胰腺癌患者预后的独立危险因素。
然而,CCT2和Galectin-3的特异性不强,尚不能作为胰腺癌的特异性肿瘤标志物,但是否可以作为监测肿瘤的进展或转移、判断手术或化疗药物疗效的指标有待进一步研究。

