多脂长喙壳菌次生代谢产物的抑菌活性研究
肖支叶, 陈丽英, 原晓龙, 华 梅, 邱 坚, 郑 科, 王 毅*
(1.云南省林业科学院 云南省森林植物培育与开发利用重点实验室,国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650201;2.西南林业大学 材料工程学院,云南 昆明 650224;3.普洱市林业管理服务中心,云南 普洱 665000)
植物病原真菌是引起植物病害的主要病原微生物,但有些病原真菌给农林业带来破坏的同时也给人类带来广泛的药用价值。据文献报道,部分植物病原真菌本身或其引起的植物病害组织具有药用价值,如利尿、止血、抗菌、抗肿瘤、清热解毒等药理作用[1]。多脂长喙壳菌(Ceratocystisadiposa)为长喙壳属真菌,该属真菌广泛分布在世界各地,是农作物和树木上的重要病原真菌[2],会产生多种挥发性有机化合物。在不同的培养条件下,该类真菌能产生大量类似水果或花卉的芳香物质,如菠萝、香蕉、苹果、柠檬和玫瑰的香味[3-6]。研究表明,甘薯长喙壳菌在生长过程中能够产生浓郁的近似香蕉气味的挥发性有机化合物[7-8],该类化合物对多种植物病原真菌具有较强的抑制作用[9]。多脂长喙壳菌通过甘蔗的切口、蔗桩侵入,感病后会散发出浓郁的菠萝香味[10]。真菌代谢产生的挥发性有机化合物主要是次生代谢产物,已被开发成绿色能源物质[11],用于植物病虫害的防治,也作为化学信息素引诱或趋避昆虫和无脊椎动物[12]。长喙壳属真菌具有的特殊代谢机制,使得这类真菌具有多种潜在应用价值。真菌广泛分布在自然环境中,种类十分丰富[13]。其次生代谢产物具有多种生物活性,可开发成不同类型的药物。真菌次生代谢产物是科研人员研究微生物的主要对象,当前研究较多的是植物内生真菌和昆虫共生菌[14-16],从它们体内或发酵物中分离获得生物碱类、萜类、醌类、甾体、酚类、肽类等具有不同生物活性的化合物[17]。因此,真菌能够成为人们寻找具有生物活性化合物的重要来源。例如人类医疗中常用的抗生素—青霉素就来源于真菌,它是由英国细菌学家Fleming于1929年发现[18],苄基青霉素的出现实现了青霉素工业化生产[19],极大地促进人类医学发展。1993年,Strobel等[20]首次从红豆杉(Taxmbrevifolia)树皮中分离获得安德氏紫杉霉(Taxomycesandreanane),该内生真菌能够产生一种萜类化合物—紫杉醇,是当今世界公认活性最为有效的抗肿瘤药物。Wang等[21]研究发现单格孢属内生真菌(Ulocladiumsp.)发酵液提取物对白色念珠菌、曲霉菌、金黄色葡萄球菌、枯草芽胞杆菌等真菌和细菌具有很好的抗菌活性。多脂长喙壳菌是甘蔗黑腐病的病原菌[10],目前未见其次生代谢产物的抗菌活性的报道。本研究首先检测多脂长喙壳菌对13种致病细菌的抑菌活性,测定最低抑菌浓度,并检测提取物抗菌化合物的稳定性,同时用单菌多产物(one strain-many compounds,OSMAC)策略液体培养多脂长喙壳菌,浓缩培养液获得提取物,检测抑菌活性,探究最佳培养条件,为定向培养植物病原真菌、分离提纯活性化合物的研究作铺垫。
1 材料与方法
1.1 材料
1.1.1 菌种来源 供试致病细菌为蜡样芽胞杆菌 (Bacilluscereus)、金黄色葡萄球菌 (Staphylococcusaureus)、铜绿假单胞菌 (Pseudomonasaeruginosa)、藤黄微球菌 (Micrococcusluteus) 、副溶血性弧菌 (Vibrioparahaemolyticus)、短小芽胞杆菌 (Bacilluspumilus)、大肠埃希菌 (Escherichiacoli)、福氏志贺氏菌 (Shigellaflexneri)、枯草芽胞杆菌 (Bacillussubtilis)、溶血性葡萄球菌 (Straphylococcushaemolyticus)、无乳链球菌 (Streptcococcusagalactiae)、缓慢芽胞杆菌 (Bacilluslentus)、乙型副伤寒沙门氏菌 (SalmonellaparatyphiB),由昆明市食品药品检验所赠送;多脂长喙壳菌由云南农业大学植物病理研究室赠送。
1.1.2 培养基 ①不同氮源培养基:葡萄糖2 g/L,蔗糖6 g/L为碳源,编号为G与S,以4 g/L的胰蛋白胨Y1、酵母粉Y2、麦芽浸粉M1、麦芽浸粉肉汤M2、牛肉浸粉B、马铃薯浸粉P、酪蛋白胨L、大豆蛋白胨S、番茄浸粉T、马铃薯浸粉和大豆蛋白胨P-S为氮源,配制成碳源相同氮源不同的液体培养基。②OMAM培养基:葡萄糖20 g/L、蔗糖20 g/L为碳源,大豆蛋白胨20 g/L和酵母粉1 g/L为氮源。
1.2 方法
1.2.1 制备提取物 用100 mL液体培养基GSY1、GSY2、GSM1、GSM2、GSB、GSP、GSL、GSS、GST、GSP-S、OMAM分别培养多脂长喙壳菌,28 ℃、150 r/min 摇床培养10 d后,用等体积的乙酸乙酯萃取2次,滤去水相,取有机相浓缩培养液,收获提取物,分别称取适量提取物,加入DMSO溶解成50 mg/mL提取物溶液备用。
1.2.2 检测提取物抗菌活性 制备供试菌悬浮液:分别将13种供试菌株接种于固体LB培养基上,37 ℃恒温培养12 h活化菌株,再挑取单菌落接种到5 mL液体LB培养基中,37 ℃、180 r/min进行斜面培养,至菌液浓度达到 (1×106~6×106)cfu/mL,备用。抑菌实验用纸片法[22]。将各菌液均匀涂布在LB固体培养基上,分别滴加10 μL多脂长喙壳菌不同提取物溶液于滤纸片(φ=5 mm)上,同时一片滤纸片滴加10 μL DMSO作为阴性对照,挥干后贴在涂有供试菌的培养基上,37 ℃恒温培养24 h后测量抑菌圈直径。3次技术重复实验。测定最小抑菌活性(MIC):采用二倍稀释法[23],测定活性提取物的MIC值。
1.2.3 提取物稳定性检测 配制15份50 mg/mL的多脂长喙壳菌提取物DMSO溶液,检测多脂长喙壳菌提取物的热、酸碱和光稳定性。①:热稳定性检测:在30、50、70、90、100 ℃热水中分别处理1份,水浴加热30 min,备用。②酸碱稳定性检测:各调一份提取物溶液的pH值至3、5、7、9、11,备用。③光稳定性检测:取5份提取物溶液置于紫外灯下照射30、60、90、120、150 min,备用。用纸片法检测处理后的提取物抗菌活性,均做3次技术性重复实验。
1.2.4 OSMAC策略寻找最佳培养条件 以不同时间、接种量和培养基分别培养多脂长喙壳菌,对其不同的提取物做活性检测,具体如下:无菌条件下,研碎多脂长喙壳菌菌体。不同培养基:分别接种在GSY1、GSY2、GSM1、GSM2、GSB、GSP、GSL、GSS、GST、GSP-S、OMAM液体培养基中;不同时间:在GSL液体培养基中培养5、10、15、20和25 d各一份;不同接种量:研碎0.2、0.4、0.8、1.6、3.2 g菌体各一份,在GSL液体培养基中培养,28 ℃、150 r/min 摇床培养10 d后,收获培养物。
2 结果与分析
2.1 检测多脂长喙壳菌提取物抑菌活性
活性检测结果表明,多脂长喙壳菌提取物对13种致病细菌中的3种革兰阳性菌(蜡样芽胞杆菌、缓慢芽胞杆菌和藤黄微球菌)具有明显的抑菌活性,抑菌圈直径分别为8.1、8.0、8.7 mm。多脂长喙壳菌提取物中含有有效的抗菌物质。多脂长喙壳菌提取物对蜡样芽胞杆菌、缓慢芽胞杆菌和藤黄微球菌的MIC均不相同,分别为6.25、1.562 5、3.125 mg/mL。MIC越小,说明致病细菌对提取物的敏感性越大,致病菌对多脂长喙壳菌提取物的敏感性大小为蜡样芽胞杆菌<藤黄微球菌<缓慢芽胞杆菌。多脂长喙壳菌次生代谢产物中的活性成分对革兰阳性菌有着较好的抗菌作用。
2.2 多脂长喙壳菌提取物稳定性
如图1所示,多脂长喙壳菌提取物溶液经过不同温度处理、调节pH值和紫外光照射不同时间后,对蜡样芽胞杆菌和藤黄微球菌仍具有抗菌活性,对缓慢芽胞杆菌无抗菌活性。藤黄微球菌对多脂长喙壳菌提取物的敏感性高。随着温度升高,pH值增大,紫外光照时间的增加,提取物对蜡样芽胞杆菌和藤黄微球菌的抑菌活性变化较小,抑菌圈直径呈现上下浮动的趋势,没有明显增大或减小,抑菌效果相似,可以断定多脂长喙壳菌提取物含有有效抑菌成分并且具有耐高温、耐酸碱和耐紫外辐射的能力。
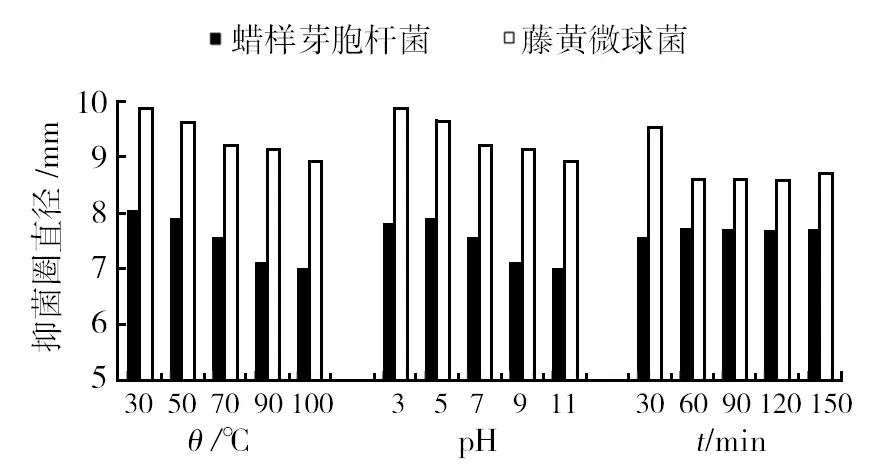
图1 多脂长喙壳菌提取物处理后的抑菌效果Fig.1 Antibacterial effect of C. adiposa extract after treatment
2.3 不同培养基对多脂长喙壳菌提取物的抑菌活性比较
多脂长喙壳菌在10种液体培养基中培养,乙酸乙酯萃取浓缩所得提取物对3种致病菌的抑制效果见表1。液体培养基GSB、GSL、GSM1、GST、GSP、GSY1、GSY2、OMAM均可使多脂长喙壳菌产生对蜡样芽胞杆菌、缓慢芽胞杆菌、藤黄微球菌有抗菌活性的次生代谢产物,抗菌实验表明,不同培养基培养多脂长喙壳菌获得的提取物对蜡样芽胞杆菌和藤黄微球菌的抑菌效果区别明显,对缓慢芽胞杆菌有广谱抗菌活性,GSL是最佳培养基。GSM2、GSS培养多脂长喙壳菌的提取物对3种致病菌具有不同的抗菌活性。
2.4 接种量对多脂长喙壳菌提取物抑菌效果
多脂长喙壳菌不同接种量培养10 d后收获提取物,由图2可知,活性实验表明接种量会影响多脂长喙壳菌提取物对三种致病菌的抗菌活性。随着接种量的增加,提取物的抗菌活性有所增大,接种0.4 g此菌丝体培养收获的提取物开始有抗菌活性,接种量在1.6 g时,提取物能够明显抑制藤黄微球菌的生长,对三种致病菌的抑菌效果最好。继续增大接种量,提取物抑菌活性降低。在不同接种量下,提取物对藤黄微球菌的抗菌效果始终优于蜡样芽胞杆菌和缓慢芽胞杆菌,对蜡样芽胞杆菌和缓慢芽胞杆菌的抗菌效果相似,可以看出,藤黄微球菌对多脂长喙壳菌提取物的敏感性较高。
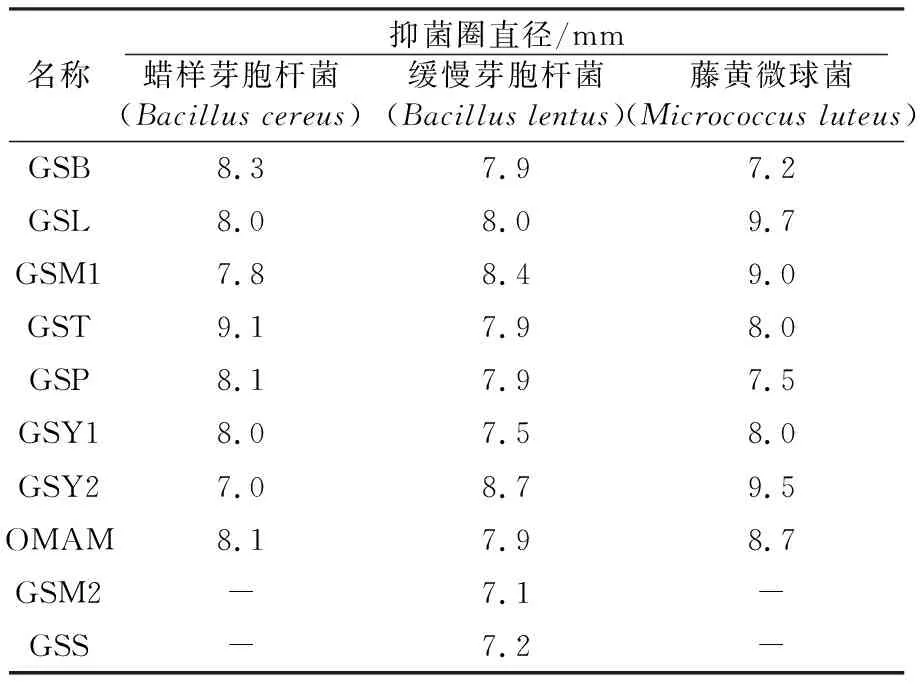
表1 不同液体培养基乙酸乙酯浓缩物抑菌活性
注: “-”表示无抗菌活性
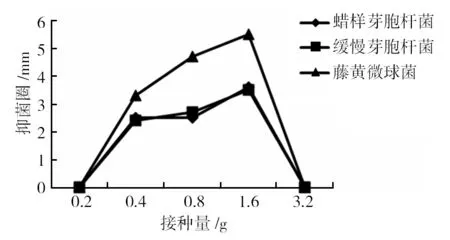
图2 接种量对提取物抑菌活性的影响
抑菌圈值为测得的抑菌圈直径与圆纸片直径的差值,下图同
The value of inhibition zone is measured diameter difference between inhibition zone and round paper
2.5 培养时间对多脂长喙壳菌提取物抑菌效果
经过不同时间培养获得的提取物的抑菌效果如图3,多脂长喙壳菌培养5 d即产生活性次生代谢产物,10 d活性达到最高,提取物的抑菌效果最好。随后抑菌活性呈现略微下降的趋势,25 d时没有抗菌活性,原因可能是培养时间过长,多脂长喙壳菌代谢出多种次生代谢产物,可能产生其他的化合物破坏了次生代谢产物中对致病细菌有抗菌活性的化学物质,从而失去抗菌活性。培养时间会影响该真菌提取物的抑菌活性。
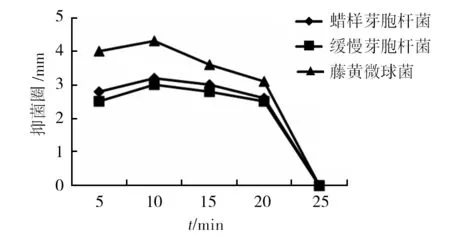
图3 时间对提取物抑菌活性的影响Fig.3 Antibacterial activity of extracts in different culture time
3 讨 论
本研究发现,GSL培养多脂长喙壳菌获得的提取物的抑菌效果最好,抑菌圈直径9.7 mm,而GSM2和GSS培养多脂长喙壳菌得到的提取物无抑菌活性(表1)。培养基对多脂长喙壳菌产生的代谢产物的抗菌活性有影响,其原因可能是该菌株在不同的培养基中产生不同类型的次生代谢产物或次生代谢产物的产量不同。接种量和培养时间也会影响多脂长喙壳菌次生代谢产物的抑菌效果。因此,改变培养基成分和培养条件均会影响多脂长喙壳菌抗菌活性成分的产生。
从微生物中筛选天然来源活性化合物是寻找新药前体化合物的有效途径之一。2002年,Bode等[24]提出单菌多产物策略(OSMAC),该策略通过改变培养条件、培养方法和添加酶抑制剂等手段,激活微生物中沉默的生物合成基因簇,从而获得结构新颖、活性高的新化合物。OSMAC策略为广泛开发微生物来源的天然产物提供了有效手段。卢轩等[25]对单菌多产物策略研究成果做了综述,利用该策略已经在不同生态环境生存的微生物的次级代谢产物的研究中获得成功,已发现多种活性化合物。Nielsen等[26]用不同培养基培养构巢曲霉(Aspergillusnidulans),HPLC分析表明构巢曲霉在查氏酵母膏琼脂培养基(CYA)中会产生arugosin A,而在酵母膏培养基(YE)中不会产生arugosin A,说明培养基种类会影响构巢曲霉次生代谢产物的产生。肖支叶等[27]报道应用OSMAC方法研究了云南松小蠹虫共生菌Leptographiumbhutanense,发现其提取物中含有抗菌物质,抗菌化合物具有较好的耐热和耐辐射性。OSMAC策略对微生物中大量代谢途径的表达有促进作用,改变微生物发酵条件可促使其产生多种类型的化合物,在微生物次生代谢产物的研究中具有广泛的适用性。
目前已经确定具有药用价值的植物病原真菌仅有数十种,而植物病原真菌的种类达8 000种以上[13],可以看出,研究过的植物致病真菌数量很少,研究前景十分广阔。关于植物病原真菌代谢产物的报道集中在具有药用价值的一些植物病原真菌,对其毒素、致病机制、群体遗传学和分子生物学等方面的研究较多[28-31],忽略了其对人类有益的方面。从真菌中发掘结构新颖、活性多样的次生代谢产物是当前的一个研究热点,应用OSMAC策略研究植物病原真菌次生代谢产物可丰富微生物研究内容,同时为寻找天然来源的新型抗生素先导化合物增加一条可能的途径。多脂长喙壳菌发酵产生的次生代谢产物抗菌活性尚属首次报道,其提取物中含有有效抗菌成分。本研究可为后续分离纯化活性物质提供理论基础,也可为植物病原真菌活性次生代谢产物的研究提供参考。