1株来自丛生盔形珊瑚的球托霉鉴定及生理学特性研究
王荻潇, 钟 敏, 雷晓凌, 聂芳红, 邓义佳, 姚远蓓
(广东海洋大学食品科技学院 广东省水产品加工与安全重点实验室 水产品深加工广东普通高等学校重点实验室 ,广东 湛江 524088)
珊瑚作为一类无脊椎动物存在于海洋环境中,种类繁多,被称为海洋的“热带雨林”。珊瑚与周围水环境及其附生的藻类、微生物群体形成稳定的生态系统,与其共附生微生物协同进化,形成了良好的互惠关系[1-2]。微生物作为珊瑚生态系统中重要组成部分,对维持该生态系统的平衡起着及其重要的作用[3-4]。有研究表明珊瑚共附生微生物可为其化学防御提供武器[5],对抵御外来物种侵害以及环境变化方面具有重要意义。 海洋微生物资源与陆地资源相比较丰富,研究潜力大但开发率低[6]。海洋真菌作为海洋共附生微生物重要的组成部分,已成为国内外研究的热点。目前有关海洋真菌的研究主要集中于抗菌、抗肿瘤等活性物质的开发[7-9],如Li等[10]从中国三亚国家珊瑚礁保护区的珊瑚Sarcophytontortuosum中分离出1株真菌Chondrostereumsp.,能产生一种对人鼻咽癌细胞具有细胞毒性的倍半萜类化合物,但对海洋真菌的鉴定及生理学特性报道较少,目前研究较多的珊瑚共附生真菌主要有子囊菌和半知菌[11-12]。除常见种属外,还发现一些较罕见菌,如Koh等[13]从新加坡地区柳珊瑚分离出粘鞭霉Gliomastixsp.和齿梗孢Scolecobasidiumsp.。Wangt等[14]从中国南海海域柳珊瑚上分离得到链格孢Alternariasp.、黑孢霉Nigrosporasp.及丛赤壳Nectriasp.,但均未对其进行生理学特性研究。虽然罕见菌的分离丰富了海洋真菌基因和形态多样性,但对生理特性研究的缺乏严重阻碍对其活性物质的进一步开发。因此,对罕见菌种生理学特性的研究,可为后期活性物质的开发奠定基础。本课题组通过对丛生盔形珊瑚中分离的菌株XWC14-13进行形态学特征、rDNA ITS基因序列分析鉴定,并研究不同温度、pH和盐度对该菌株生长的影响,筛选出最优培养条件,为进一步研究该珊瑚真菌潜在的生物活性提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 本研究所用菌株XWC14-13分离自湛江市徐闻县丛生盔形珊瑚,现保存于广东省微生物菌种保藏中心,编号为GDMCC 60006。
1.1.2 培养基 查氏琼脂培养基(CA),马铃薯葡萄糖琼脂培养基(PDA)。以上培养基均采用人工海水进行配制,海水配比为3%[15]。
1.1.3 试剂和仪器 SK8259试剂盒(真菌基因组DNA抽提试剂盒)、dNTP、DNA Ladder Mix maker、引物,购自上海生工生物工程股份有限公司;Taq-Tm DNA聚合酶,购自北京金石百优科技有限公司(MBI品牌);琼脂糖,购自生工生物工程(上海)股份有限公司(BBI品牌)。DYCP-31DN DNA电泳槽(北京六一仪器厂);FR980凝胶成像仪(上海复日科技仪器有限公司);2720 thermal cycler PCR仪(Applied Biosystems);HC-2518R冷冻高速离心机(BBI);DM4B数字显微镜(徕卡显微系统(上海)贸易有限公司)。
1.2 方法
1.2.1 菌株形态学鉴定 ①菌落观察:采用点植法将菌株接种于CA和PDA培养基上,28 ℃培养6 d,观察菌落大小、形态和色泽等,采用十字交叉法测量菌落直径。②个体形态观察:选取适宜培养基,对菌株进行插片法培养[16],每隔12 h进行形态观察。
1.2.2 分子学鉴定及系统发育树的建立 ①分子学鉴定:将菌株XWC14-13在PDA培养基上28 ℃培养7 d,取50 mg新鲜菌体,采用SK8259试剂盒提取DNA。PCR扩增引物为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4: 5′-TCCTC-CGCTTATTGATATGC-3′。25 μL反应体系:模板0.5 μL,10×Buffer 2.5 μL,dNTP 1 μL,酶0.2 μL,正向引物和反向引物均为0.5 μL,ddH2O 19.8 μL。PCR循环条件:94 ℃ 4 min;94 ℃ 45 s, 55 ℃ 45 s, 72 ℃ 1 min,30个循环;72 ℃10 min。对PCR扩增产物进行DNA测序,由生工(上海)生物工程股份有限公司完成。②系统发育树的建立:将测得的ITS序列上传到GenBank数据库中,根据菌株登录号在NCBI网站通过对比引擎BLAST进行在线对比分析,获取亲源关系较近菌株的基因序列,使用MEGA6.0软件构建系统发育树,从而确定菌株的亲缘关系。
1.2.3 菌株XWC14-13生理学特性研究 ①温度对菌株生长的影响:采用点植法将菌株接种在PDA培养基中心上,分别置于0、5、10、15、20、25、30、35、40、45、50 ℃ 10个温度梯度下培养5 d,每天用游标卡尺测量菌落直径,试验设3组平行。②酸碱度对菌株生长的影响:将PDA的pH值分别调至2.0、3.0、4.0、6.0、6.5、7.0、7.5、8.0、8.5、10.0、11.0、12.0,采用直径7.2 mm无菌打孔器将菌饼接种到平板中心,28 ℃培养5 d,每天用游标卡尺测量菌落直径,试验设3组平行。③盐浓度(体积分数)对菌株生长的影响:用海水晶将PDA的盐浓度分别配制成0%、1%、2%、3%、4%、5%、6%、10%、15%、20%,采用点植法接种,28 ℃培养5 d,每天用游标卡尺测量菌落直径,试验设3组平行。
1.2.4 数据统计分析 利用SPSS 19.0统计软件对实验数据进行方差分析和显著性测定。
2 结果与分析
2.1 菌株XWC14-13在CA和PDA培养基上生长状况及形态鉴定
菌株XWC14-13在CA和PDA培养基上培养6 d后均能显著生长,且在6 d内均能长成明显菌落。但在6 d内,PDA培养基上的菌落直径显著大于CA培养基(P<0.05)。在第1天时CA培养基的菌株直径为(2.81±0.65) mm,显著低于在PDA上生长的菌落直径(P<0.05)。第6天在CA上的菌株大小仅为在PDA上菌株大小的41%,表明PDA比CA更适宜此菌株生长(表1)。
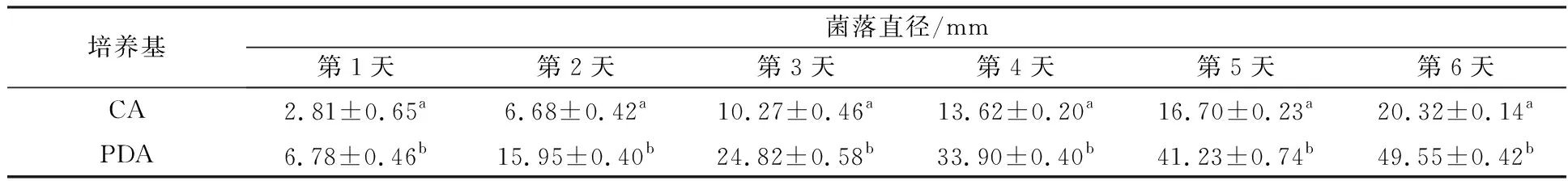
表1 菌株XWC14-13在CA和PDA培养基上不同培养时间的菌落直径(N=3,mm)
注:同一列平均数中标有不同字母,表示在0.05水平上差异显著,下表同
菌株XWC14-13在CA培养基上生长缓慢,第6天观察菌落正面为白色、中心紧实,四周质地呈薄而半透明状,绒毛疏松,反面无褶皱,且正、反两面无明显差异。菌株在PDA培养基上生长速度较快,菌落大且厚实、生长初期呈白色,第6天呈乳白色。正面平展,毛毡状,边缘较稀疏,菌落反面呈淡黄色,有向心褶皱及半透明螺纹(图1)。
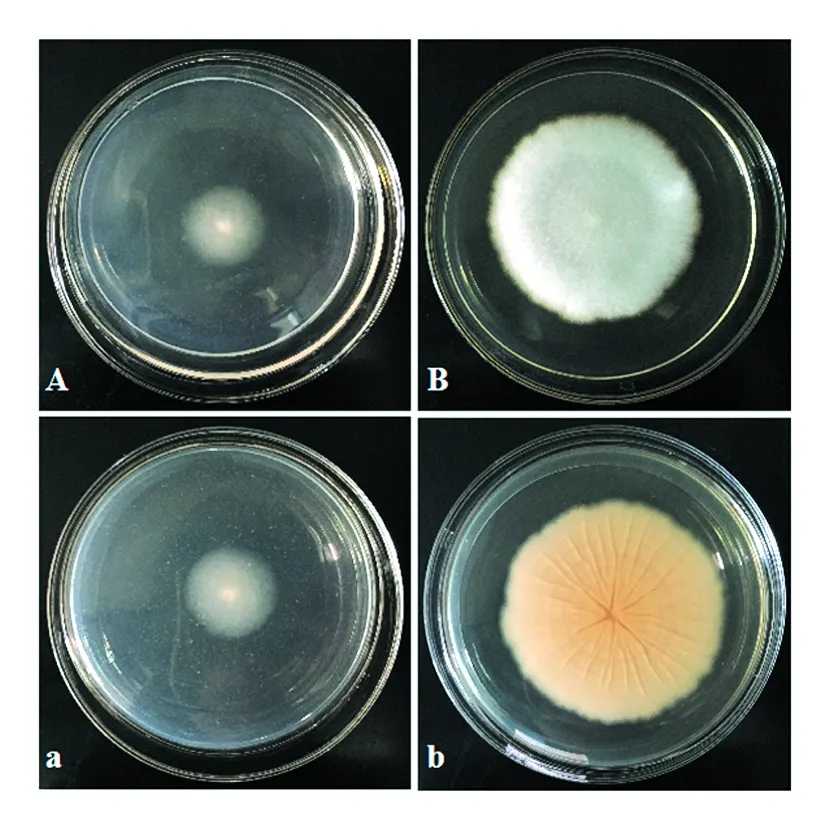
图1 菌株XWC14-13在CA和PDA上培养第6天的菌落特征Fig.1 Morphological characteristics of strain XWC14-13 developed on CA and PDA at 6th day A、B分别为菌株XWC14-13在CA和PDA培养基上的菌落正面特征;a、b分别为菌株XWC14-13在CA和PDA培养基上的菌落反面特征 A,B: Surface colony of XWC14-13 grew in CA and PDA; a,b: Back colony of XWC14-13 grew in CA and PDA
在PDA上培养24 h,菌株XWC14-13菌丝呈半透明状,产生少量小而光滑、透明圆形孢子囊;36 h孢子囊数量增多,部分从半透明变为褐色,顶生、侧生或着生于短的突起,或生于长柄或侧分枝上;48 h菌丝变粗糙,并产生少量半透明膈膜;60~72 h,孢子囊数量增多,变大且呈深褐色,呈现出圆形、卵圆形、烧瓶状,部分成熟脱落,此时囊托基本形成,膈膜颜色变深;84 h时,部分孢子囊破裂,释放大量孢子,孢囊孢子表面光滑,呈短小、细长、透明状,囊托形态明显(图2)。
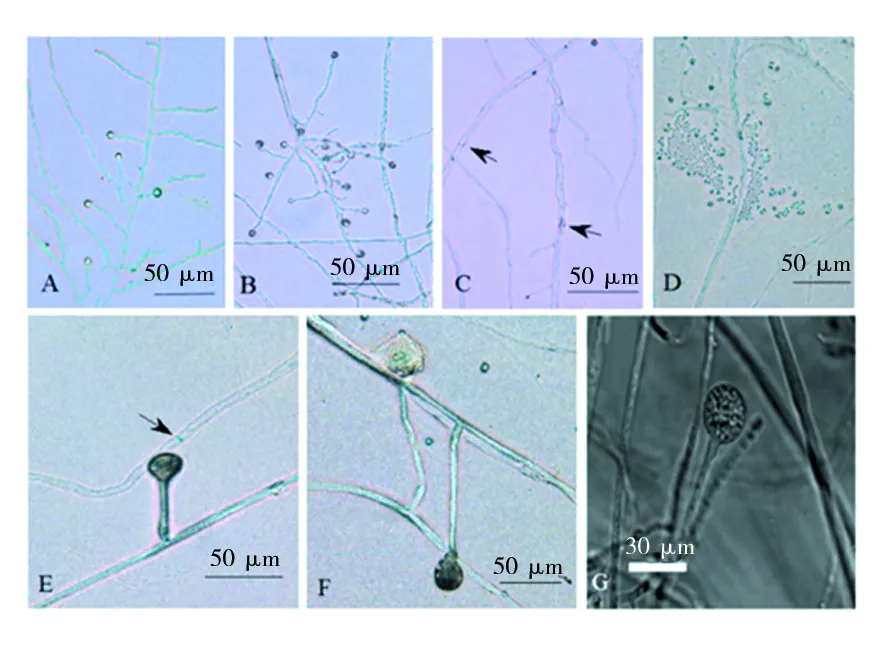
图2 菌株XWC14-13在PDA上的形态特征(28 ℃)Fig.2 Microstructure character of strain XWC14-13 on PDAA:幼龄菌丝(24 h);B:孢子囊(36 h);C:膈膜(48 h);D:孢囊孢子(84 h);E:孢子囊(72 h);F:孢子囊(84 h);G:对比菌株Gongronella butleri(KP055605)生长后期, 箭头指向横隔A: Young hyphae(24 h); B: Sporangium(36 h); C:Septate(48 h); D: Sporangiospore(84 h); E: Sporangium(72 h);F: Sporangium(84 h); G: The late growth stage of compared strain of KP055605, arrows to septate
整个生长过程中,菌株XWC14-13菌丝大小为3.62~8.09 μm,孢囊梗大小为4.88~6.76 μm,囊托大小为5.13~9.56 μm,孢子囊大小为(5.15~7.57) μm×(23.53~25.74) μm,孢囊孢子大小为(2.02~3.03)μm×(2.01~1.52)μm。菌株XWC14-13与Babu等[17]报道的菌株Gongronellabutleri(KP055605)形态大体相似,均有膈膜与孢子囊,但与对比菌株相比孢子囊较大,孢子较小,不产厚垣孢子。
2.2 系统发育分析
将所得ITS序列提交至GenBank数据库进行BLAST同源性比对,结果显示,菌株XWC14-13(KX911872)与球托霉属(Gongronellasp.)同源性最高,从GenBank中找出与XWC14-13同源性较高的7株菌株的基因序列,用MEGA6.0软件,NJ法构建系统发育树(图3),从图3可以看出,菌株XWC14-13与菌株Gongronellabutleri(KP055605)聚为一支,结合形态鉴定结果,将菌株XWC14-13鉴定为Gongronellabutleri。

图3 基于ITS序列的NJ系统发育树
2.3 温度对菌株XWC14-13生长的影响
菌株XWC14-13在15~35 ℃范围内均能生长,且生长速度差异较显著(P<0.05)(表2)。在30 ℃条件下生长速度最快,菌落直径最大;在15 ℃条件下生长速度极其缓慢,培养至第4天才有生长迹象;在35 ℃仍具有良好的生长状态,但在40 ℃不生长(表2)。菌落最适宜生长温度依次为30、35、25、20、15 ℃。

表2 不同温度对菌株XWC14-13菌丝生长的影响
注:“-”代表不生长,下表同
2.4 酸碱度对菌株XWC14-13生长的影响
菌株XWC14-13在pH 3.0~11.0之间均能生长,pH为2.0和12.0不生长。pH为3.0时PDA培养基呈液状,菌株可呈膜块状生长;pH为4.0~11.0条件下,菌株培养5 d内生长直径变化显著(P<0.05)。培养初期生长直径范围为8.90~10.52 mm,5 d时菌株直径均达到40 mm且最大值为45.84 mm(pH=8.5)(表3)。
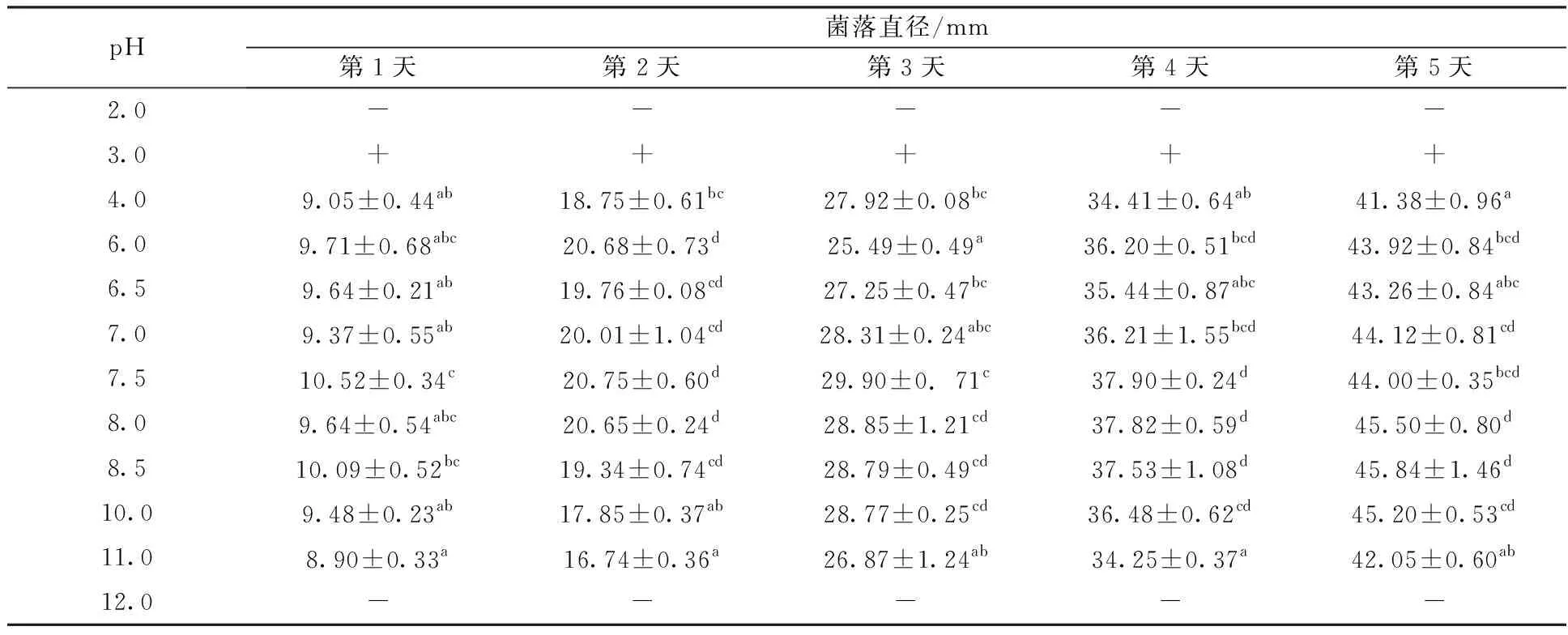
表3 不同pH对菌株XWC14-13生长的影响
注:“+”代表液体生长
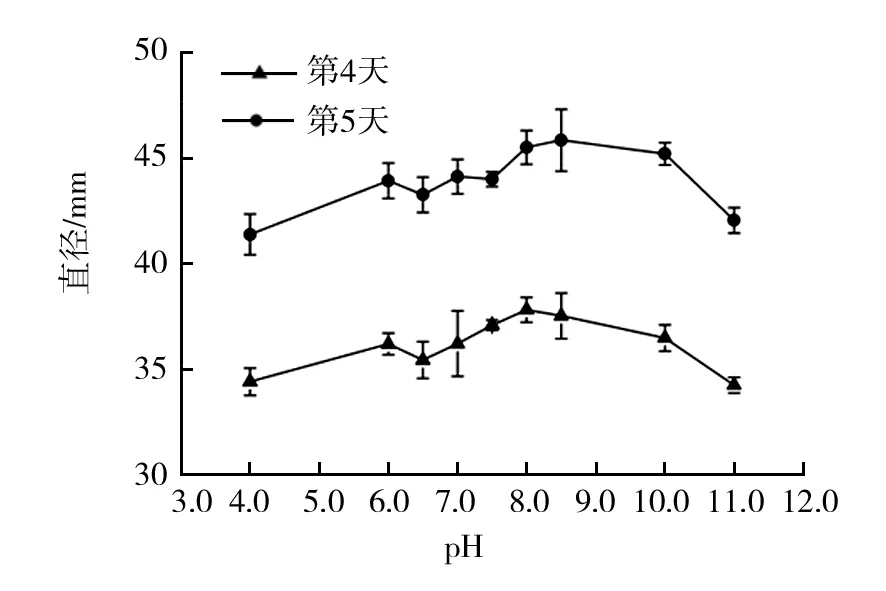
图4 菌株XWC14-13在不同pH时第4天与第5天生长比较Fig.4 Growth comparison of strain XWC14-13 in different pH on day 4th and 5th
从图4可看出,第4天时,菌株生长直径较大的pH范围为7.5~8.5,第5天的最适pH为8.0~10.0,综合分析可筛选出菌株最适宜生长的pH范围为8.0~8.5。
2.5 盐浓度对菌株XWC14-13生长的影响
菌株XWC14-13在盐浓度为0~10%(体积分数)范围内均能生长,15%不生长(表4)。在盐度为1%时生长最好,盐质量浓度为2%~4%生长较好,第5天的菌落直径均达到30 mm以上。随盐质量浓度增加,生长速率逐渐降低,盐质量浓度为10%时生长显著减缓(P<0.05)(表4)。在无盐环境下,菌株仍能生长,但速率较低。
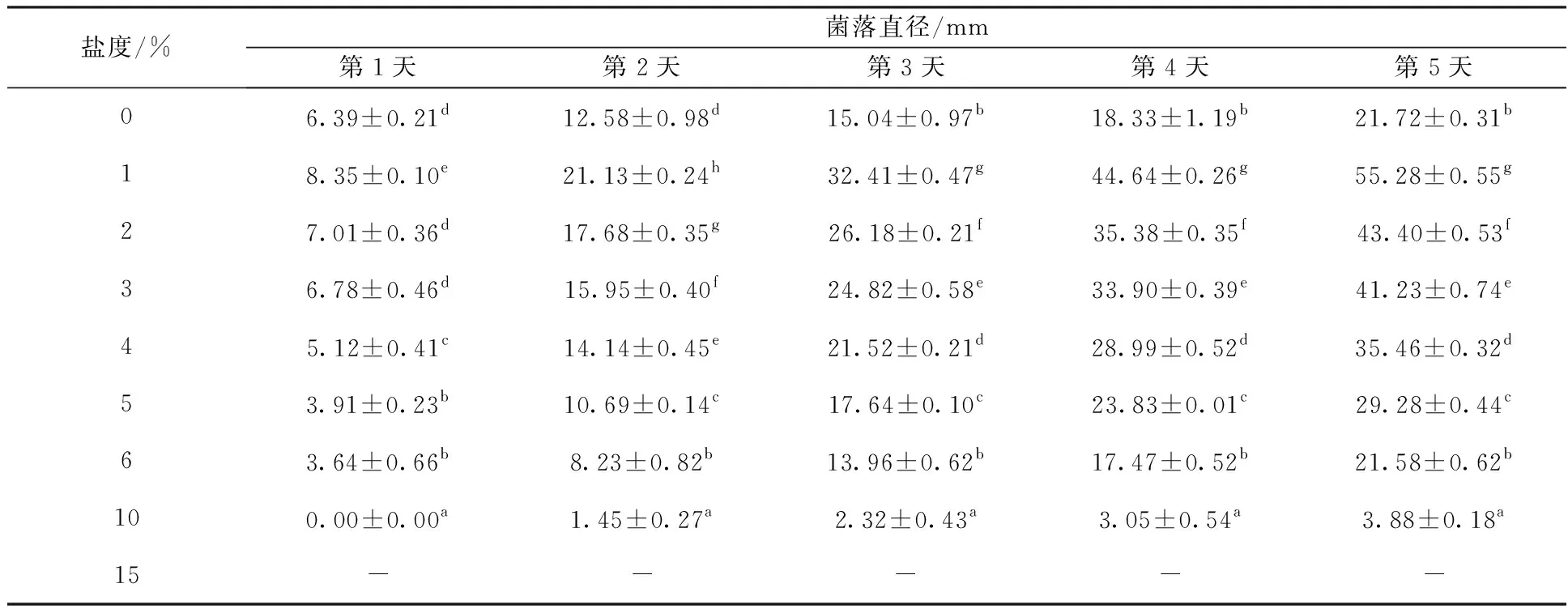
表4 不同盐度对菌株XWC14-13菌丝生长的影响
3 讨 论
本研究对珊瑚共附生真菌中分离的菌株XWC14-13进行形态学和ITS1-ITS4分子鉴定,表明该菌株与报道菌株Gongronellabutleri(KP055605)[17]极为相似,因此鉴定菌株XWC14-13为卵形球托霉Gongronellabutleri,但该菌未产厚垣孢子,且孢囊孢子显著小于对比菌株。生理学特性研究结果表明,菌株XWC14-13在PDA培养基上生长迅速,最适温度为30 ℃,pH为8.0~8.5,盐度1%,但其在pH 3.0~11.0范围内均能生长良好,具有广泛的酸碱耐受性。 Nguyen等[18]研究的1株来自森林土壤的Gongronellasp.在PDA培养基上生长最好,李桂舫等[19]研究了分离自黄海和渤海海域漂流木上的4株海生毛壳菌,与菌株XWC14-13均具有相似特征,海水偏碱性且具有一定盐度,此菌株最适生长条件偏碱性,并有耐盐能力,因此可初步判断其符合海洋真菌的生理特性。巴斯洛[20]在1985年提出兼性海洋微生物的概念。Sakayaroj等[21]表明植物内生真菌同样存在于海洋,并具有在海洋环境中生长和繁殖的能力。目前已有大量研究表明兼性物种在基因组成、生态功能及生理活性方面具有多样性[22-24]。王军等[25]从南海红树内生真菌中分离出的异香豆素 avicennin-A,是一种陆生真菌代谢产物中未见报道的化合物。与本研究菌株相似的球托霉菌属多从土壤中分离[26-28],目前并未在其他环境中发现。菌株XWC14-13分离自海洋环境,最适宜生长条件与海洋环境条件相符,具有一定的耐盐性,但在无盐环境下也可生长,属于兼性海洋微生物,比在土壤中分离得到的同种菌具有更强的环境适应性与抗逆性,具有更大的开发潜力。目前本团队前期研究发现菌株XWC14-13具有一定的抗菌活性,其他性质有待进一步研究。
目前关于Gongronellabutleri的应用研究较少,主要通过酶解细胞壁或紫外诱变方法制备高纯度壳聚糖和壳聚糖-葡聚糖复合物[29-30]。壳聚糖和葡聚糖作为重要的真菌骨骼多糖,主要存在于接合菌纲的细胞壁中,对其结构组成起到重要作用[31-32]。Nwe等[33]在强碱条件下,使用热稳定α-淀粉酶对生长在红薯片上的Gongronellabutleri菌株进行酶解细胞壁(95 ℃、5 h),获得高纯度的壳聚糖与壳聚糖-葡聚糖复合物,其稳定的三维网状结构在医学领域具有广泛的应用前景[34-35]。

