滇金丝猴粪便类固醇激素抽提及检测方法评估
黎嘉欣杨秋立普天春卢雁平王伟刘学锋刘定震
(1.北京师范大学生命科学学院,教育部生物多样性与生态工程重点实验室,北京,100875;2.圈养野生动物技术北京市重点实验室,北京动物园,北京,100044)
近年来,非损伤取样法在野生动物激素水平检测上得到了充分的运用,其中粪便样品因其采集、保存和运输便利等优势而被广泛使用[1]。正常情况下,粪便中性激素浓度与血液中性激素浓度正相关[2]。然而,由于激素在粪便中的代谢有滞后性,粪便与血液样品的激素检测结果会呈现分泌高峰时间不一致的现象[3],加之对激素的不同抽提和检测方法,往往导致最终检测结果迥异。如何选择合适的激素抽提方法和测定方法,是准确反映动物体内类固醇激素水平的关键[4]。
非人灵长类的繁殖行为及结果多由雌性的发情状况决定,通过监测雌性的性激素水平可以深入了解其繁殖策略。以往在恒河猴(Macacamulatta)[5]、日本猕猴(Macacafuscatafuscaca)[6]、夜猴(Aotustrivirgatus)[7]、黑叶猴(Trachypithecusfrancoisi)[8]、滇金丝猴(Rhinopithecusbieti)[9]等多数非人灵长类中均有较好的应用。雌二醇(estradiol,E2)或孕酮(progesterone,P4)分泌水平的高低基本能反映雌性的繁殖状态[10-12]。而王慧平等对川金丝猴(Rhinopithecusroxellana)粪尿激素抽提方法比较的结果显示,不同抽提方法的萃取率存在差异[11]。考虑到不同物种,乃至同一类群的不同种群粪便中激素代谢物的种类均可能不同[4],且不同激素性质有所差异,所以针对不同种类的灵长类和激素可能需要考虑不同的激素提取和检测方法。
滇金丝猴隶属于灵长目(Primates)猴科(Cercopithecidae)疣猴亚科(Colobinae)仰鼻猴属(Rhinopithecus),是我国特有的珍稀灵长类动物。目前野生种群数量约为2500只,栖息地破碎化和丧失比较严重[13]。圈养种群总数为29只,主要饲养于北京动物园、昆明动物园和昆明动物研究所。以往对滇金丝猴种群的地理分布、群体行为、食性等开展了一系列研究[14-15],但受限于野外工作条件,对该物种的繁殖行为与激素水平的研究较少。借助针对圈养种群繁殖行为与激素水平关系的研究,不仅可为圈养滇金丝猴的迁地保护提供理论支持,同时为进一步对野生种群的研究奠定基础。为此,本文分别采用3种抽提方法与2种检测方法,对圈养雌性滇金丝猴粪样中E2及P4含量进行了检测,并比较了不同方法组合的激素相对含量、相对误差和变异系数,以期探索适用于滇金丝猴粪便样品激素检测的合适方法,为进一步研究野生滇金丝猴的繁殖生理提供参考依据。
1 材料与方法
1.1 实验动物
实验所用21份粪便样品分别采集于北京动物园昌平十三陵饲养繁育基地的一雄二雌繁殖群中的2只成年雌性滇金丝猴——“芳芳”与“大庆”,以及北京动物园的成年雌性“01-2”,共计3只个体。其中“大庆”的粪便7份、“芳芳”的粪便6份、“01-2”的粪便8份。
1.2 实验方法
1.2.1 粪便样品的采集、保存与干燥
实验人员站在笼舍周围,观察目标个体,一旦发现其排便后,将粪便除去杂物后立即装于自封袋,标记日期、时间和个体名称,保存于-20℃冰箱,待测。将收集的21份粪便样品放于-70℃冰箱冷冻过夜,记录粪便重量41.13 g。-55℃真空冷冻干燥机中干燥约9 h,记录冻干粪便重量13.72 g(含水量为66.64%),将粪便样品研磨成粉末状并筛除杂质。所有粪便样品放入同一离心管中,置于涡旋仪上振荡至混合均匀,以排除不同个体、不同采集时间等因素对检测结果可能造成的影响。
1.2.2 激素提取
根据王慧平等[11]对于川金丝猴的粪便类固醇激素抽提方法的评估,并参考其他非人灵长类动物粪便激素提取中常用抽提方法和改良途径,采用以下3种抽提方法进行激素的提取。
乙醇加热法(ethanol-heating method,EH):参照Wasser等[10]的步骤,应用80%乙醇对0.1 g混合粪样进行抽提,其中煮沸改为70℃水浴20 min,离心条件由室温改为4℃,并合并2次上清液,将其置于60℃条件下氮气吹干后加入1 mL 0.05 mol/L的PBS溶解,离心后将上清转移至2 mL的离心管待测。
乙醇-蒸馏水法(ethanol-distilled-water method,EW):参照高云芳等[16]的步骤,首先应用5 mL 80%乙醇对0.1 g混合粪样进行抽提,其中超声波振荡改为涡旋振荡,并将37℃水浴干燥步骤改为37℃氮气吹扫仪干燥。在加入1 mL 0.05 mol/L的PBS溶解后,37℃水浴振荡30 min,离心后将上清转移至2 mL离心管待测。
乙醇-丙酮法(ethanol-acetone method,EA):参照Heistermann等[17]的步骤,首先应用4 mL无水乙醇和1 mL无水丙酮对0.1 g混合粪样进行抽提,离心条件由室温改为4℃,60℃条件下氮气吹扫,之后加入0.05 mol/L的PBS溶液复溶,离心后将上清转移至2 mL的离心管待测。
分别以上述3种方法对粪样中的雌二醇和孕酮进行抽提,各重复6次。同时对每种抽提方法各设置1个空白对照组,即不加入粪样,完成全部抽提步骤并保存所得溶液,与上述样品进行同一批次的激素检测,以排除抽提步骤所用试剂对检测试剂盒中抗体与激素的反应可能造成的影响。
1.2.3 粪便激素水平检测
将上述激素抽提样品,每份各取500 μL于2 mL离心管中留作P4的RIA法和ELISA法检测。对于乙醇加热法以及乙醇蒸馏水法,将样品分别稀释48倍和64倍留作E2的ELISA法的检测,均稀释80倍的样品留作E2的RIA法的检测;对于乙醇丙酮法,将样品稀释8倍留作E2的检测,确保其检测结果处于相应试剂盒的允许检测范围之内,将稀释后的样品存于-20℃冰箱。激素检测委托北京北方生物研究所完成。每份样品平行测试3次。所用检测试剂盒分别为碘[125I]雌二醇和碘[125I]孕酮放射免疫分析试剂盒、雌二醇和孕酮定量测定酶联免疫试剂盒(北方生物研究所,北京)。有关试剂盒的详细参数详见说明书。
1.3 数据分析
首先,采用Kolmogorov-Smironov test检验数据是否符合正态分布,然后以检测方法作为组间因子,抽提方法作为组内连续检测变量对数据进行重复测量的双因素方差分析(repeated measure two-way ANOVA),随后,对具有显著差异的组合分别进行配对t-检验(paired-samplettest),分析抽提方法与检测方法对检测结果的影响。
由于2个检测方法对同一类固醇性激素的灵敏程度和每个抽提方法对空白对照组的反应程度不同,不能直接对2种方法空白对照组的平均检测含量进行比较,所以使用相对误差描述空白对照组检测结果对抽提及检测方法组合检测结果的影响。其计算公式为:相对误差=空白对照组平均检测含量/实验组平均检测含量×100%。结合平均激素含量与相对误差,比较得出提取效率较高且受空白对照影响较小的抽提与检测方法组合。
根据公式CV%=(SD/Mean)×100%计算每个组合的变异系数,对比获得稳定性较高的抽提及检测方法组合。
所有统计检验通过SPSS 20.0(IBM Corporation,NY,USA)完成。借助OriginPro 8.0绘图。显著水平为0.05,P<0.01为差异极显著。数据用Mean±SD表示。
2 结果与分析
2.1 不同抽提方法与检测方法对粪便中类固醇性激素检测结果影响的比较
以抽提方法为组内因子,以检测方法为组间因子对粪便中孕酮含量检测结果进行two-way ANOVA分析,结果表明,使用不同抽提方法与不同检测方法检测,结果均有极显著差异(P均为0.0001),且抽提方法与检测方法之间有交互作用。进一步多重比较分析结果表明,对于RIA与ELISA两种检测方法,乙醇加热法与乙醇-蒸馏水法之间均没有显著差异,而乙醇-丙酮法的检测结果显著低于另外两种抽提方法的检测结果(图1)。
以抽提方法为组内因子,以检测方法为组间因子对粪便中雌二醇含量检测结果进行repeat measure two-way ANOVA分析,结果表明,RIA与ELISA两种检测方法对测定结果有极显著影响(P=0.0001);乙醇加热法与乙醇蒸馏水法2种抽提方法的测定结果间无明显差异(P=0.584);抽提方法与检测方法之间无交互作用(图2)。对于乙醇加热法,RIA结果显著低于ELISA的检测结果;而对乙醇-蒸馏水法,两种检测方法的结果无明显差异(图2)。
2.2 比较不同抽提及检测方法的组合间粪便类固醇激素的平均激素含量、相对误差及变异系数的差异
对混合粪样中的孕酮而言,乙醇-丙酮法的激素含量测定结果明显偏低,乙醇加热法与乙醇-蒸馏水法无明显差异;对于混合粪样中的雌二醇而言,乙醇-蒸馏水法的激素含量测定结果较高,提取效率较高(表1)。

图1 不同抽提方法与检测方法对应的粪便中孕酮的检测结果(柱图表示Mean±SD)。本研究对数据使用two-way ANOVA进行分析,并对具有显著差异的组合进行了paired-sample t test,对有显著差异的数据使用不同上标或是横线连接后以星号标注Fig.1 Mean content of progesterone(P4)in mixed fecal sample under different extraction and test methods.Bars with different letters,either capital or small letters in the same assay method,indicate significant differences(repeated measure two-way ANOVA followed by post hoc test of paired-sample t test)
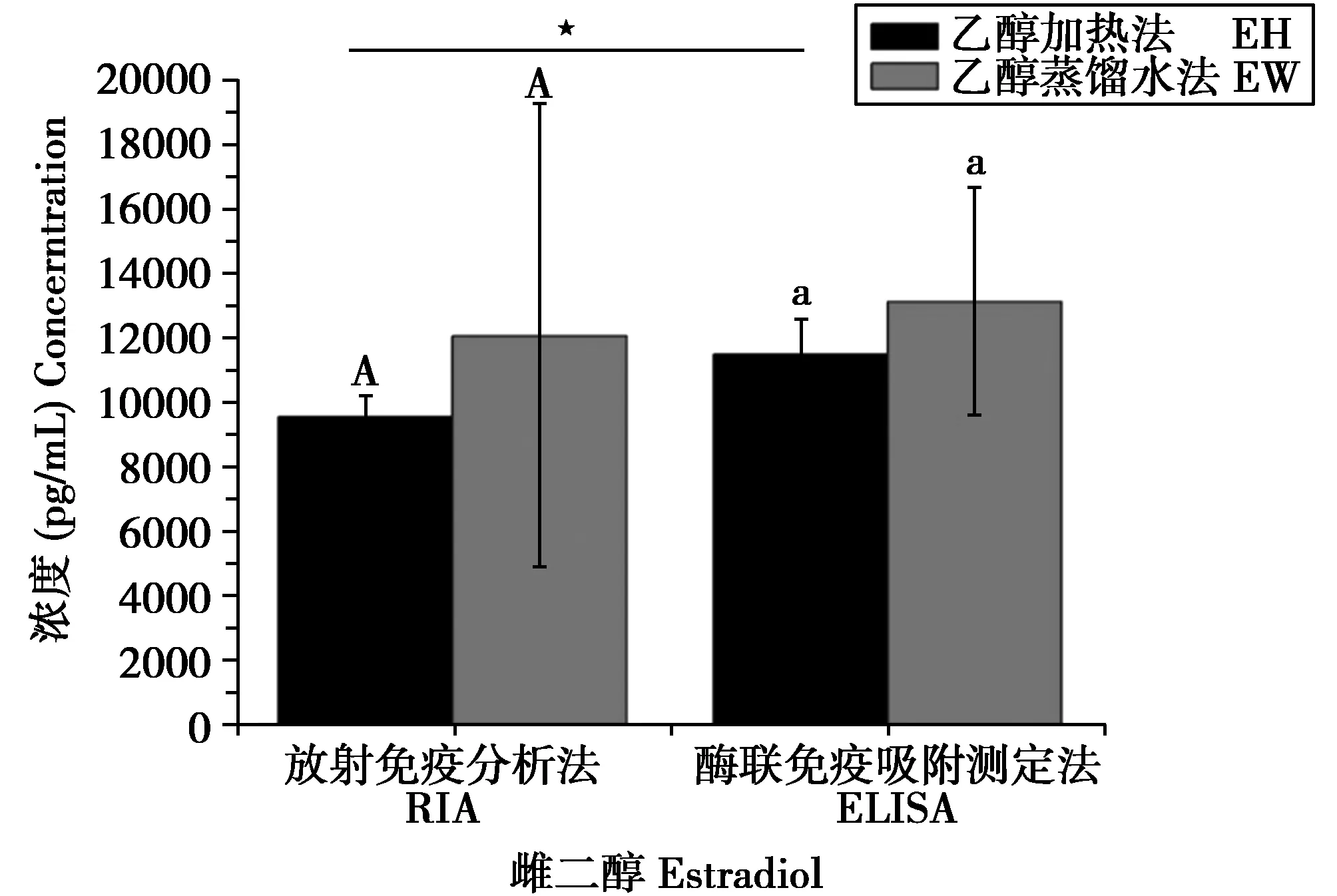
图2 不同抽提方法与检测方法对应的粪便中雌二醇的检测结果(柱图表示Mean±SD)。本研究对数据使用two-way ANOVA进行分析,并对具有显著差异的组合进行了paired-sample t test,对有显著差异的数据使用不同上标或是横线连接后以星号标注Fig.2 Mean content of estradiol(E2)in mixed fecal sample under different extraction and test methods.Bars with different letters,either capital or small letters in the same assay method,indicate significant differences(repeated measure two-way ANOVA followed by post hoc test of paired-sample t test)
表1 不同抽提与检测方法的混合粪样激素含量测定结果(Mean±SD)

Tab.1 Fecal concentrations of progesterone and estradiol using different extracting and testing methods
相对误差的大小能够在一定程度上表明测定结果的准确度,相对误差小则检测方法的准确度高。对于孕酮而言检测准确度较高的组合有二:RIA与乙醇加热法的组合以及ELISA与乙醇-丙酮法的组合;对于雌二醇而言检测准确度有明显优势的是RIA,其中乙醇加热法的空白对照组未检测出激素含量(表2)。
表2 不同抽提与检测方法的空白对照激素含量测定结果(Mean±SD)及混合粪样的相对误差
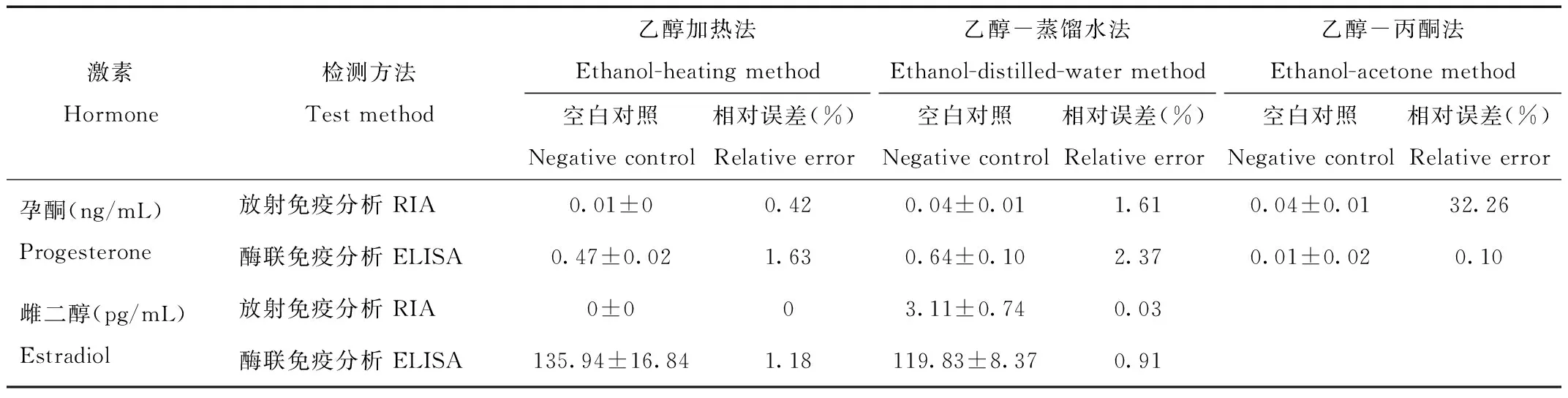
Tab.2 Fecal concentrations of progesterone and estradiol in negative control(Mean±SD)and relative errors using different extracting and testing methods
注:相对误差=空白对照组平均检测含量/实验组平均检测含量×100%
Note:Relative error=content of negative control/content of fecal sample×100%
变异系数的大小能够表征检测的稳定性,变异系数小则方法组合的稳定性高。孕酮检测结果变异系数较小的组合为RIA与乙醇加热法;对于雌二醇而言,乙醇加热法的变异系数明显小于乙醇-蒸馏水法,其中与RIA的组合变异系数最小(表3)。
表3 不同抽提方法与检测方法组合检测结果的变异系数

Tab.3 Coefficient variation of fecal progesterone and estradiol level using different extracting and testing methods
注:变异系数CV%=(SD/Mean)×100%
Note:CV%=(SD/Mean)×100%
3 讨论
本研究结果表明,不同的激素抽提和检测方法对滇金丝猴粪便中孕酮和雌二醇的检测结果都有显著影响。对于孕酮,乙醇-丙酮法提取效率明显偏低,乙醇加热法与乙醇-蒸馏水法在提取效率上无明显差异,但乙醇加热法与RIA法组合检测结果的准确性较高;同时乙醇加热法与RIA的组合变异系数明显较小,稳定性较高,因此可认为乙醇加热法与RIA的组合有较明显的优势。本研究中乙醇丙酮法提取效率偏低的结果,与以往针对黄狒狒(Papiocynocephalus)、绢毛猴(Callithrixjacchus)、鞍背狨(Saguinusfuscicollis)、棉顶狨(Saguinusoedipus)和川金丝猴雌性个体粪样中孕酮回收率较高(>80%)的结果[11,17-18]不同。这表明种属差异可能是影响不同抽提及检测方法组合的抽提率和稳定性的因素之一。对于雌二醇,乙醇-蒸馏水法提取效率较高,但乙醇-蒸馏水法稳定性明显偏低且步骤繁琐,不利于针对野外大批量的粪样处理操作。乙醇加热法中,RIA与ELISA两个检测方法的稳定性表现差异不大,但由于ELISA测定的雌二醇含量相对误差较大,综合考虑认为乙醇加热法与RIA的组合较有优势。
乙醇加热法与RIA的组合对于雌二醇与孕酮均为较理想的抽提检测方法组合。乙醇加热法是经典、简便的激素抽提方法,在多个物种的粪样激素抽提中均有较理想的应用[10-11,19-20]。3种抽提方法在抽提激素的过程中均涉及干燥步骤,常用方法有恒温水浴和氮气吹扫。由于水浴蒸干耗时极长,本实验将干燥条件统一改为氮气吹干,并保留原方法中要求的水浴温度,以加快抽提速度,但相应的抽提成本有所增加。RIA是最早用于激素检测的免疫检测法,在1969年已有人用于检测血清中E2的含量。该法灵敏度较ELISA高且结果稳定,但要求必须在具备资质的同位素实验室操作,具有对实验室防护条件要求高、试剂存放周期短等缺点。若实验室条件允许,建议选用RIA进行激素水平检测。
综上所述,建议在实验条件允许的情况下,采取氮气吹干法改良的乙醇加热法提取激素,以RIA法检测滇金丝猴粪便中雌二醇与孕酮含量。同时,建议以类固醇激素水平监测其他灵长类动物的繁殖行为时,最好综合本文提及的3种参数比较方法,首先对激素抽提法进行筛选,然后再进行后续的检测。
致谢:感谢北京动物园的饲养员帮助采集金丝猴粪便样品,西北大学生命科学学院王慧平提供参考文献,北京师范大学生命科学学院佟丽借用冷冻干燥机、硕士研究生唐如春、博士研究生刘若爽与范鹏来等提供技术指导,谨此表示诚挚的谢意!

