p75神经营养素受体在小鼠坐骨神经挤压伤后的表达变化特点
,,,
(1 临沂市人民医院,山东 临沂 276003;2 山东医学高等专科学校)
p75神经营养素受体(Neurotrophin receptor,NTR)作为肿瘤坏死因子受体超家族的成员之一,在神经修复中发挥关键作用。神经营养素与p75NTR结合,可以调控不同的信号通路,介导细胞的存活、分化、生长和凋亡[1-2]。p75NTR生物学功能取决于配体的生物学特性、与配体结合后的相互作用、蛋白水解处理过程和激动的信号传导途径等因素[3]。在周围神经损伤时,p75NTR表达与神经再生和神经保护有着密切的关系。目前,对于周围神经损伤后p75NTR表达变化特点尚不清楚,本研究通过观察小鼠坐骨神经挤压伤后不同时间点p75NTR表达水平,以探讨其表达变化特点。
1 材料和方法
1.1实验动物及分组 选取野生型健康雄性C57BL/6小鼠42只,8~10周龄,体重22~25 g,购于北京维通利华实验动物技术公司,许可证号SCXK (京) 2012-0001。小鼠饲养环境为层流环境,保持环境温度在22~24 ℃,相对湿度在50%~60%,光控周期12 h,给光时间7:00-19:00。将实验小鼠随机分为假手术组及模型组,各21只。模型组根据成模时间分为成模前、成模后0、3、7、14、21、28 d等7个时间点,每个时间点各3只。
1.2主要实验试剂 异氟烷(上海雅培制药有限公司);TRIzol(Invitrogen,美国);PrimeScript 逆转录试剂盒和SYBR 实时荧光定量试剂盒(TaKaRa,日本);RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、SDS-PAGE凝胶配制试剂盒(碧云天生物公司);Anti-GAPDH抗体、兔抗鼠p75NTR抗体、HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG(abcam,美国)。氯仿、异丙醇及无水乙醇等均为国产分析纯。
1.3动物模型制备 实验小鼠采用异氟烷吸入麻醉(2%异氟烷+98%氧),按照文献[4]报道使用钳夹法制作小鼠坐骨神经挤压伤模型。麻醉成功后,备皮、常规碘伏消毒,小鼠俯卧于手术台上,在左侧臀部作长约2 cm斜切口,钝性分离坐骨神经,使用全新显微光滑血管钳(Fine Science Tools,型号13006-12)在坐骨结节远端5 mm处钳夹坐骨神经,定量压1扣,持续时间60 s。假手术组仅暴露坐骨神经,无坐骨神经钳夹,其余同模型组。术后小鼠分笼喂养。实验过程中对动物处置严格遵守科学技术部2006年发布的《关于善待实验动物指导性意见》要求。
1.4标本采集与处理 在成模前、成模0、3、7、14、21、28 d等7个时间点随机取假手术组和模型组小鼠各3只,在深麻醉状态下,将小鼠俯卧于手术台上,暴露坐骨神经,取坐骨神经损伤部位近端2 mm处到损伤部位远端2 mm处标本,置于-80 ℃低温保存备用。
1.5检测指标及方法
1.5.1p75NTRmRNA表达的检测 用 TRIzol 法提取坐骨神经组织总RNA,紫外分光光度计测定总RNA浓度及纯度。使用 PrimeScript 逆转录试剂盒行逆转录,反应条件为37 ℃ 15 min、85 ℃ 5 s。采用SYBR实时荧光定量试剂盒进行RT-qPCR,PCR引物序列见表1。使用the Step One Plus定量 PCR 仪扩增和检测,反应条件 95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,40个扩增循环,内参为GADPH,使用2-ΔΔCt方法对p75NTRmRNA表达水平进行相对定量分析。
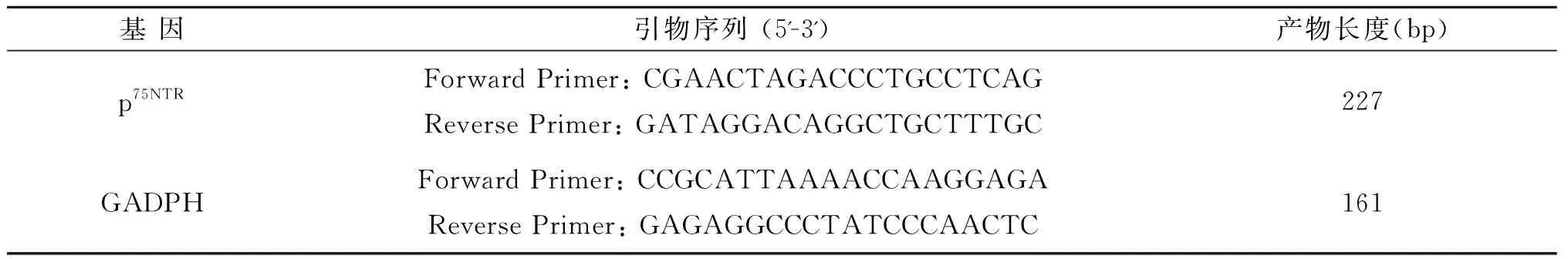
表1 PCR引物序列及扩增目的DNA片段长度
1.5.2p75NTR蛋白表达的检测 使用RIPA裂解液将坐骨神经组充分裂解,BCA法对蛋白定量。取 50 μg蛋白样本与蛋白上样缓冲液按比例混匀,100 ℃水浴5 min;SDS-PAGE蛋白电泳,300 mA恒流转膜2 h,5%脱脂奶粉室温封闭2 h;兔抗p75NTR抗体(1:500)和鼠抗Anti-GAPDH抗体(1:2000)4 ℃ 孵育过夜;加HRP标记的山羊抗兔IgG/山羊抗鼠IgG(1:4000),室温下孵育2 h;ECL 化学发光、显影,使用Image Pro Plus 软件分析条带灰度值,GADPH为内参。
2 结果
2.1两组p75NTRmRNA表达的比较 成模前假手术组与模型组p75NTRmRNA表达无显著性差异(P>0.05),在成模第3天模型组p75NTRmRNA表达升高,与成模前比较有显著性差异(P<0.01);模型组p75NTRmRNA表达在成模第7天达峰值,在成模第3、7、14天 p75NTRmRNA表达均高于假手术组(P<0.01),在成模第21天降至成模前水平(P>0.05);假手术组(图中Sham组)在各个时间点p75NTRmRNA表达无明显差异(P>0.05)。见图1。
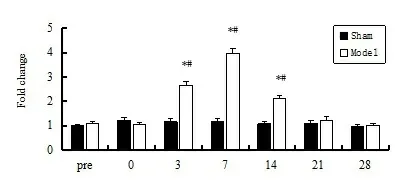
图1 RT-qPCR检测坐骨神经挤压损伤部位p75NTR mRNA相对表达量
2.2两组p75NTR蛋白表达的比较 成模前两组p75NTR蛋白表达水平无明显差异(P>0.05),在成模第3天模型组p75NTR蛋白表达水平开始升高,与成模前比较有显著性差异(P<0.01);在成模第14天模型组p75NTR蛋白表达水平达峰值,在成模第3、7、14及21天模型组p75NTR蛋白表达水平均高于假手术组(P<0.01),在成模第28天降至成模前水平(P>0.05);假手术组在各个时间点p75NTR蛋白表达水平比较无明显差异(P>0.05)。见图2。
3 讨论
p75NTR与神经营养素结合,可以对神经再生发挥双向生物学调节作用[5]。正常情况下中枢和外周神经p75NTR处于低表达状态,而在多种损伤作用下p75NTR的表达明显上调[6-7]。在周围神经损伤后,损伤远端神经纤维发生华勒氏变性,轴突的缺失可诱导施万细胞中p75NTR表达,而p75NTR表达上调参与轴突再髓鞘化。在神经损伤修复不同时期p75NTR表达状态会对神经再生有不同的影响作用。因此,明确周围神经损伤后p75NTR表达变化特点对进一步探讨p75NTR对损伤神经的再生作用及调节机制十分重要。
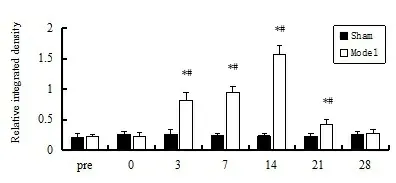
图2 Westernblot检测坐骨神经挤压损伤部位p75NTR 蛋白表达量
本研究表明,在坐骨神经挤压伤后p75NTRmRNA和蛋白的表达上调,其表达量与坐骨神经损伤后时间有关。在伤后第3天神经损伤部位p75NTRmRNA表达开始升高,第7天达到高峰,第21天降至成模前水平;而p75NTR蛋白表达在伤后第3天开始升高,第14天达到高峰,第28天降至成模前水平。笔者发现实验结果中p75NTRmRNA和蛋白表达峰值不一致,其可能原因与神经损伤后不同的调节机制导致转录产物和蛋白存在合成及降解的差异[8],即mRNA达到峰值时蛋白表达还在增加,而在蛋白达到峰值时mRNA已经降解,从而导致p75NTRmRNA和蛋白表达水平并不完全一致。既往研究[9]发现,坐骨神经挤压伤小鼠坐骨神经功能指数(SFI)在术后第10天降至谷值,然后SFI逐渐升高,在损伤后2~3周神经功能恢复最快,持续至术后4周,说明坐骨神经挤压伤后神经功能恢复也存在相似的时间相关性。笔者推测p75NTR蛋白可能参与调节坐骨神经挤压伤后神经再生。
综上所述,在小鼠坐骨神经挤压伤后p75NTR表达上调,其表达水平与损伤后时间密切相关,p75NTR表达的时序性特点可能与损伤神经再生修复有关,为进一步探讨p75NTR在坐骨神经挤压伤后神经再生的作用机制提供了理论基础。

