低磷胁迫对太空诱变耐低磷柱花草酸性磷酸酶活性和磷效率的影响
刘攀道,郇恒福,刘一明,刘国道,白昌军,陈志坚
(中国热带农业科学院热带作物品种资源研究所,农业部华南作物基因资源与种质创制重点实验室,海南 儋州 571737)
磷(phosphorus, P)是植物生长发育不可缺少的大量营养元素之一,在植物新陈代谢过程中发挥着重要作用[1]。土壤中的磷主要以无机难溶性磷(铁磷、铝磷和钙磷等)和有机磷的形式存在,不能直接被植物吸收利用[2]。无机可溶性磷(Pi)是植物可以从土壤中直接吸收的主要磷形式,但Pi在土壤中的浓度较低,难以满足植物正常生长发育的需要[3]。全球近70%的耕地中存在磷有效性低的问题,特别在酸性土壤中,低磷胁迫已成为限制这些地区农作物和牧草生产的主要障碍因子之一[4-5]。
在植物适应环境的长期进化过程中,形成了一系列适应性机制来应对低磷胁迫,如通过调控根系形态构型的改变,从而扩增根系与土壤的接触面积[6];与AM真菌形成共生菌根来增强植物从根际土壤中获取磷素的能力[7];根系分泌有机酸和磷酸酶来促进对难溶性磷和有机磷的活化利用[8];诱导高亲和磷转运蛋白表达来提高根系对土壤中磷素的吸收能力[9]等。酸性磷酸酶(acid phosphatase, APase, ACP)是一类能催化磷酸单酯或酸酐裂解从而释放无机磷酸根离子,且最适pH低于7.0的水解酶类[10],ACP活性的增加被认为是植物适应低磷环境的普遍响应[11]。对拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)、玉米(Zeamays)、大麦(Hordeumvulgare)、小麦(Triticumaestivum)、大豆(Glycinemax)和菜豆(Phaseolusvulgaris)等多种植物的研究表明,在低磷胁迫下,这些植物体内的ACP活性均显著增加,从而促进植物对有机磷的活化利用[12-13]。
柱花草(Stylosanthesspp.)原产于美洲和非洲的热带与亚热带地区。我国从20世纪60年代开始引种柱花草,目前,柱花草已成为我国南方地区重要的热带豆科牧草之一[14-15]。柱花草对酸性低磷土壤的适应性强,能高效活化利用外源有机磷[16]。最近,通过分子生物学研究手段鉴定到3个柱花草ACP,即SgPAP7、SgPAP10和SgPAP26,这些ACP参与了柱花草对外源核苷酸类有机磷(dNTP)的活化利用[17]。但是,关于柱花草ACP参与其体内磷活化利用的生理机制仍不清楚。本研究以前期研究中获得的太空诱变耐低磷柱花草突变体TPRC2001-84及其亲本热研2号(RY2)为材料[18],通过分析它们在低磷胁迫下的生物量、磷效率、细胞壁磷含量和ACP活性的差异,解析TPRC2001-84耐低磷的生理机制。
1 材料与方法
1.1 植物材料和培养条件
本课题组前期利用返地卫星对柱花草RY2的种子进行空间辐射诱变处理,通过对诱变后代进行连续5年选育,获得了85个稳定品系[14],其中TPRC2001-84在酸性缺磷土壤的田间试验条件下(土壤速效磷含量0.3~1.8 mg·kg-1,试验期间不施磷肥),其干草产量显著高于亲本RY2,具有优良的耐低磷特性[18]。本研究以TPRC2001-84和RY2柱花草为试验材料,于2016年8-9月在海南省儋州市中国热带农业科学院牧草基地网室内,通过营养液水培方法,对柱花草进行低磷胁迫处理[16,19-20]。柱花草种子萌发后,先在1/2 Hoagland营养液中培养2周,随后进行正常供磷(+P,250 μmol·L-1KH2PO4)和低磷(-P,5 μmol·L-1KH2PO4)两个处理,每个处理4次重复。处理20 d后收获样品,在75 ℃烘干到恒重后测定植株干重和全磷含量,并计算磷利用效率。同时收取从顶端开始完全展开的第3~6片功能叶和根系材料,用液氮速冻,用于测定可溶性磷浓度、细胞壁磷含量和ACP活性。
1.2 全磷含量、可溶性磷浓度的测定及磷吸收效率和磷利用效率的表示方法
全磷含量和可溶性磷浓度的测定参照Murphy等[21]的方法,取适量体积的样品磷提取液(不超过0.2 mL),用超纯水定容到4.5 mL,再加入0.5 mL钼锑抗显色液,混匀后静置30 min,测OD700的吸光度值。磷吸收效率用每株柱花草的全磷含量(mg P)表示,磷利用效率用单位磷素(mg P)所产生的干物质量(g DW)表示[22]。
1.3 细胞壁的分离和细胞壁磷含量的测定
细胞壁的分离参照Zhu等[23]的方法,柱花草叶片和根系鲜样用液氮研磨成粉末后,加入75%乙醇研磨成匀浆,冰浴20 min,8000 r·min-1离心10 min后保留沉淀。沉淀依次用丙酮、乙醇/三氯甲烷混合液(v/v=1/1)、甲醇洗涤。洗涤方法为加入相应液体后研磨成匀浆并冰浴20 min,随后8000 r·min-1离心10 min,最终获得的沉淀即为细胞壁提取物。称取5 mg分离后的细胞壁放入离心管中,加入1 mL盐酸(2 mmol·L-1)提取细胞壁中的磷。离心管置于摇床上振荡48 h。随后离心(14000 r·min-1,4 ℃,30 min)分离上清液,参照Ohno等[24]的方法以孔雀石绿为显色剂测定细胞壁中的磷。用单位鲜重细胞壁(mg CW)所含的磷(μg P)表示细胞壁磷含量。
1.4 细胞壁蛋白的提取与ACP活性的测定
细胞壁蛋白的提取参照Robinson等[25]的方法,液氮速冻的柱花草鲜样用TES/KOH缓冲液(25 mmol·L-1,pH 7.4,含10 mmol·L-1MgCl2,1 mmol·L-1EDTA,1 mmol·L-1二硫苏糖醇,1%(v/v)Triton X-100,1%(w/v)聚乙烯聚吡咯烷酮)充分研磨后离心(14000 r·min-1,4 ℃,30 min)收集沉淀。按上述步骤用TES/KOH缓冲液再洗涤沉淀3次。收集的沉淀用醋酸/NaOH缓冲液(0.5 mmol·L-1,pH 4.6,含0.2 mol·L-1CaCl2)研磨后离心(18000 r·min-1,4 ℃,30 min),收集上清液即为细胞壁蛋白提取液。参照Bradford[26]的方法测定蛋白浓度。ACP活性参照Liu等[17]的方法,取1.8 mL磷酸酶底物缓冲液[含1 mmol·L-1对硝基苯磷酸环己胺(ρ-NPP),用45 mmol·L-1的醋酸-醋酸钠buffer(pH=5.0)配制],加入适量体积的蛋白提取液,并用超纯水补足2 mL。混匀后于37 ℃反应15 min,用1 mL NaOH溶液(1 mol·L-1)终止反应,混匀后12000 r·min-1离心2 min,吸取上清液测OD405的吸光度值。磷酸酶活性用单位时间内(min)单位蛋白(mg)水解ρ-NPP的量(μmol)表示。
1.5 数据统计分析及作图
通过SPSS 18.0(IBM-SPSS,美国)对试验数据进行统计分析。采用Origin 8.0(OriginLab,美国)进行数据可视化作图。
2 结果与分析
2.1 低磷胁迫对柱花草生物量、磷吸收效率和磷利用效率的影响
由图1可知,柱花草的干重、磷吸收效率和磷利用效率受低磷胁迫的显著影响。低磷处理显著降低TPRC2001-84与RY2的植株干重和磷吸收效率(P<0.05),但显著增加了磷利用效率(P<0.05)(图1)。相对于正常供磷处理(+P),低磷处理(-P)使TPRC2001-84和RY2植株干重分别降低26.9%和51.9%(图1A),磷吸收效率分别降低91.5%和92.5%(图1B)。但是,TPRC2001-84和RY2在低磷处理下的磷利用效率分别比正常供磷处理增加7.7和5.4倍(图1C)。
在正常供磷条件下,两份柱花草材料的植株干重、磷吸收效率和磷利用效率均无显著差异(图1)。然而,在低磷处理下,TPRC2001-84的植株干重和磷利用效率显著高于RY2(P<0.05),分别是RY2的1.6和1.4倍(图1A和C)。以上结果说明,相对RY2,柱花草TPRC2001-84具有较强的耐低磷能力和较高的磷利用效率。
2.2 低磷胁迫对柱花草叶片和根系可溶性磷浓度及细胞壁磷含量的影响
图2的结果表明,低磷处理显著降低了柱花草TPRC2001-84与RY2叶片和根系的可溶性磷浓度(P<0.05)。在低磷处理下(-P),柱花草TPRC2001-84与RY2叶片可溶性磷浓度分别只有正常供磷条件下(+P)的22.2%和18.4%,而根系可溶性磷浓度分别只有正常供磷条件下的16.1%和12.6%(图2)。此外,虽然两份柱花草材料叶片和根系的可溶性磷浓度在正常供磷条件下无显著差异,但是,在低磷处理下,TPRC2001-84叶片和根系的可溶性磷浓度分别比RY2高36.8%和42.6%,差异显著(P<0.05)(图2)。
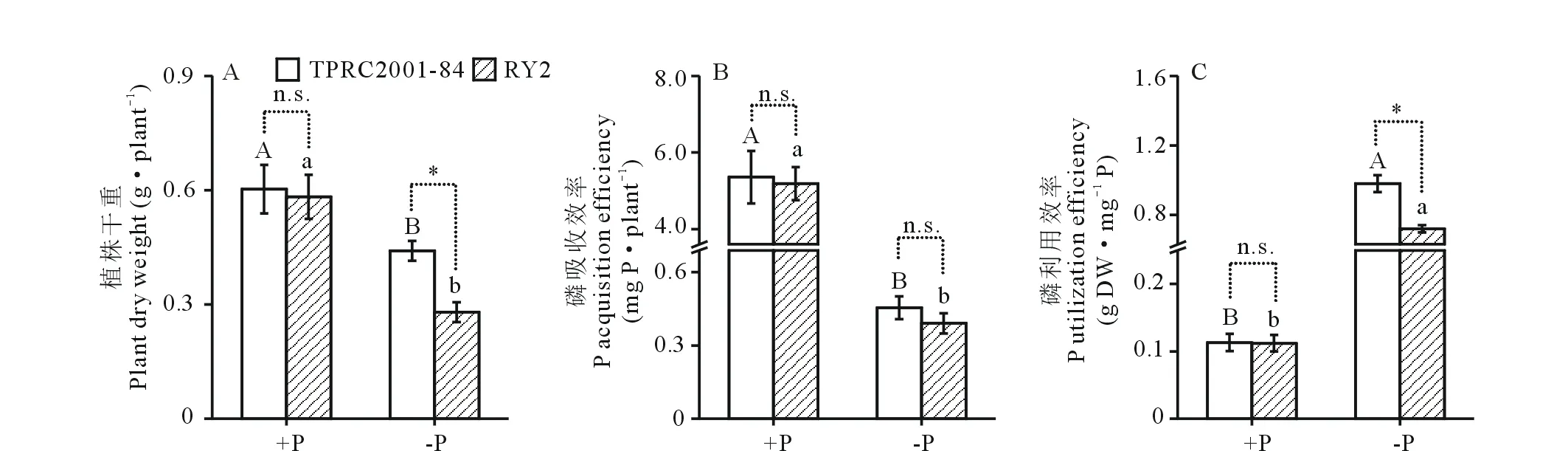
图1 不同供磷条件下柱花草的植株干重、磷吸收效率和磷利用效率Fig.1 Plant dry weight, P acquisition efficiency and P utilization efficiency in stylo at different P levels 不同的大写字母表示TPRC2001-84在+P与-P处理之间差异显著(P<0.05),不同的小写字母表示RY2在+P与-P处理之间差异显著(P<0.05)。*表示在相同磷处理下TPRC2001-84与RY2之间差异显著(P<0.05),n.s.表示TPRC2001-84与RY2之间差异不显著。下同。Different capital letters indicate significant difference of TPRC2001-84 between +P and -P treatment at P<0.05 level. Different lowercase letters indicate significant difference of RY2 between +P and -P treatment at P<0.05 level. * Indicate significant difference and n.s. indicate no significant difference between TPRC2001-84 and RY2 in the same phosphorus treatment at P<0.05 level. The same below.

图2 不同供磷条件下柱花草叶片和根系的可溶性磷浓度Fig.2 Soluble Pi concentration in the leaves and roots of stylo at different P levels
从图3可以看出,两份柱花草材料的叶片和根系细胞壁磷含量在低磷处理下显著降低(P<0.05),在低磷处理下,TPRC2001-84与RY2叶片细胞壁磷含量分别只有正常供磷条件下的6.9%和10.6%,而根系细胞壁磷含量分别只有正常供磷条件下的10.2%和14.8%(图3)。在正常供磷处理下,TPRC2001-84与RY2的叶片和根系细胞壁磷含量差异不明显,但在低磷处理下,TPRC2001-84叶片和根系的细胞壁磷含量分别只有RY2的71.6%和72.7%。以上结果表明,在低磷条件下,TPRC2001-84细胞壁中有更多的磷被活化释放出来。
2.3 低磷胁迫对柱花草总ACP及细胞壁ACP活性的影响
由图4可知,相对正常供磷处理(+P),低磷处理(-P)显著提高了TPRC2001-84与RY2叶片和根系总ACP活性(P<0.05)。在低磷处理下,TPRC2001-84和RY2叶片总ACP活性分别是正常供磷条件下的1.72和1.71倍,根系总ACP活性分别是正常供磷条件下的3.4和2.8倍,差异显著(P<0.05)。然而,在相同磷处理条件下,两份柱花草材料的叶片和根系总ACP活性差异不明显。
低磷处理显著提高了TPRC2001-84与RY2叶片和根系的细胞壁ACP活性(P<0.05)(图5)。在低磷处理下,TPRC2001-84和RY2叶片细胞壁ACP活性分别是正常供磷条件下的2.4和1.8倍,根系细胞壁ACP活性分别是正常供磷条件下的3.9和2.7倍(图5)。两份柱花草材料在正常供磷条件下的叶片和根系的细胞壁ACP活性差异不显著,然而,在低磷处理下,TPRC2001-84叶片和根系的细胞壁ACP活性分别比RY2高46.6%和53.6%,差异显著(P<0.05)(图5)。以上结果表明,相对RY2,TPRC2001-84在低磷胁迫下具有较高的细胞壁ACP活性。
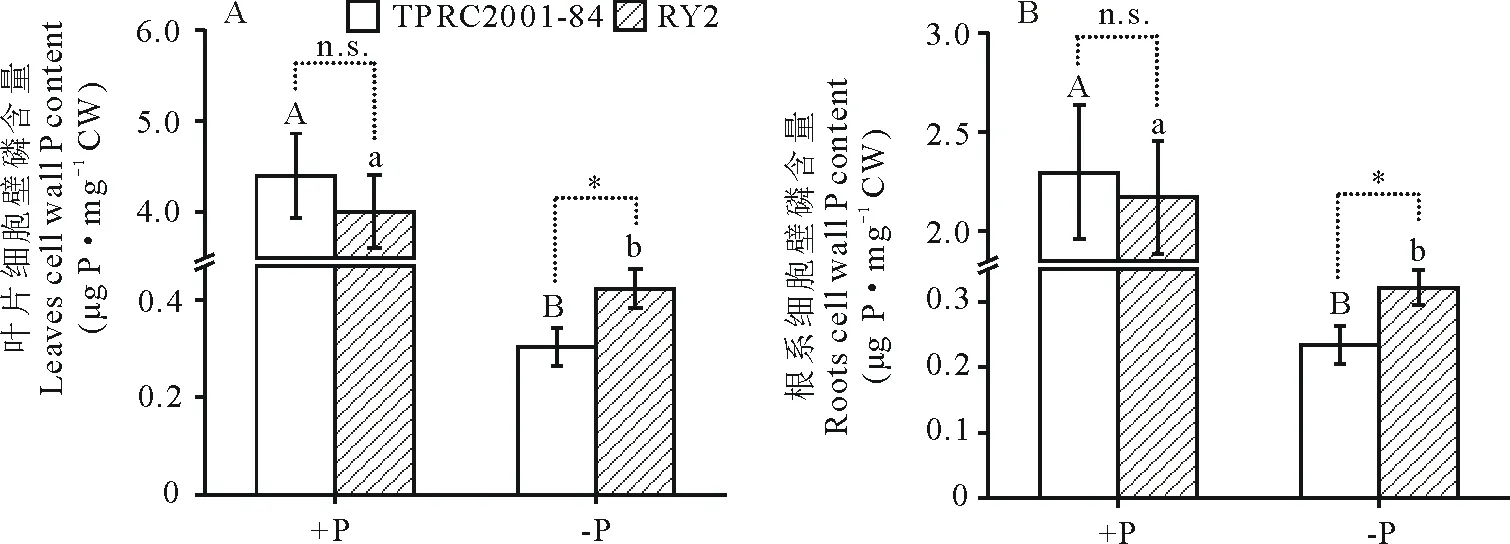
图3 不同供磷条件下的柱花草叶片和根系细胞壁磷含量Fig.3 Cell wall P content in the leaves and roots of stylo at different P levels

图4 柱花草叶片和根系在不同磷水平下的总酸性磷酸酶活性Fig.4 Total APase activity in the leaves and roots of stylo at different P levels

图5 柱花草叶片和根系在不同磷水平下的细胞壁酸性磷酸酶活性Fig.5 Cell wall APase activity in the leaves and roots of stylo at different P levels
3 讨论
低磷胁迫导致全球范围内农作物产量下降30%~40%[2]。由于磷肥的当季利用率低(通常只有10%~20%),施用磷肥只能部分解决作物对磷素的需求,并且,在农业生产中,投入的磷肥因其不能被及时吸收利用而流失,造成水体富营养化和环境污染[27]。因此,为保持农业的可持续发展,最为行之有效的方式就是优化养分管理,并结合育种技术改良作物的磷营养性状,综合提高作物的磷效率(包括磷吸收效率和磷利用效率)[28]。
通过太空诱变育种,我国已获得了水稻、小麦、棉花(Gossypiumhirsutum)、辣椒(Capsicumannuum)、番茄(Lycopersiconesculentum)和芝麻(Sesamumindicum)等多种作物和蔬菜的诱变新品种[29]。本课题组前期的研究中也利用太空诱变技术获得了一份耐低磷的柱花草突变体TPRC2001-84[14,18]。本研究的结果表明,TPRC2001-84在低磷处理下的植株干重显著高于亲本RY2(图1A),说明在低磷胁迫下TPRC2001-84具有较高的磷效率。TPRC2001-84与RY2的磷吸收效率无显著差异(图1B),但TPRC2001-84在低磷处理下的磷利用效率显著高于RY2(图1C),表明在低磷胁迫下TPRC2001-84较高的磷效率主要是由其较高的磷利用效率所决定。
为适应低磷胁迫环境,植物形成了一系列适应性机制来最大效率地提高磷的吸收和利用,以维持植物体内磷的平衡[8]。其中,低磷胁迫下增加ACP活性是粮食作物(水稻、大麦、小麦、玉米等),油料作物[大豆、油菜(Brassicanapus)等],蔬菜(菜豆、番茄等)和牧草[苜蓿(Medicagotruncatula)、白羽扇豆(Lupinusalbus)、白三叶(Trifoliumrepens)等]中均存在的应答反应[12]。本研究发现,低磷处理显著提高了柱花草TPRC2001-84和RY2的ACP活性(图4和5),表明诱导ACP活性增加是植物广泛存在的一种适应低磷胁迫机制。
细胞壁是植物贮存磷的场所之一。在低磷胁迫环境下,植物衰老组织中细胞壁储藏的磷可被活化和再利用,满足新陈代谢旺盛部位对磷素的需求,而定位于细胞壁的酸性磷酸酶在这个过程中可能发挥着重要作用[25]。在拟南芥中已鉴定多个细胞壁定位的ACP,包括紫色酸性磷酸酶AtPAP12、AtPAP26和核糖核酸酶AtRNS2。对这3个ACP的生物学功能分析表明,它们参与了DNA(脱氧核糖核酸)或ADP(腺苷二磷酸)的活化利用[25,30-31]。本研究发现,在低磷处理下,磷利用效率高的TPRC2001-84叶片和根系可溶性磷浓度显著高于RY2(图2),但TPRC2001-84叶片和根系中的细胞壁磷含量低于RY2(图3),说明当体内磷缺乏时,TPRC2001-84可能通过活化释放细胞壁中贮存的磷,从而提高细胞内的可溶性磷浓度。类似的,在低磷胁迫下,相对于磷低效水稻品种,磷高效水稻品种具有较高的细胞内可溶性磷浓度和较低的细胞壁磷含量[23]。此外,在低磷处理下,虽然TPRC2001-84与RY2叶片和根系总ACP活性无显著差异,但是,细胞壁磷含量低的TPRC2001-84具有较高的叶片和根系细胞壁ACP活性,而细胞壁磷含量高的RY2,细胞壁ACP活性显著低于TPRC2001-84(图4和5),进一步说明了柱花草细胞壁磷含量受到细胞壁ACP活性的影响。
4 结论
本研究从生理水平上初步解析了柱花草TPRC2001-84在低磷胁迫下具有较高的磷利用效率和较低的细胞壁磷含量的机理,其主要通过调控细胞壁ACP活性来实现。研究结果可为培育适应我国南方酸性缺磷土壤的柱花草新品种提供种质资源和理论依据。

