[bmim]OH和[A336][FeCl4]混合离子液体氧化吸收硫化氢
王建宏 于鑫萍 詹敏述 许 波 朱 玲 王亚飞
北京石油化工学院环境工程教学与实验中心
0 引言
络合铁水溶液催化—氧化硫化氢工艺具有脱硫效率高、安全无毒和流程简单等优点,其主流的LOCAT(Liquid Oxidation Catalyst)工艺不仅用于天然气净化,在页岩气脱硫方面也有成功应用[1]。但为了保证其正常运行需要定期添加铁络合剂、络合铁稳定剂、细菌抑制剂和表面活性剂等USFilter公司的专利试剂,导致运行成本相当高[2]。LO-CAT工艺这种高昂的运行费用来自于络合铁水溶液催化氧化硫化氢体系始终存在以下问题:①铁络合剂的降解[3];②脱硫副反应[4]。有机铁络合剂的降解主要发生在络合亚铁的再生过程中,当络合亚铁水溶液与空气中的氧气接触时,产生了H2O2,H2O2与亚铁络合物组成了类Fenton试剂,类Fenton试剂在水溶液中生成了氧化能力很强的氢氧自由基,氢氧自由基则作为主要的氧化剂将有机络合剂氧化降解[5-6]。大量的文献表明,类Fenton试剂仅在乙腈[7]、甲醇和乙醇[8]这几种有机溶剂中能产生氢氧自由基从而具有较高的氧化活性,在其他有机溶剂中的高活性未见报道。依据类Fenton试剂在大部分有机溶剂中的活性较低、不容易产生氢氧自由基的特点,非水相的强酸性1-丁基-3-甲基咪唑四氯铁酸盐([bmim]FeCl4)离子液体催化氧化硫化氢体系被提出[9]。该体系克服了铁络合剂的降解和脱硫副反应问题,同时具有较高的硫化氢脱除效率。但是研究发现价格较高的咪唑类离子液体提高了非水相催化氧化的工业化成本,同时,[bmim]FeCl4离子液体的强酸性又导致硫容和铁利用率较低[10],进一步增加了运行成本。
考虑到三辛基甲基氯化铵([A336]Cl)季铵盐离子液体的价格远低于1-丁基-3-甲基咪唑氯盐离子液体的价格,笔者拟采用[A336]Cl合成[A336][FeCl4],并利用该铁基离子液体吸收硫化氢,[A336][FeCl4]既降低了吸收剂的成本,又保留了铁的络合态。为了提高[A336][FeCl4]离子液体的硫容和铁利用率,依据降低离子液体的酸性强度,硫容和铁利用率升高[11]的特点,将 [bmim]OH碱性离子液体与[A336][FeCl4]混合达到降低铁基离子液体酸性强度的目的。鉴于混合离子液体的物理化学性质对其硫化氢催化氧化性能有较大的影响,系统研究了[bmim]OH和[A336][FeCl4]混合离子液体的水溶性、密度、红外光谱、黏度和酸性强度等性能,在此基础上,对其硫容和反应产物进行了分析。
1 实验部分
1.1 试剂
三辛基甲基氯化铵(纯度≥99%,上海秉奇化工科技有限公司),氯化1-丁基-3-甲基咪唑(纯度≥99%,上海成捷化学有限公司),FeCl3·6H2O(分析纯,天津市福晨化学试剂厂),氢氧化钾(分析纯,北京化工厂),无水乙醇(分析纯,北京化工厂)。
1.2 分析测试仪器
美国Thermo Fisher Haake 公司的HAAKE Roto-Visco1旋转黏度计。德国BRUKER公司的傅立叶变换红外光谱仪(FT-IR),TENSOR 27型,分辨率为 4 cm-1,中红外扫描区间为400~4 000 cm-1。上海雷磁的PHS-3C精密pH计。
1.3 离子液体的合成
1.3.1 [bmim]OH离子液体的合成
在200 mL的烧杯中,加入80 mL乙醇和16 g KOH,搅拌成悬浮液后,再加入50 g 1-丁基-3-甲基咪唑氯盐([bmim]Cl),室温下剧烈搅拌2 h,待反应不再进行时停止。反应后,抽滤去除白色KCl,得到淡黄色液体,再使用滤液旋转蒸发去除乙醇溶剂,得到黄色黏稠状液体,即[bmim]OH[12]。
1.3.2 [A336][FeCl4]的合成
在200 mL的烧杯中,加入200 g三辛基甲基氯化铵([A336]Cl)和133.8 g FeCl3·6H2O(物质的量之比为1∶1),剧烈搅拌24 h,得到黄色液体,倒入分液漏斗静置90 min,溶液分层,取上层溶液,得到黄褐色粘稠状液体,即[A336]FeCl4[13]。
1.3.3 混合铁基离子液体的制备
将已制备的 [A336]FeCl4分成5份,分别置于20 mL烧杯中,按照物质的量之比([bmim]OH∶[A336]FeCl4= 0.2∶1,0.5∶1,0.8∶1,1∶1,2∶ 1)加入[bmim]OH,常温下磁力搅拌2 h,分别得到不同比例的混合铁基离子液体即0.2[bmim]OH-[A336]FeCl4,0.5[bmim]OH-[A336]FeCl4, 0.8[bmim]OH-[A336]FeCl4,1[bmim]OH-[A336]FeCl4和 2[bmim]OH-[A336]FeCl4。
1.4 酸性的测试
吡啶作为一个碱性探针来测量离子液体的酸性种类,粗略指示酸性强度。测量酸性的样品通过将吡啶与离子液体以1∶5的体积比混合后,采用液膜法测量其红外光谱。
1.5 铁基离子液体吸收硫化氢的装置
硫化氢的吸收装置如本文参考文献[11]所示,室温下,99.9%纯度的H2S气体压力调至0.05 MPa,流量调至15 mL/min后通过装有3.5~4.0 g铁基离子液体的鼓泡吸收管鼓泡吸收,每隔一段时间,用一个精度为0.000 1 g、最大量程为110 g 的电子天平称量鼓泡吸收管的质量,当鼓泡吸收管的质量不再增加时,鼓泡吸收管增加的质量与铁基离子液体的质量之比就是每克离子液体吸收的硫化氢质量,即铁基离子液体的硫容。
2 结果与讨论
2.1 离子液体的水溶性和密度
硫化氢被铁系催化剂催化氧化后的产物是硫磺和水[14],一般硫磺是通过沉降到反应器的底部再进行分离,因而离子液体的密度对于硫磺的沉淀分离有重要影响,离子液体的水溶性对催化氧化后水分的分离方式也会产生影响。
离子液体的水溶性和密度如表1所示。由表1可知,[A336]FeCl4的密度最小,低于水的密度,也远小于[bmim]FeCl4的密度[15],这有可能为[A336]FeCl4的阳离子较大所引起。[bmim]OH离子液体的密度最大,但小于硫磺的密度2.6 g/cm3,在混合离子液体中,随着 [bmim]OH物质的量之比由0.2∶1增加至2∶1,混合离子液体的密度逐渐由0.949 g/cm3增加至1.215 g/cm3,也远小于硫磺的密度,有利于硫磺的沉降。为了达到硫磺和离子液体的快速分离,LO-CAT工艺规定溶液的密度小于1.2 g/cm3[16],因而,从密度的角度考虑,[bmim]OH/[A336]FeCl4物质的量之比低于2∶1比较有利于硫磺的分离。
表1还显示除了[A336]FeCl4微溶于水之外,[bmim]OH和混合离子液体均可以与水完全混溶。这说明该非水相体系不能采用简单的分液方法进行离子液体和水的分离,不过,在LO-CAT工艺中,根据测算,每生成1 kg硫可以蒸发1.4 kg的水,而每生成1 kg硫只能生成0.2 kg的水[16],所以,生成的水可全部被工艺气体或者再生空气带走,无需另外分离。
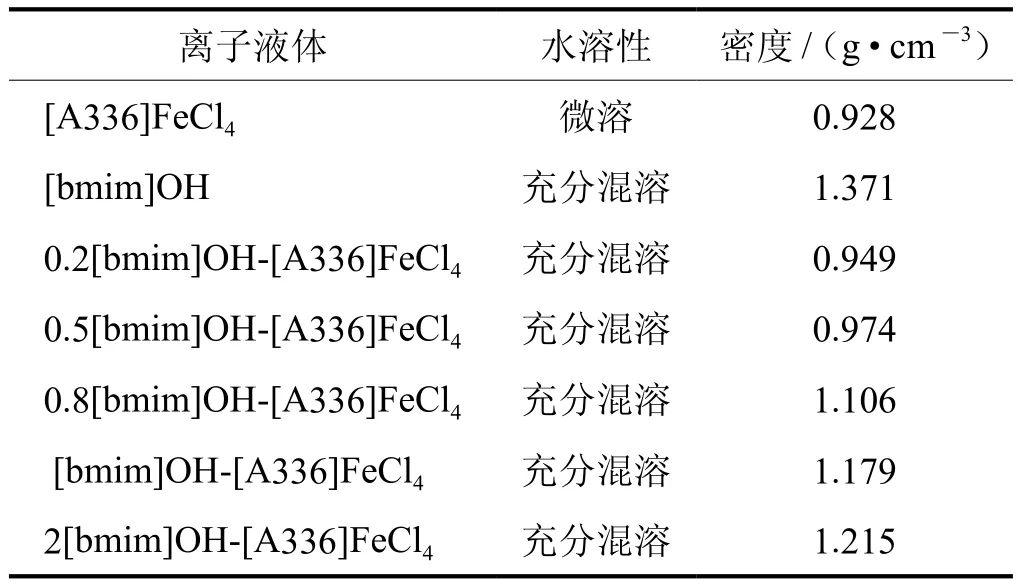
表1 离子液体的水溶性和密度表
2.2 离子液体的红外光谱
图1显示了[A336]Cl和[A336]FeCl4的红外光谱。由图1可知,[A336]Cl合成为[A336]FeCl4后,两者的特征震动频率基本不变,这表明[A336]FeCl4仍保持[A336]Cl的骨架。此外,当[A336]Cl合成为[A336]FeCl4后,N-H收缩振动峰由3 562 cm-1蓝移至3 678 cm-1且明显增强,蓝移表明红外振动所需的能量增大,因而,[A336]FeCl4更加稳定。另一方面,与[A336]Cl相比, [A336]FeCl4在1 730 cm-1处的季铵根离子特征吸收锋[17]明显减弱,其原因可能为FeCl3的加入导致烷基上氢的脱落形成H+[18],季铵盐的氮提供孤对电子给氢离子,增加了N-H结合键,减少了季铵盐离子的数量。

图1 [A336]Cl和[A336]FeCl4 的红外光谱图
图2显示了[bmim]OH、[A336]FeCl4以及它们按照不同比例混合后的离子液体红外光谱。由图2可知,[bmim]OH和[A336]FeCl4按一定比例混合后,两者的特征震动频率基本都存在于混合离子液体中,这表明混合离子液体同时具有[bmim]OH和[A336]FeCl4的骨架结构,当[bmim]OH/[A336]FeCl4的物质的量之比从0.2∶1增加至2∶1时,[bmim]OH和[A336]FeCl4的混合离子液体能够稳定存在。对于[bmim]OH,3 200~3 650 cm-1之间宽而强的吸收带证明产物中有羟基存在。在混合离子液体中,随着[bmim]OH与[A336]FeCl4的物质的量之比由0.2增加至2,羟基的峰值高度逐渐增加,表明其碱性强度也逐渐增加。将混合离子液体和[A336]FeCl4比较,可发现[A336]FeCl4在3 678 cm-1的N-H收缩振动吸收峰在混合离子液体中消失。但是,[A336]FeCl4在1 730 cm-1处的季铵盐离子收缩振动峰在物质的量之比为0.2∶1、0.5∶1和0.8∶1混合离子液体中的振动强度增加了,这有可能为氢氧根中和了部分氢离子,导致N-H键减少的同时,增加了季铵盐离子的数量。
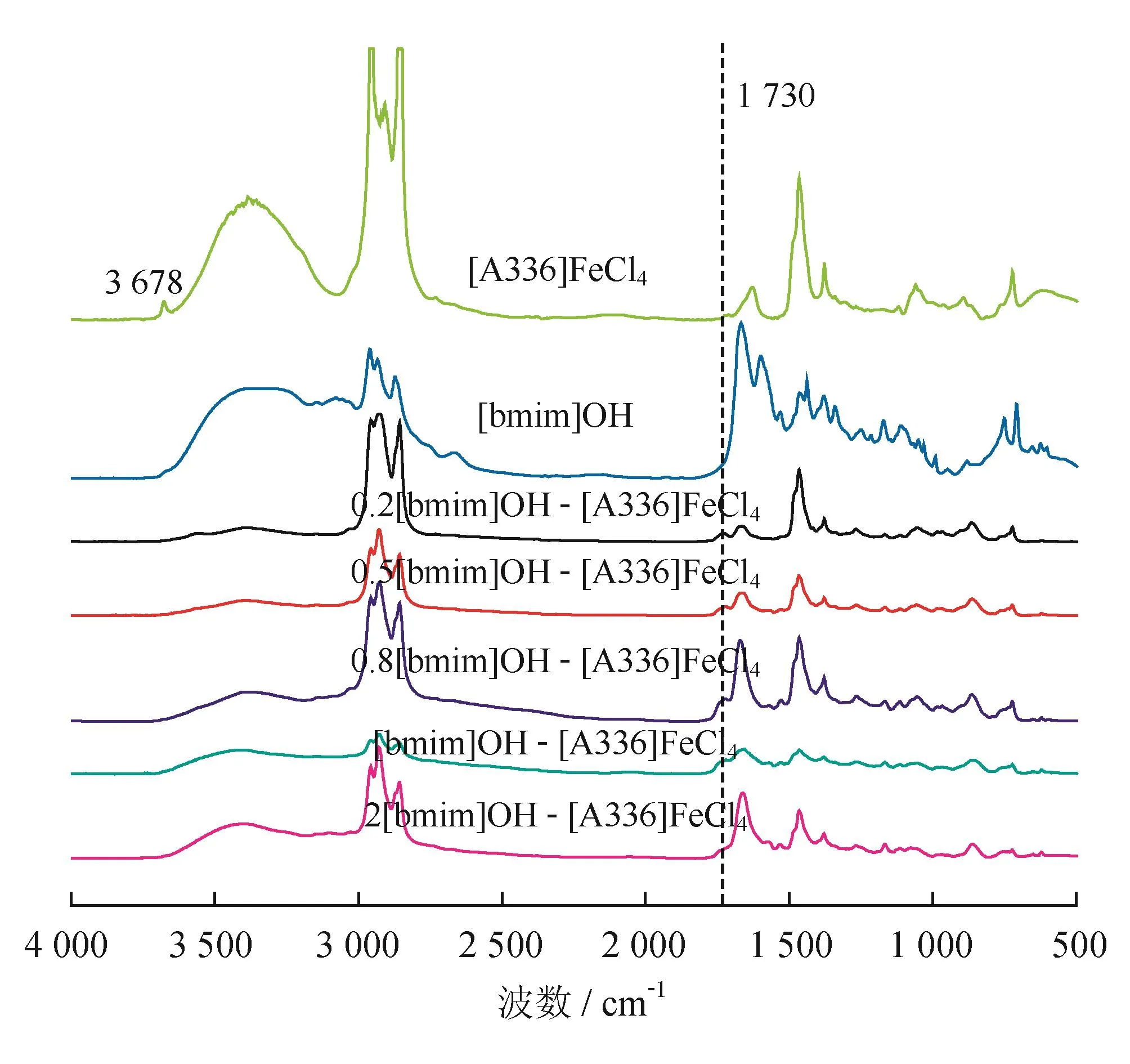
图2 离子液体的红外光谱图
2.3 离子液体的酸性分析
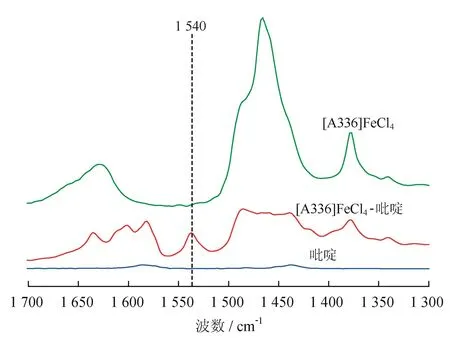
图3 以吡啶为探针的[A336]FeCl4红外吸收光谱图
为了探究[A336]FeCl4的酸性及其酸性类型,以吡啶为探针测试的红外光谱如图3所示。从图3中可以明显看出[A336]FeCl4与吡啶混合后在1 540 cm-1处有新的吸收峰出现,这说明[A336]FeCl4呈现Brφnsted酸性[19],这与前面的红外光谱分析[A336]FeCl4离子液体中烷基上氢的脱落形成H+是一致的,但不同于[bmim]FeCl4同时具有Brφnsted酸性和Lewis酸性的特征[20],[A336]FeCl4的酸性强度可能远低于[bmim]FeCl4。
不过,[A336]FeCl4呈现Brφnsted酸性,硫化氢溶于水也为酸性,所以会导致硫化氢在[A336]FeCl4离子液体中的溶解度较小,脱除硫化氢效果较低。
为了降低其酸性,向[A336]FeCl4离子液体中加入不同比例的碱性离子液体[bmim]OH,再以吡啶为探针测定其酸性种类和强度,结果如图4所示。由图4可知,[bmim]OH /[A336][FeCl4]混合离子液体与吡啶混合后均存在1 540 cm-1的新峰,表明混合离子液体都具有Brφnsted酸性,不过混合离子液体1 540 cm-1处的峰强度明显减弱,说明加入[bmim]OH能够有效减弱[A336][FeCl4]的酸性。鉴于红外光谱法只能粗略指示离子液体的酸性,使用pH值法对铁基离子液体酸性测试结果如表2所示。从表2可以看出,随着混合离子液体中[bmim]OH的物质的量之比逐渐增加,混合离子液体的pH值逐渐提高,当[bmim]OH/[A336]FeCl4物质的量之比为0.5∶1.0时,其pH值为2.38,已经超越了多个酸性铁基催化氧化体系的pH值[21-22],再继续增加[bmim]OH时其pH值增加的幅度逐渐变慢,当物质的量之比达到2∶1时,其pH值才达到4.09,仍是酸性环境。因为[bmim]OH咪唑类离子液体的价格高于[A336]FeCl4季铵盐类离子液体的价格,从控制吸收剂的成本考虑,[bmim]OH/[A336]FeCl4物质的量之比为0.5∶1~1∶1的酸性环境可能有利于硫化氢进行经济的吸收。
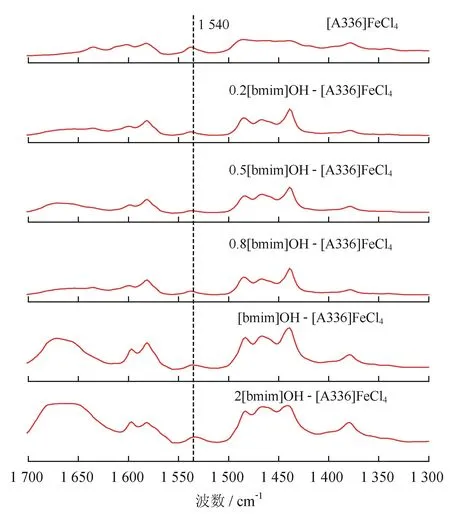
图4 以吡啶为探针的离子液体红外吸收光谱图

表2 离子液体的pH值表
2.4 温度对离子液体黏度的影响
图5显示了[bmim]OH、[A336]FeCl4以及混合离子液体的黏度随温度的变化。从图5可以看出,[A336]FeCl4的黏度最小,[bmim]OH的黏度比[A336]FeCl4的黏度大。随着[bmim]OH所占的比例越大,两种离子液体混合后的黏度越大。0.2[bmim]OH-[A336]FeCl4、0.5[bmim]OH-[A336]FeCl4的 黏 度 在 [A336]FeCl4和[bmim]OH之间。0.8[bmim]OH-[A336]FeCl4、[bmim]OH-[A336]FeCl4、2[bmim]OH-[A336]FeCl4这3种离子液体的黏度都要比[bmim]OH和[A336]FeCl4的黏度大,尤其是[bmim]OH-[A336]FeCl4和2[bmim]OH-[A336]FeCl4,其黏度剧烈增加,有可能为[A336]FeCl4作为酸离子液体,存在H+,而[bmim]OH存在OH-,H+和OH-发生了中和反应,导致[A336]FeCl4和[bmim]+结合形成了大分子,流动性变差,从而黏度迅速增加。
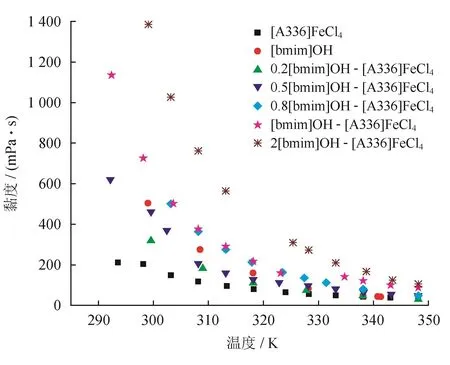
图5 离子液体黏度随温度的变化图
当温度升高时,所有离子液体的黏度随之降低。[A336] FeCl4在298 K时,黏度达到了最大值203 mPa·s,在348 K时,黏度减小为33.78 mPa·s,大约降低83.35%。0.2[bmim]OH-[A336]FeCl4在299 K下的黏度为319 mPa·s,341 K降低为29.87 mPa·s,大约降低90.63%,0.5[bmim]OH-[A336]FeCl4在299 K下的黏度为461 mPa·s,仅仅稍高于1.6Et3NHCl·FeCl3离子液体的黏度457 mPa·s[23],348 K降低至47.5 mPa·s,大约降低89.69%。由此可见,混合离子液体的黏度相对于[A336] FeCl4随温度升高降低的幅度更大。值得一提的是,348 K时,0.8[bmim]OH-[A336]FeCl4的黏度也仅为47.71 mPa·s,与同温度下的0.5[bmim]OH-[A336]FeCl4离子液体相近。
为了算出离子液体能达到的最低黏度,用Andrade方程对离子液体黏度进行拟合。
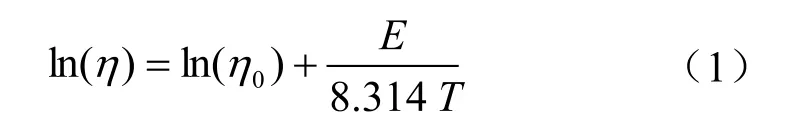
式中η表示某一温度(T)下的黏度,mPa·s;η0表示无限温度下的黏度,mPa·s;E表示活化能,J/mol。
拟合结果如表3所示。由表3可知,混合离子液体的无限黏度均低于[A336]FeCl4,且活化能均高于[A336]FeCl4,这说明混合后的离子液体比[A336]FeCl4更加稳定,且随着温度的升高,其黏度有可能低于[A336]FeCl4。[A336][FeCl4]/ [bmim]OH混合离子液体是一种有潜力的中/高温催化氧化硫化氢的离子液体,不过鉴于[bmim]OH /[A336][FeCl4]物质的量之比超过1∶1时,其急剧增加的黏性,物质的量之比低于1∶1的离子液体更有工业应用价值。

表3 离子液体的黏度与温度的Andrade方程拟合结果表
2.5 离子液体氧化吸收硫化氢的性能
图6显示了[bmim]OH/[A336][FeCl4]的物质的量之比对理论硫容和实测硫容的影响。由图6可知,理论上,[A336][FeCl4]的硫容最高,随[bmim]OH/[A336][FeCl4]物质的量之比的增加,混合离子液体的硫容逐渐降低,其原因为随着物质的量之比的增加,混合离子液体中的铁浓度降低,而被离子液体吸收的硫化氢,很快会被[FeCl4]-氧化,理论上,铁浓度降低将导致氧化吸收的硫化氢减少。但是,图6显示,实测的[A336][FeCl4]的硫容最低,随着[bmim]OH/[A336][FeCl4]物质的量之比的增加,混合离子液体的硫容则逐渐增加,这是因为强酸性的环境不利于硫化氢溶解于离子液体中,而仅仅只有被溶解的硫化氢才能被氧化[4,14,21,22],如表2 所示,[A336][FeCl4]的酸性最强,因而,硫化氢在[A336][FeCl4]的溶解度最小,导致硫容最小,铁利用率最低;随着[bmim]OH/[A336][FeCl4]物质的量之比增加,混合离子液体的酸性强度逐渐减弱,有利于硫化氢的溶解和氧化,从而导致硫容的增加和铁离子利用率的提高。从图6也可以看出,随着[bmim]OH /[A336][FeCl4]物质的量之比的增加,其理论硫容和测量硫容之间的差距也逐渐缩小,说明其铁利用率在逐渐增加。当[bmim]OH /[A336][FeCl4]物质的量之比为1∶1时,测量硫容非常接近理论硫容。当物质的量之比为2∶1时,其测量硫容已经超过了理论硫容。这不仅意味着只有物理吸收的硫化氢也存在于离子液体中,而且表明所有的铁已经全部被硫化氢还原,此时,铁的利用率是100%。不过,2[bmim]OH-[A336]FeCl4的黏度是最大的,大的黏度将会造成氧化和再生速率的降低,此外,[bmim]OH /[A336][FeCl4]物质的量之比从1∶1增加至2∶1时,实测硫容仅仅从2.08%增加至2.13%,但是吸收剂的成本几乎增加一倍。从吸收的角度考虑,[bmim]OH /[A336][FeCl4]物质的量之比为0.8∶1和1∶1的离子液体,其实际硫容和测量硫容之间的差距较小,铁的利用率较高,适合进行硫化氢的催化氧化。
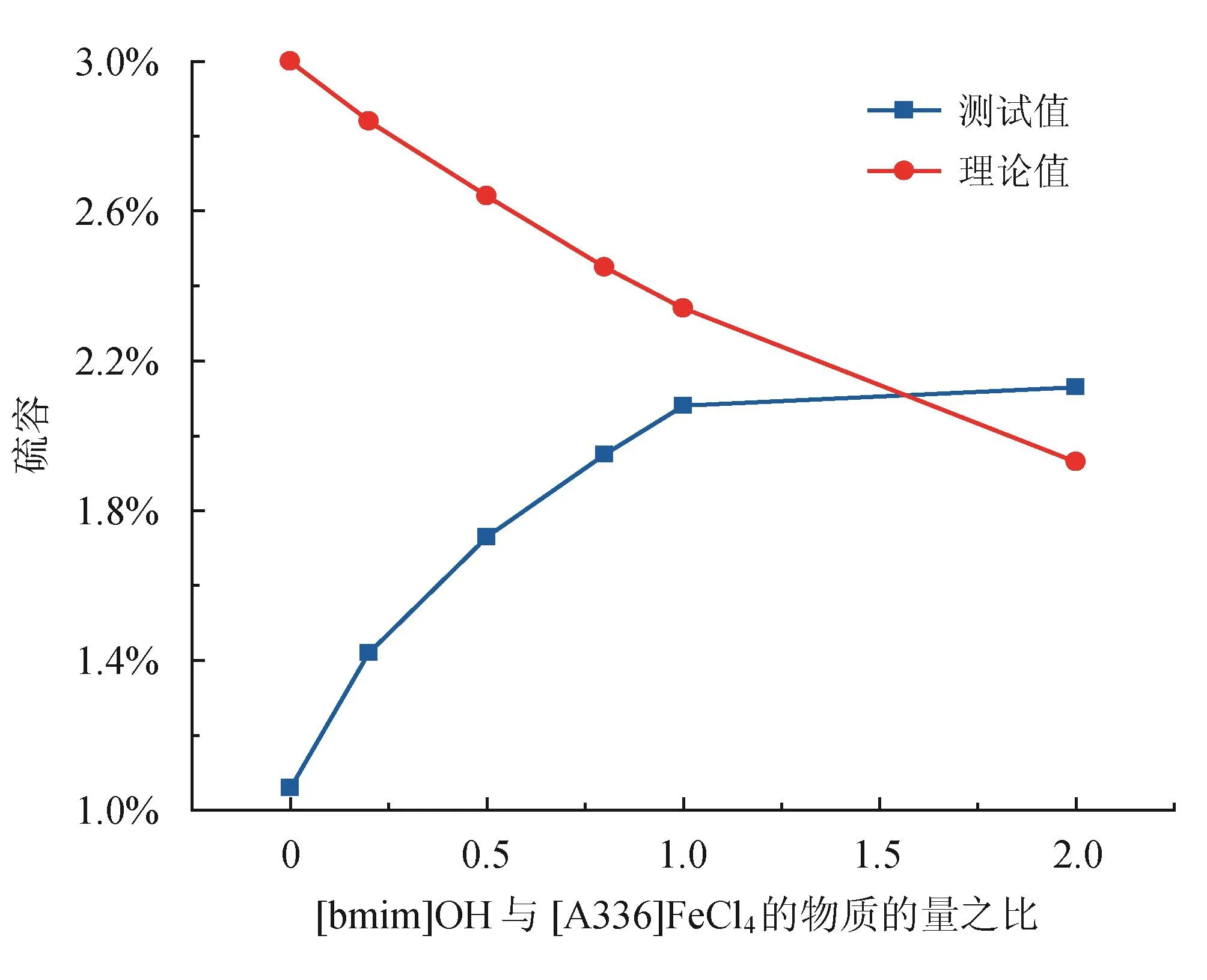
图6 物质的量之比对离子液体硫容的影响图
2.6 离子液体吸收硫化氢后的红外光谱分析
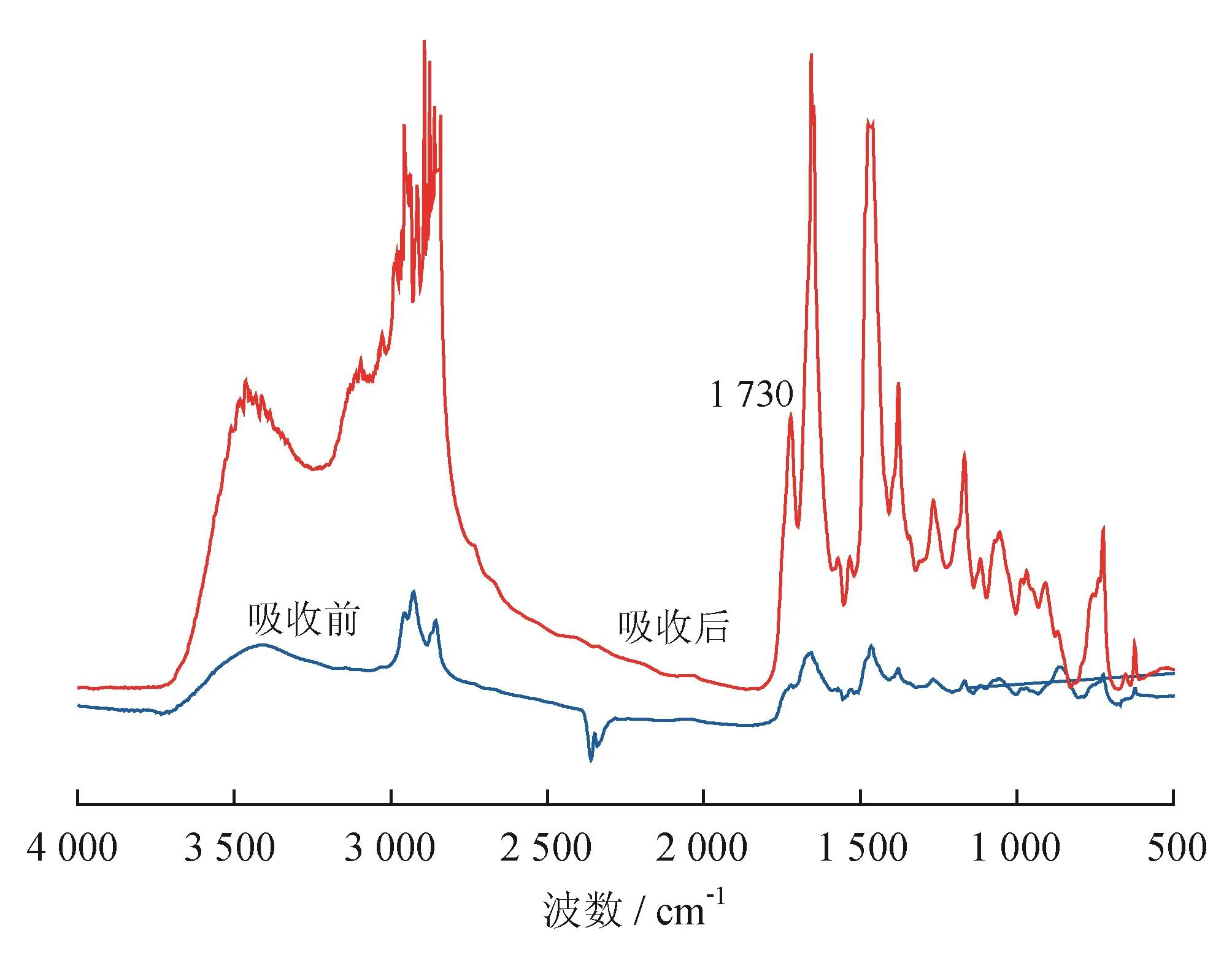
图7 0.8[bmim]OH-[A336]FeCl4鼓泡吸收H2S前后的红外光谱图

图8 [A336]FeCl4鼓泡吸收H2S前后的红外光谱图
离子液体吸收硫化氢后的代表性红外光谱如图7、8所示,图7显示了0.8[bmim]OH-[A336]FeCl4鼓泡吸收H2S前后的红外光谱,图8显示了[A336]FeCl4鼓泡吸收H2S前后的红外光谱。由图7、8可知,吸收硫化氢后的离子液体中不存在2 562 cm-1处的S-H键的特征峰,说明离子液体吸收硫化氢后氧化完全,离子液体中不存在H2S、HS-等,硫化氢基本都被氧化为单质硫[20]。由图7、8还可看出,吸收硫化氢前后的红外特征锋基本相同,表明吸收硫化氢后没有改变离子液体的骨架结构。不过,0.8[bmim]OH-[A336]FeCl4和 [A336]FeCl4在吸收硫化氢后,其在1 730 cm-1处的峰高均明显增加,其原因可能为氧化吸收前的FeCl4-还原成为了吸收后的FeCl42-[11],氧化形态的变化,导致季铵盐离子数量的增多,当FeCl42-空气再生为FeCl4-时,1 730 cm-1处的特征峰又可能与吸收前一致[23]。
3 结束语
[A336]FeCl4季铵盐离子液体的酸性强度和价格均低于[bmim]FeCl4离子液体,可以降低离子液体非水相催化氧化硫化氢体系的成本。碱性的[bmim]OH与酸性的[A336]FeCl4混合后,没有改变它们彼此的骨架结构,但减弱了离子液体的酸性强度,提高了离子液体的黏度随温度下降的幅度,增加了离子液体的硫容和铁利用率。综合考虑混合离子液体的密度、黏度、酸性、硫容和吸收剂的成本,当[bmim]OH/[A336][FeCl4]混合离子液体的物质的量之比在0.5∶1~1∶1时,混合离子液体的密度小于1.2 g/cm3,pH值高于2.38,341 K以上时黏度较低,硫容较大,铁利用率较高,适合构建341 K以上的铁系中高温催化氧化硫化氢体系。

