骨形态发生蛋白9基因修饰人羊膜间充质干细胞体外向韧带成纤维细胞分化研究
朱喜忠 刘子铭 吴术红 熊华章 金瑛 李豫皖 杨继滨 尤奇 刘毅
1遵义医学院附属医院(贵州遵义 563000)
2重庆医科大学附属医院骨科(重庆 400000)
韧带因自身愈合能力有限,其损伤或病变的治疗仍是运动医学面临的一大难题[1-3]。据报道,美国每年有超过200万例患者因肌腱或韧带损伤而就诊[4]。因此,深入了解韧带细胞的分化机制对临床损伤的修复或重建至关重要。骨髓间充质干细胞(bone marrowderived mesenchymal stem cells,BMSCs)虽已广泛应用于实验研究[5,6],但存在取材创伤大、含量低等缺点[7,8]。而人羊膜间充质干细胞(human amniotic mesenchymal stem cells,hAMSCs)具有取材方便、增殖速度快、不存在伦理限制等优点,成为近些年的研究热点[9-11]。
BMP9(生长分化因子2,GDF-2)是已知骨形态发生蛋白(bone morphorgenetic proteins,BMPs)家族中诱导间充质干细胞在体内和体外成骨分化能力最强的成员[12,13],但其是否具有诱导干细胞向肌腱分化的能力还鲜有报道。最近有研究表明[14],BMP9同样可以激活ALK1和ALK5受体从而增强细胞外基质蛋白的表达。因此,本实验使用腺病毒载体系统将人BMP9基因导入人羊膜间充质干细胞中,探讨BMP9能否诱导人羊膜间充质干细胞向韧带细胞定向分化,并研究其分子机制。
1 材料和方法
1.1 主要材料、试剂、仪器
实验所搜集5个胎盘来自于遵义医学院附属医院产科足月产产妇,无其他基础疾病,术前均签署知情同意书,符合遵义医学院附属医院伦理委员会要求。实验所搜集3例前交叉韧带残端来自于遵义医学院附属医院骨科全膝关节置换术患者,术前签署知情同意书,符合遵义医学院附属医院伦理委员会要求。
L-谷氨酰胺、L-DMEM/F12培养液(GIBCO公司,美国);胰蛋白酶、Ⅰ型胶原酶、Ⅱ型胶原酶(HYCLONE公司,美国);转录试剂盒、SYBR Green real-time PCR Master Mix(TAKARA公司,日本);AdBMP9表达质粒、AdGFP空载对照质粒(上海汉恒生物科技有限公司);青霉素、链霉素(华北制药有限公司);Trizol试剂(Invetrogen公司,美国);Ⅰ型胶原抗体(Abcam公司,英国);4%多聚甲醛固定液(北京中杉金桥生物技术有限公司);4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)、山羊抗兔 cy3荧光二抗、Triton X-100、山羊血清(北京索莱宝科技有限公司)。
超净工作台(北京冠鹏净化设备公司);冷冻离心机(EPPENDORF公司,德国);倒置相差显微镜、荧光显微镜(OLYMPUS公司,日本);CO2恒温箱(THERMOSCIENTIFIC公司,美国)。CFX96型实时定量PCR仪(Bio-Rad公司,美国)。
1.2 人羊膜间充质干细胞的分离与培养
根据本课题组建立的方法分离培养hAMSCs。主要如下:将羊膜从胎盘上剥离,PBS液冲洗干净后剪成碎片,0.02%EDTA-0.05%胰蛋白酶消化2次,PBS液洗涤后,0.75 mg/mLⅡ型胶原酶消化3 h,收集细胞滤液,以1500 rpm、4℃离心6 min。弃上清,用含10%FBS的L-DMEM/F12培养基重悬细胞、计数并接种,置于37℃、5%CO2及饱和湿度培养箱培养。
1.3 人交叉韧带成纤维细胞的分离与培养
根据本课题组建立的酶消化法分离培养韧带成纤维细胞(Ligament fibroblast cells,LFs),主要如下:将ACL残端在PBS液中反复洗涤,剔除多余结缔组织,0.2%的Ⅰ型胶原酶在37℃水浴箱中震荡消化5 h,收集细胞滤液,以1500 rpm、4℃离心6 min。弃上清,用含10%FBS的L-DMEM/F12培养基重悬细胞、计数并接种,置于37℃、5%CO2及饱和湿度培养箱培养。
1.4 AdBMP9体外转染hAMSCs
基于AdMAX系统[pHBAd穿梭质粒、腺病毒骨架载体pBHGlox(deltaΔE1,3Cre)双载体组成],将构建的带有目的基因的腺病毒穿梭质粒与骨架质粒经大量抽提(浓度>1 mg/ml、A260/280 在 1.7~1.8之间)后,于293A细胞中进行包装(体系:目的基因质粒:pBHGlox(deltaΔE1,3Cre)=1∶2)后行筛取、扩增与纯化,纯化采用PEG8000沉淀-CsCl密度梯度离心-透析联用法。随后使用293细胞对病毒进行梯度法稀释后培养8 h后观察绿色荧光表达量,进行病毒滴度(PFU/ml)的测定。
取P3代汇合率50%~75%之间的hAMSCs,弃去培养基后使用PBS洗涤3遍,更换新鲜无血清培养基后,分别添加不同梯度(MOI=3、10、30、100、300;感染复数(multiplicity of infection,MOI)AdBMP9和等滴度同体积的AdGFP,轻摇培养板使其分布均匀,置于37℃、5%CO2及饱和湿度培养箱培养8 h后更换为含10%FBS的L-DMEM/F12培养液培养,24 h后观察荧光表达量并计算合适的MOI值。
取P3代汇合率50%~75%之间的hAMSCs,弃去培养基后使用PBS洗涤3遍,更换新鲜无血清培养基后添加MOI=10的AdBMP9和AdGFP,置于37℃、5%CO2及饱和湿度培养箱培养8 h后更换为含10%FBS的LDMEM/F12培养液培养,此后每48 h换液[15]。
1.5 观测指标
1.5.1 hAMSCs和LFs的比较
倒置相差显微镜观察:原代培养24 h后和P3代培养24 h后,于倒置相差显微镜下观察细胞形态和生长情况。
1.5.2 转染效率检测
①倒置相差显微镜观察:转染后8 h、24 h于倒置相差显微镜下观察细胞形态和生长情况。②荧光显微镜观察:转染后8 h、24 h于荧光显微镜下观察转染效果。
1.5.3 实验分组
A组:携带绿色荧光蛋白(Green Fluorescent Protein,GFP)的空腺病毒载体转染hAMSCs(hAMSCs-GFP);B组:携带BMP9基因的腺病毒载体转染hAMSCs(hAMSCs-BMP9);C组:韧带成纤维细胞组(LFs)。所有实验分组材料均按照上述所制备。各组细胞体外培养7天后进行进一步的实验检测。
1.5.4 韧带相关分子表达水平检测
①实时荧光定量PCR检测:取A、B、C三组细胞分别于培养7 d时检测SCX、Tnmd、ColⅠ、Fib和TNC的mRNA表达水平。标准Trizol法提取各组细胞的RNA,紫外分光光度计检测RNA提取质量。以反转录得到的cDNA为模板进行实时荧光定量PCR检测。以GAPDH为内参,通过2-ΔΔCt法计算目标基因相对表达量。引物在NCBI基因库中对比后,由上海生工生物工程股份有限公司合成(表1)。②荧光免疫组化分析:A、B、C三组细胞分别以密度为1.5×105/ml的细胞悬液,加入到含直径25 mm细胞爬片的6孔板内,培养7 d后,取出细胞爬片,按改良Coons细胞免疫荧光染色步骤操作,一抗孵育过夜后,加山羊抗兔Cy3检测Ⅰ型胶原,荧光显微镜观察。

表1 基因引物序列及产物长度

续表1
1.6 统计学方法
采用SPSS18.0统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用LSD检验;检验水准α=0.05。
2 结果
2.1 hAMSCs和LFs的形态学观察
倒置相差显微镜观察:hAMSCs原代时多呈椭圆或多角形贴壁生长,部分区域可见细胞聚集,细胞核圆形,排列不规则;传代培养后以长梭形为主,漩涡状生长。LFs原代时多以长梭形贴壁生长,细胞核圆形,原代数量较少;传代后呈明显长梭状生长,可见漩涡状集落(图1)。
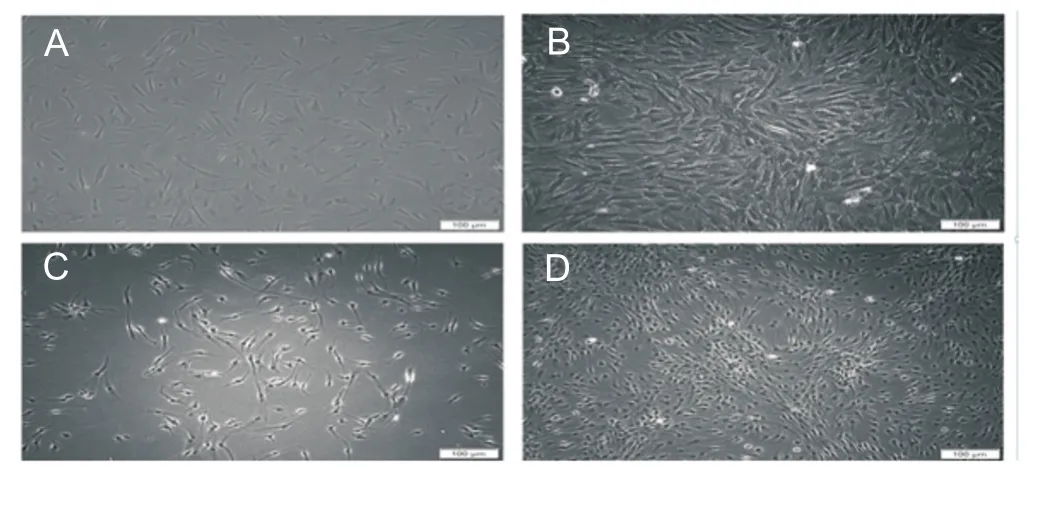
图1 人羊膜间充质干细胞和人韧带纤维细胞的形态(×100)
2.2 转染效率检测
2.2.1 倒置相差显微镜观察
转染后8 h、24 h镜下可见细胞生长增殖缓慢,轮廓清晰,细胞形态未发生变化。(图2A、2B)
2.2.2 荧光显微镜观察
转染后8 h可见明显GFP荧光表达;24 h时表达GFP细胞数量明显增多,同时荧光强度也增强(图2C、2D)。

图2 病毒转染人羊膜间充质干细胞(×200)
2.3 韧带相关分子表达水平检测
2.3.1 实时荧光定量PCR检测
转染7天后,A组表达SCX、Tnmd、ColⅠ、Fib及TNC均高于B组(P<0.05),但其SCX、Tnmd、Fib及TNC的表达量低于C组(P<0.05),而ColⅠ的表达量高于C组,差异有统计学意义(P<0.05)(图3)。

图3 人羊膜间充质干细胞诱导后肌腱细胞相关基因mRNA的表达
2.3.2荧光免疫组化分析
体外培养7天后,B组ColⅠ的表达量均高于A组和C组,C组ColⅠ的表达量高于A组(P<0.05)(图4)。
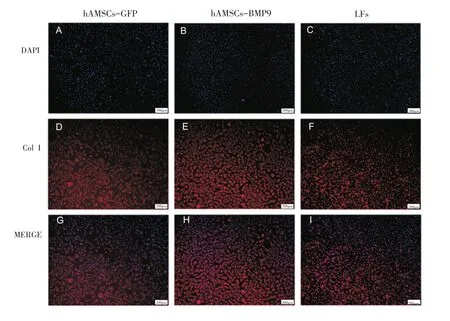
图4 免疫荧光检测各组Ⅰ型胶原表达量(×40)
3 讨论
与其他来源的MSCs相比,人羊膜间充质干细胞具有取材无创、采集便捷等优点[16],已广泛应用于骨损伤、神经性疾病、脊髓损伤等疾病的动物模型体内研究,对骨骼肌肉系统损伤的治疗具有良好前景[17]。BMPs对于发育过程中的细胞增殖和分化都发挥着重要作用,可以调控间充质干细胞向骨、软骨、脂肪和肌腱等方向分化[18]。BMP9作为其家族中成骨分化能力最强的成员,其能否诱导干细胞向韧带分化鲜有报道。这可能与BMP12的研究有关。BMP12具有较强的成韧带组织能力[19],有学者在兔模型上采用BMP12基因修饰促进了后交叉韧带损伤的组织学和生物力学愈合[20]。
传统的外源性添加诱导因子能够诱导MSCs向肌腱样细胞分化[11],但直接添加外源性生长因子具有价格昂贵、发挥生物活性时间短、局部浓度不确定等缺点[8]。故本研究通过腺病毒载体系统将人BMP9基因转入hAMSCs,使外源性基因在一定时间内高效表达[15]。实验结果表明,用BMP9基因修饰hAMSCs后,可明显促进hAMSCs向韧带成纤维细胞表型分化并促进韧带特异性基因表达和细胞外基质分泌。但目前尚无单一的表型标记来鉴定成熟的韧带成纤维细胞,因此本实验采用实时荧光定量PCR和免疫荧光检测,从基因和蛋白水平来评价BMP9基因修饰hAMSCs后促进其向韧带细胞分化的效果,并与LFs相比较。而本实验中使用的LFs细胞取自膝关节骨性关节炎全膝置换术患者,故肌腱细胞的增殖和特异性分子表达能力能否代表正常肌腱细胞还需进一步实验研究。
转化生长因子β(Transforming growth factor beta,TGF-β)超家族为现阶段韧带组织工程中的热点因子,包括TGF-β1(transforming growth factor beta 1)和骨形态发生蛋白(bone morphogenetic proteins,BMPs)家族,而其对种子细胞的诱导作用和途径却不尽相同[21]。TGF-β1主要通过介导ALK5的Ⅰ型受体或ALK1受体激活Smad2/3途径从而促进细胞分化和细胞外基质的合成[22],而BMPs家族对细胞诱导和分化效果主要通过介导ALK2、ALK3和ALK6受体,且不同的BMPs家族亚型对不同来源的细胞诱导效果也不一样[23]。如BMP12因其具有较强的纤维诱导作用被应用于腱骨愈合的研究,而BMP6或BMP7却抑制种子细胞的纤维化。Herrera等[24]发现,BMP9作为TGF-β1Ⅰ型受体ALK1的联合配体并激活Smad1/5/8途径促使内皮细胞、肾小球系膜细胞及肝癌细胞纤维化。不仅如此,Munoz等[14]发现BMP9还可激活Smad2/3及MAPK/ErK1/2受体从而增强细胞外基质的合成及种子细胞纤维化。既往研究表明ErK1/2被抑制后会降低BMP9的成骨分化效应,而BMP9刺激内皮细胞后会激活MAPK/ErK1/2受体,这说明MAPK/ErK1/2对于BMP9诱导种子细胞分化可能是另一个重要的途径[25]。然而BMP9与TGF-β1并不具有协同作用。Herrera等人还发现,尽管两种因子同时作用后比分别单独使用TGF-β1诱导增强了CAGA启动子的激活,比单独使用BMP9诱导减弱了BRE元件的激活,而对于Smad1/5/8和Smad2/3的激活效应却没有增强。更值得注意的是,经BMP9转染后的干细胞在培养过程中额外添加TGF-β1诱导因子复合诱导后检测发现一型胶原及纤维连接蛋白的表达量无明显改变,这说明BMP9与TGF-β1之间可能存在受体竞争作用[14]。
实验结果显示,转染7天后,B组中SCX、Tnmd、CoⅠ、Fib及TNC的mRNA表达量均高于A组(P<0.05)。SCX作为肌腱和韧带发生和发育的重要转录因子,参与肌腱祖细胞的聚集及分化[26,27]。Ⅰ型胶原是肌腱和韧带细胞外基质的主要组成部分,其对肌腱和韧带的强度至关重要[28]。Tnmd是肌腱分化的特异性标记,主要在肌腱和韧带以及骨骼肌的肌外膜中表达[29]。另一方面,转染7天后,B组SCX、Tnmd、Fib及TNC的mRNA表达量仍显著低于C组(P<0.05)。这可能与BMP9的诱导分化能力及时间有关。但B组CoⅠ的mRNA表达量显著高于C组(P<0.05),此结果相同于荧光免疫组化分析。这可能由多方面因素造成,一是LFs来源问题(OA患者)而导致ColⅠ表达量降低,有研究证明LFs在体外分离培养过程时,其培养周期较长且增殖能力较弱[30];二是hAMSCs经BMP9诱导后确实明显增加了ColⅠ的表达量,这需要进一步的实验研究进行验证。
综上所述,本研究将人BMP9基因成功转染人羊膜间充质干细胞,并诱导其成韧带细胞分化取得了一定效果,为hAMSCs作为韧带组织工程种子细胞提供了实验基础,同时为BMP9基因作用的研究提供了新的方向。

