蒲地蓝消炎颗粒的毒性研究
侯丽丽 ,陈文云,栗荣霞,晏永新,杨彦平
(1.山西省兽药监察所,太原030027;2.江西省兽药饲料监察所,南昌330029;3.西安雨田农业科技有限公司,西安710075;4.西安国联质量检测技术股份有限公司,西安710105;5.江西新世纪民星动物保健品有限公司,南昌330096)
蒲地蓝消炎片、蒲地蓝消炎口服液等是目前临床较常见的抗炎药物,由蒲公英、板蓝根、苦地丁、黄芩4味中药组成,其主要成分包含黄芩苷、汉黄芩素、咖啡酸等,具有清热解毒,抗炎消肿之功效,对金黄色葡萄球菌、溶血性链球菌等有较强的抑制作用,临床上用于治疗疖肿、腮腺炎、咽炎、扁桃体炎、淋巴腺炎等[1-3]。本课题研究的蒲地蓝消炎颗粒源于人药《部颁标准》第3册“蒲地蓝消炎片”,是由蒲公英、苦地丁、板蓝根、黄芩四味药材提取制成的复方制剂。蒲地蓝消炎颗粒尚未应用于动物临床,其安全性尚不清楚,基于此展开了蒲地蓝消炎颗粒的小鼠急性毒性试验和大鼠长期毒性试验,以观察并评价其长期用药的安全性。
1 材料和方法
1.1 材料
1.1.1 受试药物、试剂及仪器 蒲地蓝消炎颗粒,100g/袋,1.5g 生药 /g,批号:20120205,由江西新世纪民星动物保健品有限公司提供;ALT、AST、Bun、Crea、TP、ALB 等生化试剂盒由济南希森美康医用电子有限公司提供,批号:ZG8004;十万分之 一 电 子 分 析 天 平 (AB204-N,METTLER TLLEDO);全自动生化仪(日立 7100);血细胞计数仪(SysmexXT-2000i)。
1.1.2 试验动物 清洁级ICR小鼠60只,体重18-22g,清洁级 SD大鼠 80只,体重 100-120g,均雌雄各半。实验动物饲养于室温20~25℃,相对湿度45%~70%条件下,分别饲喂大、小鼠全价营养饲料,自由采食,饮水。
1.2 方法
1.2.1 蒲地蓝颗粒小鼠经口最大给药量测定[4-5]试验前12小时禁食不禁水,小鼠称重,随机分为3组,每组10只,分别灌胃蒲地蓝消炎颗粒溶液(0.375g生药 /mL、0.75g生药 /mL、1.5g 生药 /mL浓度),每次0.1mL/10g体重,24小时内给药3次,给药后饲养观察一周。
1.2.2 蒲地蓝颗粒大鼠长期毒性试验[5-7]将大鼠随机分为4组:高剂量组(60g生药/kg),中剂量组(40g 生药 /kg),低剂量组(20g 生药 /kg),对照组(等容积蒸馏水)。每天上午8~10时灌胃给药1次,给药容积为1mL/100g体重,连续给药4周,对照组给予等容积蒸馏水。每天观察动物精神状态、行为、活动、毛色、二便等一般体征,每周称重1次,并依体重变化调整药量。给药结束后,每组取10只大鼠,禁食12小时,采血,进行血液学、生化检查,系统解剖和病理学检查。各组剩余动物停止给药,观察2周后,进行相同指标检测。
2 结果
2.1 蒲地蓝消炎颗粒最大给药量测定 最高浓度1.5g生药/mL、每次0.1mL/10g体重、24小时内给药3次,给药后连续观察7天,小鼠全部存活,活动正常,未见耸毛、耳廓苍白或充血、突眼、步履蹒跚、肌肉瘫痪、呼吸困难、昏迷、惊厥、大小便失禁等不良反应。体重明显增长,与对照组无显著差异。7天后处死,大体解剖未见内脏器官有异常改变。蒲地蓝消炎颗粒小鼠最大给药量为45g生药/kg体重。
2.2 蒲地蓝消炎颗粒大鼠长期毒性试验
2.2.1 动物行为学观察
给药期间和停药2周内,各组大鼠精神、行为、活动、毛色、二便等一般体征均未见异常,也未出现因药物毒性而致死亡的情况。
2.2.2 体重
各给药组,给药4周和停药2周后大鼠体重明显增长,经t检验,与对照组比较,各给药组大鼠体重无明显差异。
2.2.3 血液、生化指标检测
与对照组相比,给药1个月后低剂量组HGB显著升高(P<0.05),停药2周后低剂量组WBC显著降低(P<0.05)。高剂量组和中剂量组血红蛋白(HGB)、红细胞(RBC)、血小板(PLT)、白细胞(WBC)及分类与对照组相比均无显著性差异(见表1、2)。
表1 停药4周对血液学指标的影响(±s,n=10)

表1 停药4周对血液学指标的影响(±s,n=10)
注:与对照组比较“*”表示 P<0.05,“**”表示 P<0.01,下表同;
项目 对照组 低剂量组 中剂量组 高剂量组RBC(×1012/L) 7.86±1.20 7.76±0.77 8.02±0.96 7.55±0.94 HGB(g/L) 136.3±12.9 153.8±9.8* 132.7±13.2 138.5±11.5 WBC(×109/L) 7.00±0.62 7.33±0.92 6.89±0.72 7.15±0.85 PLT(×109/L) 510.6±80.5 515.8±110.2 485.5±73.2 477.7±86.2淋巴细胞(%) 0.68±0.06 0.66±0.04 0.70±0.06 0.72±0.08中性粒细胞(%) 0.24±0.07 0.25±0.09 0.21±0.08 0.20±0.06凝血时间(秒) 64.39±5.97 67.77±8.14 65.06±7.62 67.46±9.29
表2 停药2周对血液学指标的影响(±s,n=5)
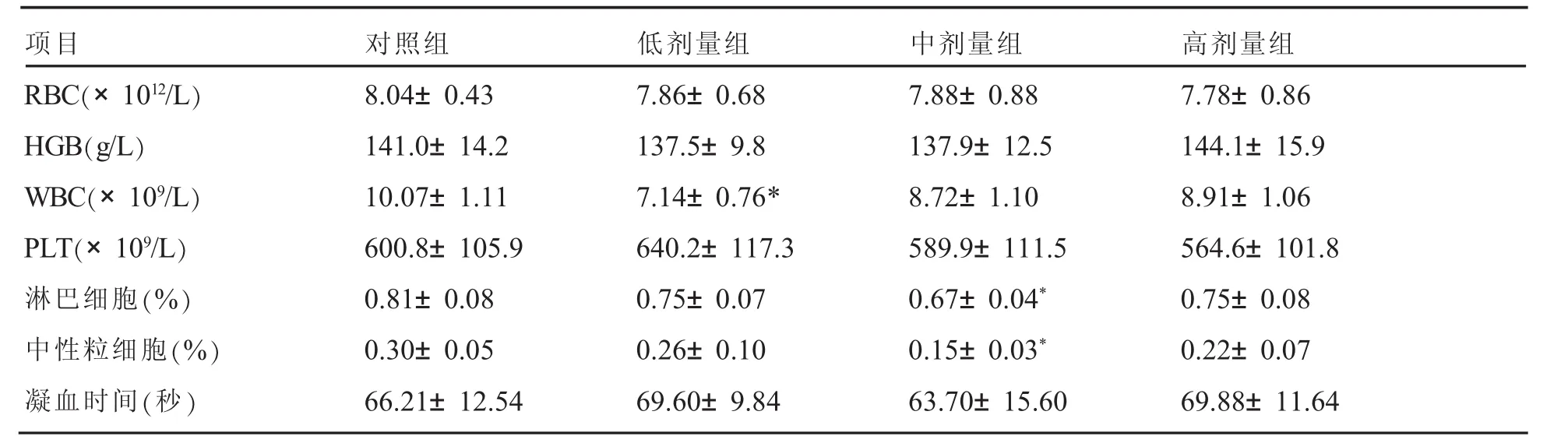
表2 停药2周对血液学指标的影响(±s,n=5)
项目 对照组 低剂量组 中剂量组 高剂量组RBC(×1012/L) 8.04±0.43 7.86±0.68 7.88±0.88 7.78±0.86 HGB(g/L) 141.0±14.2 137.5±9.8 137.9±12.5 144.1±15.9 WBC(×109/L) 10.07±1.11 7.14±0.76* 8.72±1.10 8.91±1.06 PLT(×109/L) 600.8±105.9 640.2±117.3 589.9±111.5 564.6±101.8淋巴细胞(%) 0.81±0.08 0.75±0.07 0.67±0.04* 0.75±0.08中性粒细胞(%) 0.30±0.05 0.26±0.10 0.15±0.03* 0.22±0.07凝血时间(秒) 66.21±12.54 69.60±9.84 63.70±15.60 69.88±11.64
与对照组相比,各剂量组给药1个月后ALT、AST、ALP、BUN、Crea、T-Bili、TP、Alb、GLU、T-CHO均无显著性差异(P>0.05)。与对照组比,停药两周后中剂量组血清ALP显著增加(P<0.05),而低剂量组和高剂量组ALP、各剂量组ALT、AST、BUN、Crea、T-Bili、TP、Alb、GLU、T-CHO均无显著性差异。(见表3、4)。
表3 给药4周对血液生化指标的影响(±s,n=10)

表3 给药4周对血液生化指标的影响(±s,n=10)
项目 对照组 低剂量组 中剂量组 高剂量组ALT(u/L) 49.3±7.3 51.6±7.3 47.3±9.3 46.96±11.4 AST(u/L) 166.5±19.8 170.8±26.3 156.8±16.7 188.3±22.8 ALP(u/L) 185.9±57.8 166.4±63.0 160.1±47.9 190.1±61.4 BUN(mmol/L) 9.5±2.5 10.1±3.7 9.4±3.4 10.1±3.0 Crea(umol/L) 98.5±14.2 103.0±15.8 96.5±16.8 92.3±13.5 T-Bili(umol/L) 1.79±0.30 1.75±0.34 1.86±0.32 1.80±0.36 TP(g/L) 80.0±7.8 77.9±7.5 81.8±7.8 77.6±9.1 Alb(g/L) 40.4±3.7 38.8±3.5 38.2±5.3 41.4±6.1 Glu(mmol/L) 4.89±0.80 4.67±0.93 4.96±0.87 4.66±0.93 T-CHO(mmol/L) 4.29±0.89 4.14±1.05 3.77±1.06 3.82±1.09
表4 蒲地蓝消炎颗粒停药2周对血液生化指标的影响(±s,n=5)
项目 对照组 低剂量组 中剂量组 高剂量组ALT(u/L) 52.0±9.5 46.6±10.6 51.5±8.0 56.7±8.4 AST(u/L) 136.4±15.9 149.8±23.8 146.3±17.4 145.8±22.0 ALP(u/L) 178.5±52.0 170.5±62.72 16.7±37.1* 193.7±56.5 BUN(mmol/L) 8.8±2.0 9.0±2.4 9.4±2.6 8.2±2.6 Crea(umol/L) 108.2±22.0 103.4±11.8 106.0±23.4 104.9±26.3 T-Bili(umol/L) 1.86±0.40 1.76±0.21 1.70±0.21 1.93±0.49 TP(g/L) 80.1±6.8 78.9±7.5 83.0±7.8 78.7±6.7 Alb(g/L) 39.0±7.4 40.3±5.7 37.9±7.9 39.3±6.5 Glu(mmol/L) 4.76±0.97 4.42±0.51 4.53±1.00 4.46±1.11 T-CHO(mmol/L) 2.55±0.96 2.55±0.63 2.05±0.58 2.05±0.91
2.2.4 系统解剖和病理组织学
进行系统解剖发现,给药4周后与停药2周后对照组和各剂量组动物脏器均无异常变化。对各组SD大鼠心、肝、脾、肺、肾进行称重,计算脏器系数结果表明,与对照组相比,各剂量组脏器系数无显著性差异(P>0.05)(见表 5、6);此外,对各组SD大鼠心、肝、脾、肺、肾进行制作石蜡切片,观察其形态发现,与对照组相比,各剂量组动物心、肝、脾、肺、肾未见明显的与药物有因果关系的病理性损害伤。
表5 给药4周对脏器指数的影响(±s,n=10)
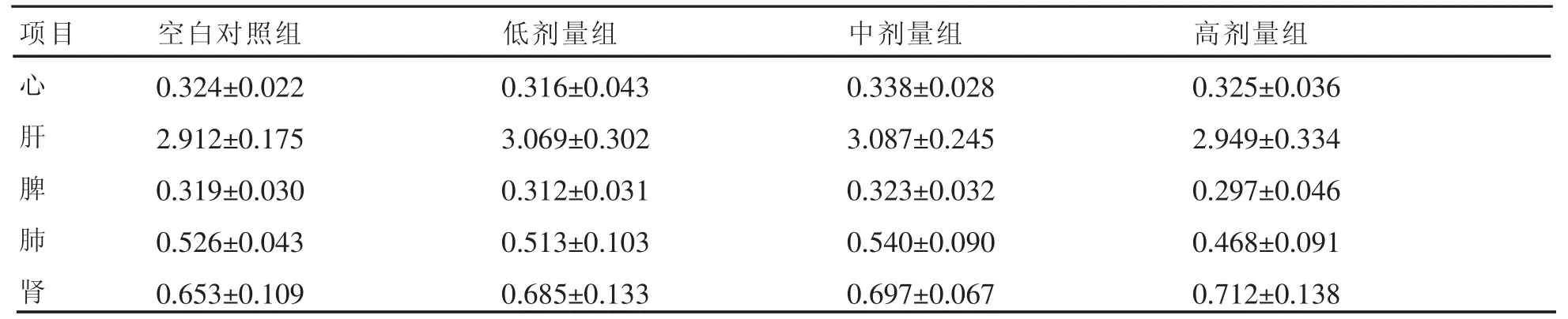
表5 给药4周对脏器指数的影响(±s,n=10)
项目 空白对照组 低剂量组 中剂量组 高剂量组心0.324±0.022 0.316±0.043 0.338±0.028 0.325±0.036肝2.912±0.175 3.069±0.302 3.087±0.245 2.949±0.334脾0.319±0.030 0.312±0.031 0.323±0.032 0.297±0.046肺0.526±0.043 0.513±0.103 0.540±0.090 0.468±0.091肾0.653±0.109 0.685±0.133 0.697±0.067 0.712±0.138
表6 给药2周对脏器指数的影响(±s,n=5)

表6 给药2周对脏器指数的影响(±s,n=5)
?
3 讨论与小结
急性毒性试验是一次大剂量给药后,对动物出现的毒性反应和死亡情况的观察,急性毒性试验可以测定引起急性中毒的剂量,揭示在药物中毒过程中所出现的毒性反应和可能的靶器官。长期毒性试验研究是新药安全性评价的重要研究内容,它为临床安全用药的剂量设置提供参考依据,为临床毒副反应的监护和生理生化指标的监测提供依据。长期毒性试验可以发现动物因连续给药产生的毒性反应,包括毒性反应的性质和程度,剂量与毒性效应的关系、可逆性等;推测药物的毒性反应靶器官;观察动物的耐受性,无毒性反应的安全剂量,毒性反应剂量和安全范围;观察停药后毒性反应的恢复情况等[5、8、9]。 由此可见,长期毒性试验在药物安全性评价中具有极其重要的作用,是新药评价不可缺少的研究资料。
本研究发现,蒲地蓝消炎颗粒急性毒性试验测得最大给药量相当生药45g/kg。此外,长期毒性试验结果表明,各组动物均未出现任何与药物有因果关系的毒性反应和死亡现象。各给药组动物的血液学、生化指标和病理学指标检测结果表明,除小剂量WBC、淋巴细胞分类等个别指标与对照组有显著差异外,其余与对照组比较均无显著性差异,故未发现蒲地蓝消炎颗粒明显的长期毒性。试验结果表明,蒲地蓝消炎颗粒安全范围大,临床使用具有较高的安全性。

