耐碳青霉烯类鲍曼不动杆菌的耐药机制
闫玲 顾兵, 张丽 马萍,
1徐州医科大学医学技术学院(江苏徐州 221004);2徐州医科大学附属医院检验科(江苏徐州 221002)
鲍曼不动杆菌以其耐药性广泛、可以快速获得抗生素耐药基因而闻名[1⁃2]。对其全基因组分析表明耐药基因大量表达[3⁃5],由染色体编码的AmpC酶、头孢菌素酶等β⁃内酰胺酶的产生使该菌对很多β⁃内酰胺类药物存在天然耐药,但对头孢吡肟及碳青霉烯类药物较稳定。然而,由于其生长特性及耐药特性,随着时间推移鲍曼不动杆菌对碳青霉烯类药物的耐药性逐年上升[6],严重威胁公共健康,迫切要求临床实验室能准确识别感染与耐药趋势以提示临床用药及实施感染控制措施。本研究针对临床分离的42株CRAB,采用分子生物学技术对该类细菌可能的耐药机制进行初步检测和分析,为临床用药与感染控制的实施提供一定的实验室依据。
1 材料与方法
1.1 菌株来源收集2017年1-4月徐州医科大学附属医院住院患者临床送检标本,经Vitek⁃2XL全自动细菌鉴定药敏分析仪鉴定为至少对一种碳青霉烯类药物(亚胺培南)耐药的42株非重复鲍曼不动杆菌,其中30株来源于痰标本、5株来源于血液标本、6株来源于纤支镜洗液标本、1株来源于脑脊液标本。质控标准菌株大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC⁃BAA⁃1705、肺炎克雷伯菌ATCC⁃BAA⁃1706购自卫生部临床检验中心。
1.2 主要试剂与仪器Vitek⁃2XL全自动细菌鉴定与药敏分析仪(法国梅里埃公司),ABI2720PCR扩增仪(美国ABI公司),DYY⁃8C型电泳仪(北京六一仪器厂),Bioshine Gelx1850凝胶成像系统(上海欧翔科学仪器有限公司)。GelRed(美国Biotium公司),dl2000 DNA marker(日本TaKaRa公司),2×Taq PCR MasterMix(北京天根生化科技),亚胺培南粉末、苯酚红(美国Sigma公司),细菌蛋白质提取液(美国Thermo公司),ZnSO4·7H2O粉末,NaOH粉末,5×TAE(上海捷瑞生物工程),Agarose LE琼脂糖(美国Promega公司),亚胺培南(IMP)、美罗培南(MEM)药敏纸片(10 μg)(英国OXIOD公司),哥伦比亚血平板、M⁃H平板(法国梅里埃公司),胰蛋白胨大豆肉汤(上海科玛嘉微生物技术有限公司)。
1.3 方法
1.3.1 抗菌药物敏感性试验采用Vitek⁃2XL全自动细菌鉴定药敏分析仪对临床标本中分离鉴定为鲍曼不动杆菌的菌株进行药敏试验,高级专家系统对检测结果进行核对修正后给出药敏结果(参照CLSI2017版标准判读)。
1.3.2 Carba NP试验[7]检测碳青霉烯酶在2 h内出现阳性结果(a管为红色或桔红色,b管为黄色)的报告为产碳青霉烯酶。见图1。

图2 mCIM试验Fig.2 mCIM Test
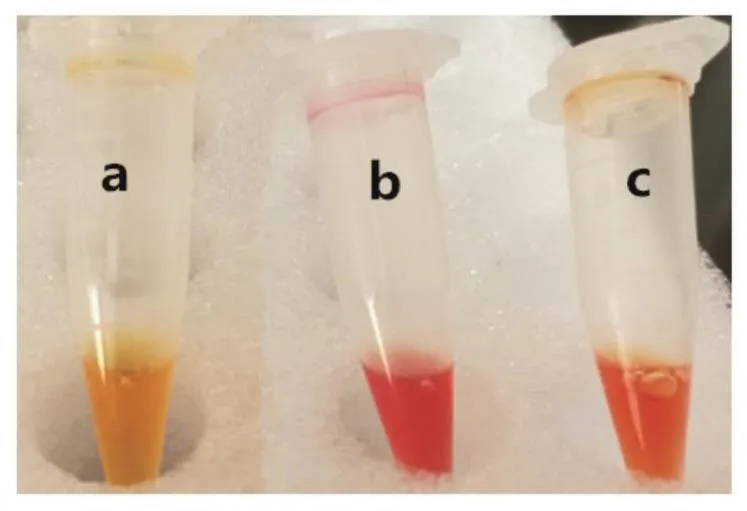
图1 Carba NP试验Fig.1 Carba NP Test
1.3.3 mCIM[8]检测碳青霉烯酶刮取1 μL血平板上过夜培养的菌落于胰蛋白胨大豆肉汤(Tryp⁃tone Soybean Broth,TSB)中,漩涡振摇10~ 15 s;使用无菌镊子每管加入一张10 μg的美罗培南/亚胺培南纸片,确保整张纸片浸没在TSB中;在(35±2)℃中培养4 h±15 min;在取出TSB中的美罗培南/亚胺培南纸片前,采用标准菌株ATCC25922配制0.5麦氏单位的菌悬液;按CLSI M02文件中常规纸片扩散法的步骤于15 min内在M⁃H平板上涂布上述菌悬液,干燥3~10 min;使用10 μL接种环取出TSB中的药敏纸片,在管壁内缘挤去多余液体放在涂布有ATCC25922的M⁃H平板上;在(35±2)℃中培养18~24 h之后,测量抑菌圈直径大小。抑菌圈直径为6~15 mm或在16~18 mm内有菌落生长,为碳青霉烯酶阳性;抑菌圈直径≥19 mm为碳青霉烯酶阴性;见图2。抑菌圈直径在16~18 mm,不确定是否存在碳青霉烯酶。
1.3.4 细菌DNA模板的制备及相关基因表达检测采用煮沸法提取细菌DNA。PCR技术检测常见碳青霉烯酶基因(blaKPC⁃2、blaNDM⁃1、blaIMP、blaVIM、blaGES、blaOXA⁃23),外排泵基因(adeB、adeJ)、整合子基因(Int1、Int2),相应引物参照文献由上海生工公司合成,引物序列及退火温度见表1。PCR反应总体积为25 μL,包括 DNA模板2 μL,10 μmol/L上下游引物各 1 μL,2×PCR Master Mix 12.5 μL,ddH2O 8.5 μL。产物经15 g/L琼脂凝胶电泳后,用凝胶成像系统分析。
1.4 统计学方法采用Kappa检验比较两种表型筛选试验与PCR检测的一致性,Kappa≤0.4说明一致性较差;Kappa≥0.75说明一致性好。

表1 扩增基因引物序列、反应条件及扩增长度Tab.1 Primer sequence,reaction conditions and amplification length of amplified genes
2 结果
2.1 药敏结果42株CRAB中多重耐药菌株占79.1%,主要表现为对对亚胺培南、哌拉西林、头孢他啶、头孢噻肟及头孢曲松耐药。然而这些多重耐药的CRAB全部对替加环素敏感。
2.2 碳青霉烯酶基因检测结果42株CRAB菌株中36株检测到碳青霉烯酶基因,blaNDM⁃1型有14株、blaOXA⁃23型有33株,其中11株同时合并两种基因。
2.3 两种方法筛选产碳青霉烯酶菌株的比较以PCR为金标准试验,Carba NP试验筛选产碳青霉烯酶菌株的灵敏度为0,特异度为83.3%,Kappa值为0.11。mCIM试验采用亚胺培南纸片时,其筛选产碳青霉烯酶菌株的灵敏度为97.2%,特异度为33.3%,Kappa值为0.88。mCIM试验采用美罗培南纸片时,其灵敏度为13.8%、特异度为66.6%,Kappa值为0.21。mCIM试验采用亚胺培南纸片筛选产碳青霉烯酶菌株与PCR方法一致性好。
2.4 外排泵基因42株CRAB菌株中有39株检测到外排泵基因(92.8%)。36株经PCR检测碳青霉烯酶基因阳性菌株中检测到外排泵基因34株(94.4%),6株未检测到碳青霉烯酶基因菌株中5株检测到外排泵基因(83.3%),adeJ基因阳性36株,adeB基因阳性35株,多数菌株两种外排泵基因同时存在。
2.5 整合子基因检测结果42株CRAB菌株中有25株检测到Int1基因(59.5%),未检测到Int2基因。36株PCR检测为碳青霉烯酶基因阳性菌株中22株检测到Int1基因(61.1%),6株未检测到碳青霉烯酶基因菌株中3株检测到Int1基因(50%)。CRAB相关耐药基因检测结果见表2。
3 讨论
耐碳青霉烯类鲍曼不动杆菌(CRAB)菌株耐药机制有多种:产生碳青霉烯酶、外膜蛋白缺失或表达降低、主动外排系统过度表达、青霉素结合蛋白位点改变及整合子机制等[17]。耐药机制中以产碳青霉烯酶为主,主要为A、B和D类碳青霉烯酶,青霉素结合位点改变少见[18]。A类中blaGES型分布在中东地区[19],而blaKPC型罕见[20];B 类中blaIMP、blaVIM、blaNDM型在鲍曼不动杆菌中都有检出[21-22];D 类中blaOXA⁃23、blaOXA⁃40、blaOXA⁃51、blaOXA⁃58、blaOXA⁃143这 5种亚组是鲍曼不动杆菌对碳青霉烯类药物获得性耐药的首要原因。本试验36株碳青霉烯酶基因阳性菌株中,检测到blaNDM⁃1型与blaOXA⁃23型两种碳青霉烯酶编码基因,碳青霉烯酶流行情况同上述研究结果相同。编码碳青霉烯酶的基因主要位于可移动基因如质粒或转座子上,使得耐药性在鲍曼不动杆菌属间传播,而且产碳青霉烯酶菌株毒力更强[23],因此实验室能够有效检测菌株的耐药机制对临床治疗意义重大。
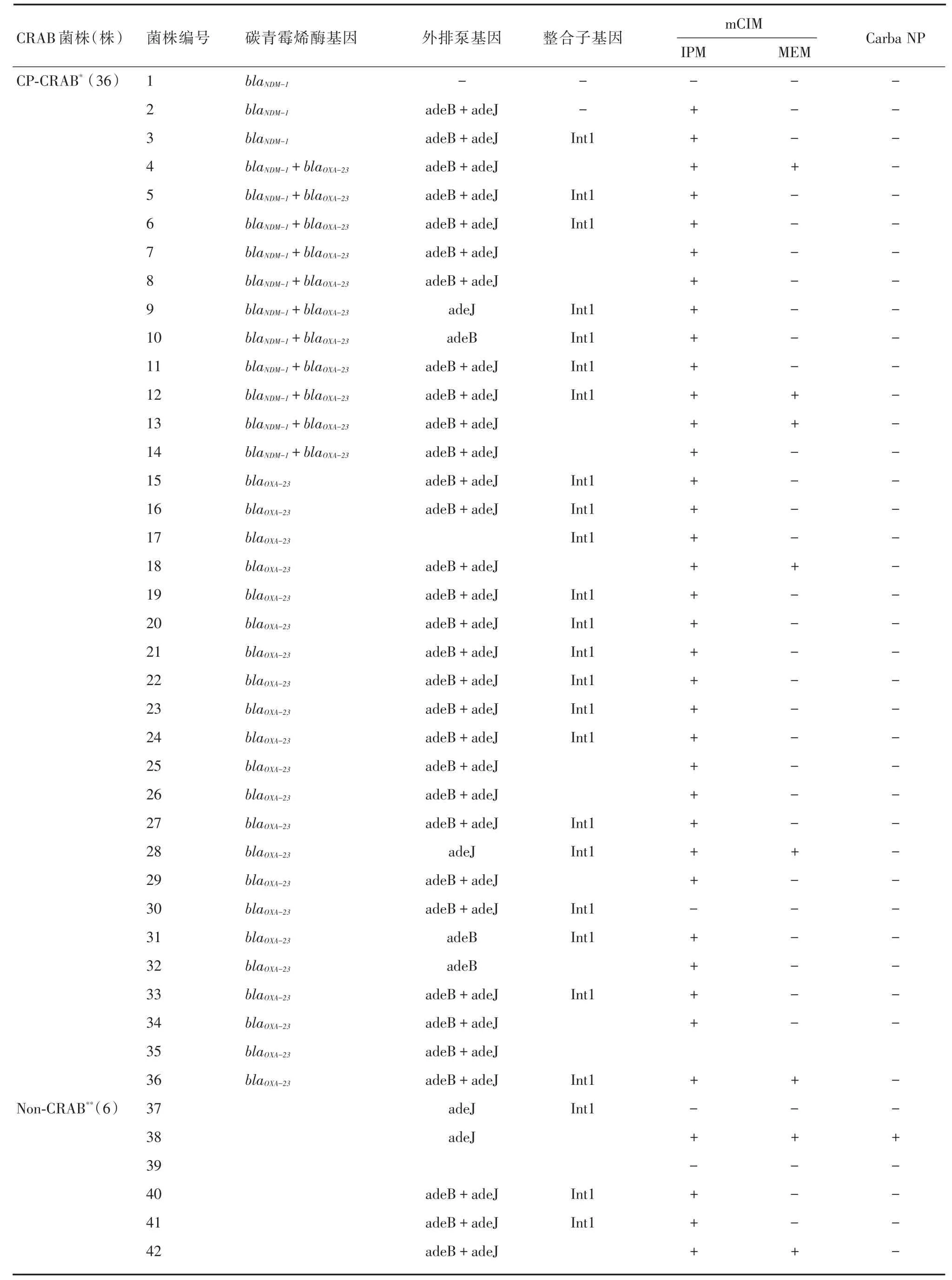
表2 CRAB菌株相关耐药基因及碳青霉烯酶表型检测结果Tab.2 Detection of resistance genes and carbapenem phenotype in CRAB strain
为了提高实验室快速检测产碳青霉烯酶菌株的能力,CLSI不断推出产碳青霉烯酶菌株表型筛选方法,改良Hodge试验被用于体外检测碳青霉烯酶活性,但难以检测到产blaNDM型与blaOXA型的菌株,同时非产酶菌株该试验可能为阳性。Carba NP试验基于pH值与比色法检测亚胺培南β-内酰胺环是否水解,该试验对所配试剂的pH值要求严格,且难以检测到粘液型菌株与产blaOXA⁃48型菌株。mCIM是采用美罗培南药敏纸片检测菌株中是否存在碳青霉烯酶,该方法操作简便价格低廉,目前推荐用于产碳青霉烯酶肠杆菌科细菌的筛选。本试验36株碳青霉烯酶基因阳性菌株中,35株mCIM阳性,Carba NP试验全部阴性。6株未检测到碳青霉烯酶编码基因的菌株中,4株mCIM阳性,1株Carba NP阳性。mCIM试验采用亚胺培南纸片时,与PCR方法的一致性最好(Kappa=0.88)。相比Carba NP,mCIM更适用于产碳青霉烯酶鲍曼不动杆菌的表型筛选。对于出现表型筛选阳性而基因检测阴性的菌株是因为试验设计引物有限未涉及到所有碳青霉烯酶基因,进一步说明PCR方法只适用于已知碳青霉烯酶菌株检测的局限性。
整合子是保守的类似于转座子的DNA元素,具有捕捉与调动基因盒的能力。整合子基因阳性菌株与多药耐药显著相关[24],其可作为耐药基因的载体进行耐药机制的传播。Int1是临床分离鲍曼不动杆菌中最常检测到的整合子基因型[25]。本试验42株CRAB菌株中有25株检测到Int1基因,未检测到Int2基因,CRAB菌株整合子的携带率达到59.5%,说明鲍曼不动杆菌对碳青霉烯类抗生素耐药与 Int1 有关。blaNDM⁃1型与blaOXA⁃23型碳青霉烯酶编码基因的36株菌中,22株检测到Int1基因,产酶菌株整合子的携带率为61.1%,整合子的存在使获得性来源的碳青霉烯酶的编码序列能在不同菌属间横向传播。
耐药节结化细胞分化(RND)超家族中的Ade⁃ABC、AdeIJK、AdeFGH与鲍曼不动杆菌耐药相关。如果编码这些外排泵蛋白的基因或相关基因发生突变可致其高表达,并且抗菌药使用的压力使主动外排泵活性增强。研究[26]表明AdeABC外排泵的过度表达使亚胺培南和美罗培南的MIC值增加了2倍,说明AdeABC外排泵在鲍曼不动杆菌耐碳青霉烯类药物的耐药机制中起作用,而且与D类碳青霉烯酶作用时,会出现协同耐药效应。FERNANDO[27]研究表明过度表达的adeB在耐药中起重要作用。SUGAWARA等[28]研究表明 AdeI⁃JK表达的同时伴有AdeABC的表达,二者在多重耐药中具有协同作用。本试验42株CRAB菌株中有35株检测到AdeB基因,36株检测到AdeJ基因,其中32株同时合并AdeB、AdeJ两种基因的情况下,伴有blaOXA⁃23型碳青霉烯酶的存在,提示外排泵基因的过度表达与碳青霉烯酶协同作用导致对碳青霉烯类药物的耐药。
本研究中收集的CRAB菌株全部对替加环素敏感,替加环素作为第一种被FDA批准上市的甘氨酰四环素抗菌药,该药具有临床用药方便、与其他药物无交叉耐药且肝肾毒性低等特点[29]。张冀霞等[30]对11个城市15家三级甲等教学医院临床常见多重耐药菌进行研究,结果表明,替加环素对临床常见多重耐药菌(包括MRSA、VRE、产ESBL及耐碳青霉烯类肠杆菌科细菌和鲍曼不动杆菌)均具有良好的体外抗菌活性。其结论与本试验研究结果一致,替加环素对CRAB感染治疗具有乐观的前景,但是仍需要做好其药敏监测工作,及时指导临床合理用药。
本研究临床分离耐碳青霉烯类鲍曼不动杆菌耐药机制复杂,多数菌株产碳青霉烯酶的同时伴有外排泵基因、整合子基因的大量表达。提示临床医生用药时应严格遵循用药原则,尽量减少抗生素的选择性压力;需要实验室选择有效的产碳青酶烯酶表型筛选方法(mCIM)检测可疑产酶菌株,为CRAB菌株的预防控制提供准确的实验室依据。

