早期穿刺人工血管在血液透析血管通路中的临床应用
黄德绪 胡波 李佛兰 尹良红
暨南大学附属第一医院肾内科(广州 510630)
血管通路是维持性血液透析患者的生命线,影响着患者的透析效果和长期存活率[1]。以带隧道带涤纶套导管(tunneled cuffed catheter,TCC)作为长期血管通路将导致全因病死率相应增加2~3倍,败血症风险增加7倍,中心静脉狭窄等不良后果[2-3],因此避免中心静脉导管置管或缩短置管时间显得尤为重要。自体动静脉内瘘(arteriovenous fistula,AVF)是维持性血液透析血管通路的首选,然而AVF术后需要经过6~8周的“成熟期”才能使用,而且早期失败率高[4]。人工血管动静脉内瘘(arteriovenous graft,AVG)作为自体血管耗竭而无法建立AVF的重要选择,具有较高早期成功率、低败血症风险等优势。常规聚四氟乙烯(ex⁃panded polytetrafluoroethylene,ePTFE)人工血管需要至少2星期成熟期,而早期穿刺人工血管(Early cannulation graft)最早可于术后24 h内穿刺,更具有避免中心静脉导管的使用或者缩短中心静脉导管置管时间等优势[5]。目前国内尚缺早期穿刺人工血管(GORE®AcusealTM)作为维持性血液透析血管通路的相关研究报道,本文回顾性分析暨南大学附属第一医院肾内科20例早期穿刺人工血管患者的临床资料,现报告如下。
1 对象与方法
1.1 研究对象单中心回顾性队列研究,纳入2017年1月1日至2017年6月30日在暨南大学附属第一医院行早期穿刺人工血管(GORE®AcusealTM)动静脉内瘘手术的终末期肾脏病患者。术前评估和手术由暨南大学附属第一医院肾内科血管通路医师完成。术前评估满足:(1)术前血管条件满足:动脉直径≥2.5 mm,无严重钙化、静脉直径≥3 mm;(2)有同侧深静脉置管史、肿胀手或明显胸壁静脉曲张患者术前需行DSA血管造影检查,排除中心静脉狭窄、闭塞。排除标准:(1)合并严重疾病,预计生存期少于6个月;(2)严重心脏疾病或周围血管疾病;(3)基础血压低于90/60 mmHg;(4)严重凝血功能障碍;(5)手术部位感染、脓毒血症或败血症。
1.2 研究方法
1.2.1 研究资料收集资料来自于医院信息系统、血液透析记录单、当地血透中心提供、电话随访。随访AVG使用情况及通畅率:初级通畅率=(随访时间点未经干预保持通畅的AVG例数/随访总例数)×100%;辅助初级通畅率=(随访时间点内通畅的AVG例数/随访总例数)×100%;AVG的通畅标准:在1个月的2/3透析中能满足穿刺2针并且平均血流速度至少达到200 mL/min。
1.2.2 手术方法选用GORE®公司早期穿刺人工血管(AcusealTM)。术前物理及超声评估血管并标记血管。根据选取血管走形选择纵向或横行切口,分离显露静脉(包括肘正中静脉、头静脉、贵要静脉或肱静脉),及动脉(包括肱动脉或桡动脉)。人工血管静脉端修剪成喇叭口形状,与自体静脉行端侧吻合(GORE CV⁃7血管缝线),用隧道器做皮下隧道,植入人工血管(先吻合静脉端或先植入人工血管均可),注意人工血管标记线方向,防止人工血管扭转。吻合动脉端,开放动脉夹保留静脉夹,排气后再开放静脉夹。动静脉端吻合口放置凝胶海绵加以轻度按压止血数分钟,检查无明显出血后缝合皮肤。术中无使用肝素,人工血管无需预冲,术后未放置引流管。
1.2.3 术后处理常规应用一代头孢预防感染3 d,未给予常规抗凝或抗血小板治疗。术后每2~3天换药1次,术后14 d拆线。术后抬高术肢,术肢注意保暖及避免过度弯曲。
1.2.4 人工血管首次穿刺护理操作人工血管内瘘穿刺前应由血管通路医师及护士长评估人工血管内瘘满足:内瘘震颤明显,人工血管走形表浅易于穿刺,无明显血肿、血清肿,确定血流方向。首次由护士长或高年资护士穿刺,严格遵循无菌操作,要求带无菌手套穿刺,选择17号内瘘针,以45°角进针,穿刺成功后固定穿刺针。半量低分子肝素抗凝,血流速度减慢,约180~200 mL/min;透后拔针按压15 min,注意内瘘震颤情况及有无血肿形成。做好患者教育。
1.3 统计学方法数据采用IBM SPSS Statistics 22.0(Armonk,NY,US)软件进行分析,结果采用均数±标准差表示。
2 结果
2.1 一般资料共纳入20例患者植入AcusealTM人工血管建立上肢AVG,男11例,女9例,平均年龄:(59.1± 13.5)岁,平均透析龄:(33.0± 41.9)月,既往长期血管通路手术次数:平均(1.2±0.9)次,95%患者既往有深静脉置管史(表1)。
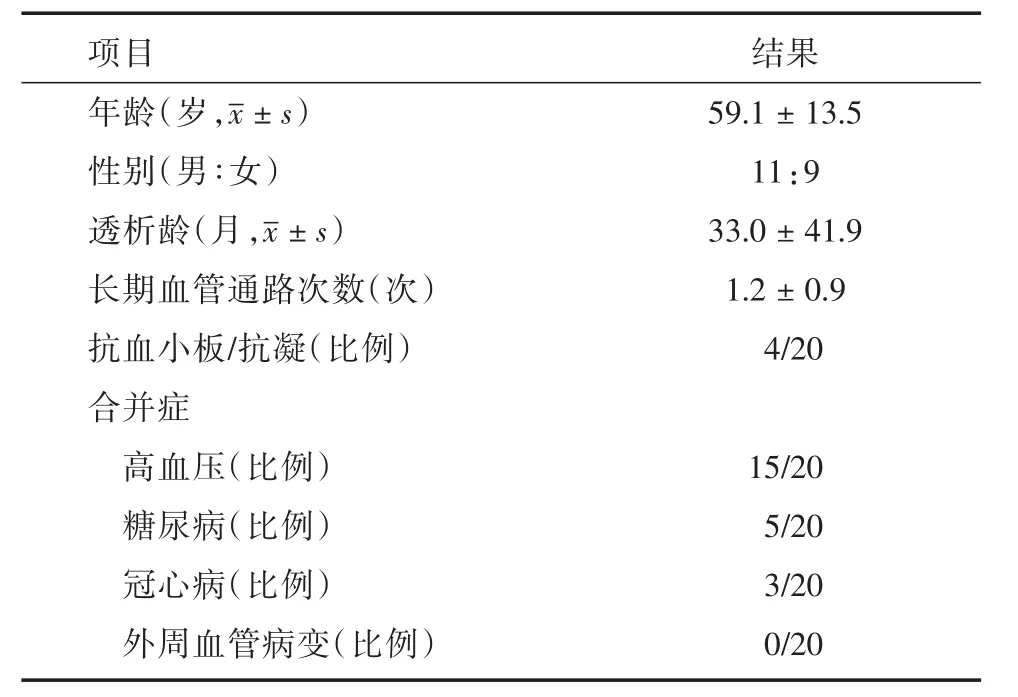
表1 患者一般资料Tab.1 Basic patient demographics
2.2 手术结果20例患者建立上肢AVG,其中前臂AVG 18例次,包括袢型16例次、直型2例次;动脉选择:肱动脉16例次、桡动脉2例次;静脉选择肘正中静脉8例次、贵要静脉5例次、头静脉5例次。上臂AVG 2例次,包括袢型1例次,直型1例;动脉选择:肱动脉2例;静脉选择:腋静脉2例。
2.3 围手术期并发症血清肿和血肿的发生率分别为20%和5%,4例术后出现肿胀手,其中1例重度肿胀造影证实存在锁骨下/中心静脉狭窄,3例轻-中度肿胀术后3~6周保守治疗后可消肿;1例术后出现血肿,该患者已行多次人工血管内瘘并栓塞,选用腋静脉延伸段位于胸前区,手术创面大而且规律服用抗血小板药物,导致术后出现血肿(表2)。围手术期感染发生率为2例次(10.5%),2例出现伤口感染,经保守治疗后痊愈。1例患者AVG术后20 d死于肺炎,AVG通畅、无感染。
2.4 首次穿刺情况20例患者AVG术后均可成功完成首次穿刺,透析血流速度可达230 mL/min,手术成功率100%。首次穿刺时间最短为术后16 h,本研究90%患者人工血管植入术后2周内行首次穿刺,仅1例患者因手肿胀、1例因患者未进入常规透析而未使用人工血管内瘘(表3)。AVG术后2星期内行早期穿刺,均未见血肿、假性动脉瘤、感染等并发症。
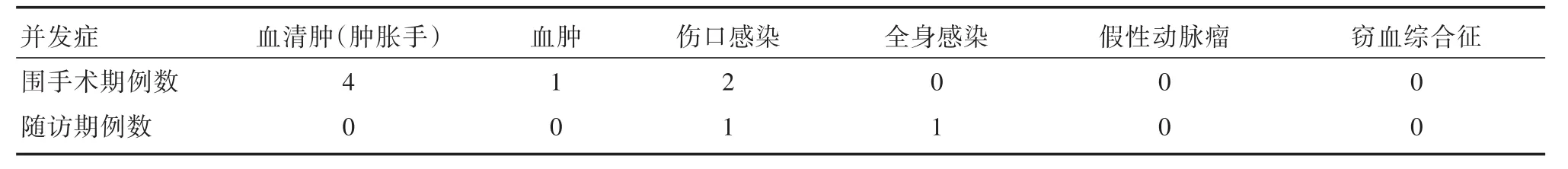
表2 围手术期及随访期并发症Tab.2 Complications during perioperative and follow⁃up 例
2.5 随访情况术后随访3~9个月,平均随访时间为(173±48)d,3个月初级通畅率为79%,3个月辅助初级通畅率为84%。1例患者术后1个月栓塞,溶栓后开通内瘘,造影证实存在锁骨下静脉狭窄已行腔内治疗成功开通锁骨下静脉。1例患者术后1个月栓塞,彩超发现自体静脉狭窄,但患者拒绝手术开通AVG内瘘,改为带隧道带涤纶套中心静脉导管维持透析。1例患者术后87 d栓塞,彩超发现自体静脉狭窄,手术取栓及经皮球囊扩张血管成形(PTA)术后再次栓塞,改为带隧道带涤纶套中心静脉导管维持透析(表4)。随访期感染发生率为2例次(10.5%),1例患者术后2个月人工血管穿刺部位感染,分泌物培养为铜绿假单胞菌,经保守治疗后无效于2017年7月行人工血管拔除;1例患者伤口拆线后不愈合导致人工血管外露,正常使用8个月后人工血管局部感染,行感染段局部切除重新吻合后成功保住人工血管。

表3 人工血管内瘘首次穿刺时间Tab.3 Time of first graft cannulation after operation

表4 术后3个月内早期穿刺人工血管内瘘失功的原因Tab.4 The cause of early cannulation graft failure within 3 months after operation
3 讨论
早在1986年SCHANZER等[6]报道了第一代早期穿刺三层结构硅胶人工血管,但由于当年未得到美国食品药品监督管理局(FDA)批准而没有广泛应用。目前市面上至少有四款早期穿刺人工血管,包括:Flixene,Avflo,Rapidax,Acuseal,均可术后72 h内可提供穿刺,最早可于术后24 h内穿刺。本研究采用的AcusealTM早期穿刺人工血管具有多层结构,外层膨体聚四氟乙烯(ePTFE),中层是硅胶,内层是带肝素涂层的ePTFE,特有的三层结构设计具有吻合口出血少、穿刺部位出血少、减少术后血清肿、持续抗凝等优点[7]。
本研究纳入20例植入早期穿刺人工血管的患者,20例患者均成功完成首次穿刺,透析血流速度可达230 mL/min,手术成功率100%,其中90%患者于术后2周内进行首次穿刺,而且未发现早期穿刺导致的血肿、血清肿、假性动脉瘤、感染等并发症。本研究所有患者于成功使用AVG行血液透析1~2次后拔除中心静脉导管,尽管本研究90%患者于术后2周内进行首次穿刺,45%患者于术后72 h内穿刺,然而仅1例患者可以避免中心静脉置管,原因分析如下:(1)本研究绝大多数患者需紧急透析而使用中心静脉导管过度;(2)目前使用早期穿刺人工血管相关研究数据及经验尚欠缺,首次穿刺时间仍偏保守。本研究采用的早期穿刺人工血管的三层结构设计降低术后血清肿和血肿的发生率,分别为20%和5%,明显低于文献报道的95%肿胀手发生率[8]。总结本研究,早期穿刺人工血管的优势:(1)AVG术后2周内可以成功穿刺行血液透析治疗,并且未发现早期穿刺导致的相关并发症;(2)避免或缩短中心静脉导管的置管时间;(3)降低术后肿胀手的发生率。
本研究随访期间4例AVG失功,包括3例栓塞,1例感染手术拔除。随访过程中未发现缺血综合征,无假性动脉瘤的形成,未发现明显与人工血管早期穿刺相关的并发症。术后3个月早期穿刺人工血管动静脉内瘘初级通畅率为79%与AIT⁃KEN等[9]人报道的初级通畅率相当,然而目前临床研究发现不管普通ePTFE人工血管还是Acuse⁃alTM早期穿刺人工血管长期通畅率并不理想,1年初级通畅率不足50%[10]。本研究人工血管感染发生率为4例次(21.1%),2例发生于术后2周内围手术期,2例发生于随访期,其中1例人工血管感染导致全身炎症反应,保守治疗无效后行手术拔除。感染是慢性肾脏病患者第二最常见的死亡原因,而人工血管内瘘是继中心静脉导管后感染发生率最高的血管通路,据文献报道人工血管内瘘感染发生率是自体血管内瘘的4倍,人工血管感染率为11%~35%[11-13],本研究人工血管感染发生率与文献报道相当。人工血管内瘘感染常见危险因素包括:手术及护理穿刺无菌操作欠缺、手术及穿刺导致血肿、糖尿病、低蛋白血症、免疫抑制、个人卫生不足等[13]。降低人工血管内瘘感染发生率至关重要,应注意无菌操作、预防性使用抗生素及控制危险因素。总而言之,早期穿刺人工血管内瘘的初级通畅率与普通ePTFE人工血管相当,而且并未增加感染、假性动脉瘤形成等并发症的发生率。
本研究回顾性分析本中心建立的20例早期穿刺人工血管内瘘的短期临床资料,总结如下:早期穿刺人工血管可于术后2星期内穿刺行血液透析治疗,具有避免中心静脉导管的使用或者缩短置管时间,减少术后肿胀手发生率等优势,而且不增加并发症及降低通畅率,但本研究存在病例数较少及随访时间短等不足,仍需大样本及长期临床研究评价早期穿刺人工血管的临床疗效及安全性。

