髓源性抑制细胞在免疫性血小板减少性紫癜中的临床意义
凌奕文 张复华 赵莹 陈焯文
1佛山市第一人民医院血液淋巴瘤科(广东佛山 528000);2佛山市南海区人民医院血液科(广东佛山 528200)
髓源性抑制细胞(MDSCs)是一群异质性细胞,来源于骨髓祖细胞和未成熟髓细胞,表面标志为CD33+CD11b+HLA⁃DR-。MDSCs可通过多种途径发挥免疫抑制功能,包括:(1)诱导一氧化氮合酶(iNOS)活性的改变,使NO的合成和分泌受到影响,从而诱导T细胞发生凋亡;(2)干扰L⁃精氨酸代谢通路,MDSCs细胞内高表达精氨酸酶1(Arg⁃1),通过消耗大量L⁃精氨酸使T细胞摄取精氨酸减少,最终导致T细胞功能与增殖减弱;(3)诱导调节性T细胞(Treg)增殖,从而干扰到T细胞的活化[1-2];(4)可释放ROS,诱导T细胞凋亡和使T细胞受体硝基化,最终影响T细胞活化;(5)下调选择素L(CD62L)的表达,使未活化T细胞归巢减少,不能迁移到淋巴结中被肿瘤抗原所激活,最终影响T细胞的免疫应答。原发性免疫性血小板减少性紫癜(ITP)是一种以血小板过度破坏和/或血小板生成减少为特点的自身免疫性出血性疾病。ITP的病理生理过程至今未得到阐明,T细胞异常被认为在ITP发病机制中占重要作用,一些免疫调节细胞得到关注,如Th细胞失衡[3-4],Treg细胞数量减少及缺陷5,细胞毒性T细胞破坏血小板[6-7]。由于ITP发病机制的复杂及难治性ITP的治疗困境,临床亟需阐明ITP发病机制及寻找ITP治疗新靶点。在自身免疫性疾病动物模型中,MDSCs对头发、胰腺起保护作用,抑制其病理损伤[8-9];同时,MDSCs对神经系统起病理损伤作用[10],这使得MDSCs可能成为治疗自身免疫性疾病的新靶点。但是,在ITP这个自身免疫性出血性疾病中,MD⁃SCs起的作用未得到阐明。本文通过研究MDSCs及淋巴细胞亚群在ITP患者发病及治疗过程中的动态变化,进一步探讨ITP的发病机制,为ITP的诊疗提供理论依据。
1 资料与方法
1.1 临床资料2016年1月至2017年8月接受治疗的ITP患者55例,其中男19例,女36例,中位年龄34岁(17~55岁);健康体检者60例,其中男21例,女39例,中位年龄33岁(21~57岁)。所有ITP患者均符合文献[11]中的诊断标准,排除常见导致继发性血小板减少病因,如自身免疫性疾病、肿瘤、药物因素等。排除标准:(1)心、肝、肾等重要器官功能异常者;(2)合并重症感染;(3)妊娠;(4)血栓病史;(5)失访患者。ITP初始治疗给予标准剂量的糖皮质激素[泼尼松1 mg/(kg·d),或等效地塞米松、甲泼尼松]或冲击治疗(甲泼尼松0.5~1.0 g/d,3 d),根据临床出血情况及PLT水平,决定是否给予丙种球蛋白冲击及血小板输注,单用糖皮质激素治疗无效,则加用重组人血小板生成素、艾曲波帕、切脾或环孢素等二线治疗。
1.2 研究方法55例ITP患者作为研究组,60例健康体检者作为对照组。分别检测对照组、研究组外周血中MDSCs水平、T细胞亚群、iNOS及ARG表达。采用流式细胞术(FACS)检测外周血中MD⁃SCs、T 细胞亚群,检测管加入:(1)CD11b⁃FITC、CD33⁃PE、HLA⁃DR⁃APC单抗各 7 μL;(2)CD8⁃PE、CD4⁃APC、CD3⁃PECY5;(3)CD4⁃FITC、CD25⁃PECY5。对照管加入鼠抗人IgG⁃FITC、IgG⁃PE、IgG⁃APC、IgG⁃PECY5单抗各7 μL。各管再加入120 μL全血,避光孵育20 min。(2)加入红细胞裂解液3~4 mL,避光孵育8~10 min。(3)PBS洗涤2次(1 000 r/min,5 min),最后500 μL PBS重悬,流式细胞仪检测。每份标本测定5 000个细胞,全部数据用流式细胞仪自带软件获取和分析,测定MDSCs、CD3+CD4+T细胞、CD3+CD8+T细胞、CD4+CD25+T细胞的百分率。
ELISA法检测iNOS、ARG表达。步骤:(1)加样:分别设空白孔、标准孔、待测样品孔。空白孔不加任何液体,余孔分别加标准品或待测样品100 μL,注意不要有气泡,加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀,酶标板加上盖或覆膜,37℃反应30 min。(2)温育后,弃去孔内液体,甩干,洗板3次,每次浸泡1~2 min,200 μL/每孔,甩干,最后用力在洗水纸上拍干。(3)每孔加酶结合物100 μL,空白孔不加。混匀,37 ℃,30 min。(4)温育后,弃去孔内液体,甩干,洗板5次,每次浸泡1 ~ 2 min,200 μL/每孔,甩干,最后用力在洗水纸上拍干。(5)依序每孔加底物溶液90 μL,37 ℃避光显色。(30 min内,此时肉眼可见标准品的前3~4孔有明显的梯度兰色,后3~4孔梯度不明显,即可终止)。(6)依序每孔加终止溶液50 μL,终止反应,此时蓝色立转黄色。终止液的加入顺序应尽量与底物液的加入顺序相同。为了保证实验结果的准确性,底物反应时间到后应尽快加入终止液。(7)在加终止液后立即进行检测,用酶标仪在450 nm波长依序测量各孔的OD值。
1.3 疗效标准参照ITP国际工作组2007年制定的疗效标准[12],完全反应(CR):治疗后PLT ≥ 100×109/L且无出血;有效(R):治疗后PLT≥30×109/L且至少比基础PLT增加2倍,且没有出血;无效(NR):治疗后PLT<30×109/L或者PLT增加不到基础值的2倍或者有出血。
1.4 统计学方法结果以均数±标准差表示,采用独立样本t检验、非参数相关分析方法,应用统计软件SPSS 15.0分析。
2 结果
2.1 MDSCs水平研究组外周血中MDSCs比例低于对照组[(1.75± 0.34)%vs.(0.78±0.45)%],差异有统计学意义(P<0.05);研究组中治疗达CR及R者,治疗后外周血中MDSCs比例高于发病时,差异有统计学意义(P<0.05,表1);研究组中治疗NR者,治疗后外周血中MDSCs比例稍高于发病时,差异无统计学意义(P>0.05,表1)。
表1 研究组治疗前后外周血MDSCs比例Tab.2 The proportion of MDSCs in peripheral blood beforeand after treatment in the study group ± s,%
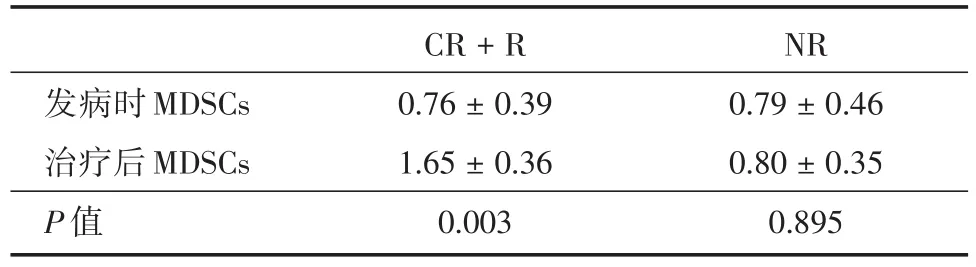
表1 研究组治疗前后外周血MDSCs比例Tab.2 The proportion of MDSCs in peripheral blood beforeand after treatment in the study group ± s,%
发病时MDSCs治疗后MDSCs P值CR+R 0.76±0.39 1.65±0.36 0.003 NR 0.79±0.46 0.80±0.35 0.895
2.2 淋巴细胞亚群水平研究组外周血中CD3+CD4+细胞与CD3+CD8+细胞均高于对照组,CD4+CD25+细胞则低于对照组,差异均无统计学意义(P>0.05,表2)。研究组中治疗达CR及R者,治疗后外周血中CD4+CD25+细胞比例高于发病时,差异有统计学意义(P<0.05,表3);研究组中治疗NR者,治疗后外周血中CD3+CD4+细胞、CD4+CD25+细胞比例低于发病时,CD3+CD8+细胞高于发病时,差异无统计学意义(P>0.05,表3)。
表2 对照组与研究组患者外周血淋巴细胞亚群比例Tab.2 The proportion of lymphocyte subsets in peripheral blood in the control group and the study group ± s,%
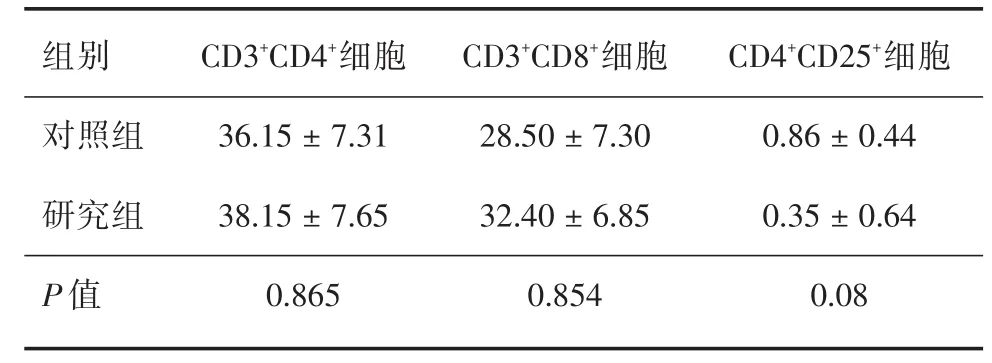
表2 对照组与研究组患者外周血淋巴细胞亚群比例Tab.2 The proportion of lymphocyte subsets in peripheral blood in the control group and the study group ± s,%
组别对照组研究组P值CD3+CD4+细胞36.15±7.31 38.15±7.65 0.865 CD3+CD8+细胞28.50±7.30 32.40±6.85 0.854 CD4+CD25+细胞0.86±0.44 0.35±0.64 0.08
表3 研究组治疗前后淋巴细胞亚群比例Tab.3 The proportion of lymphocyte subsets in peripheral blood before and after treatment in the study group ± s,%
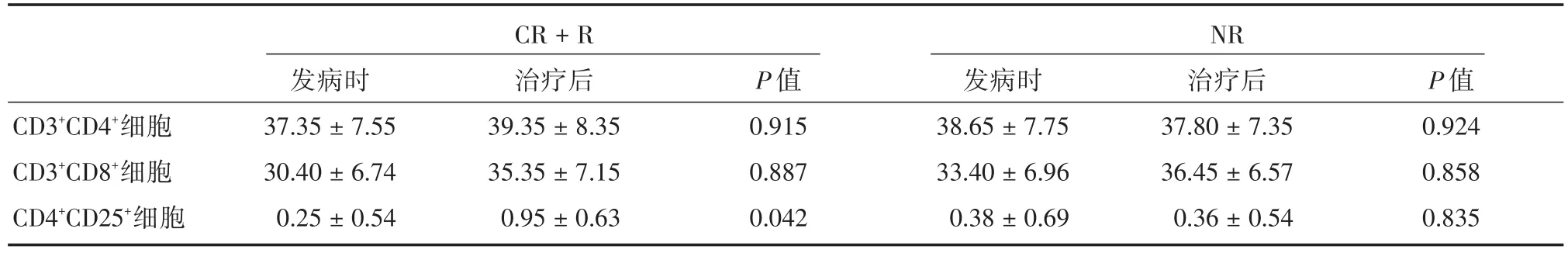
表3 研究组治疗前后淋巴细胞亚群比例Tab.3 The proportion of lymphocyte subsets in peripheral blood before and after treatment in the study group ± s,%
CR+R NR CD3+CD4+细胞CD3+CD8+细胞CD4+CD25+细胞发病时37.35±7.55 30.40±6.74 0.25±0.54治疗后39.35±8.35 35.35±7.15 0.95±0.63 P值0.915 0.887 0.042发病时38.65±7.75 33.40±6.96 0.38±0.69治疗后37.80±7.35 36.45±6.57 0.36±0.54 P值0.924 0.858 0.835
2.3 iNOS、ARG表达研究组外周血中iNOS、ARG表达水平均低于对照组,差异有统计学意义(P<0.05,表4);研究组中治疗达CR及R者,治疗后外周血中iNOS、ARG表达水平比例高于发病时,差异有统计学意义(P<0.05,表5);研究组中治疗NR者,治疗后外周血中iNOS、ARG表达水平稍高于发病时,差异无统计学意义(P>0.05,表5)。
表4 对照组与研究组患者外周血iNOS、ARG表达水平Tab.4 The expression of iNOS and ARG in peripheral blood in the control group and the study group ± s,mIU/mL
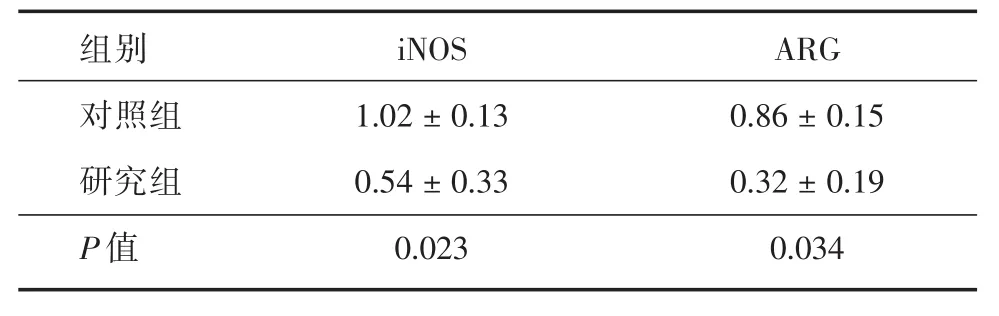
表4 对照组与研究组患者外周血iNOS、ARG表达水平Tab.4 The expression of iNOS and ARG in peripheral blood in the control group and the study group ± s,mIU/mL
组别对照组研究组P值iNOS 1.02±0.13 0.54±0.33 0.023 ARG 0.86±0.15 0.32±0.19 0.034
表5 研究组治疗前后外周血iNOS、ARG表达水平Tab.5 The expression of iNOS and ARG in peripheral blood before and after treatment in the study group ± s,mIU/mL
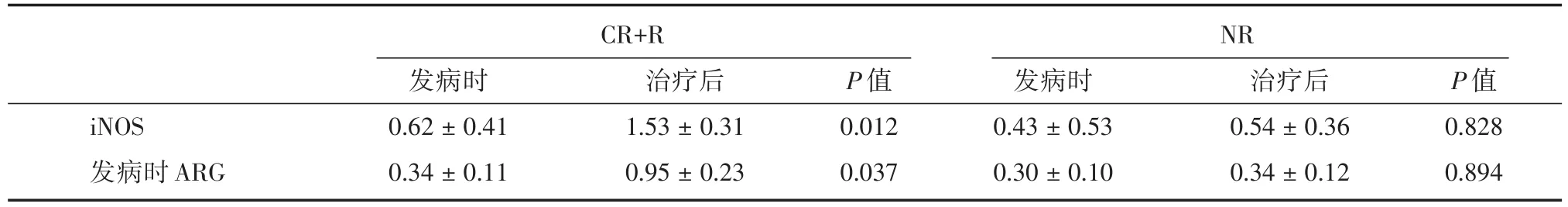
表5 研究组治疗前后外周血iNOS、ARG表达水平Tab.5 The expression of iNOS and ARG in peripheral blood before and after treatment in the study group ± s,mIU/mL
CR+R NR iNOS发病时ARG发病时0.62±0.41 0.34±0.11治疗后1.53±0.31 0.95±0.23 P值0.012 0.037发病时0.43±0.53 0.30±0.10治疗后0.54±0.36 0.34±0.12 P值0.828 0.894
3 讨论
ITP是一种自身免疫性疾病,现认为该病的发生主要是由免疫因素介导的巨核细胞成熟障碍与细胞毒性T细胞、自身抗体介导的PLT破坏所致[13]。但确切发病机制至今未得到阐明。ITP患者疗效相差甚远,有单用糖皮质激素可治愈的,有需要使用二线免疫抑制药物的,亦有多药耐药的难治性ITP。难治性ITP的治疗使得患者生存质量明显下降,甚至不亚于恶性肿瘤。因此,寻找治疗ITP的新靶点,一直是临床热门研究。
既往,MDSCs研究主要集中在实体肿瘤领域,其促进肿瘤免疫逃逸及其可能相关机制:(1)抑制T细胞的增殖能力[14-15]。(2)分化为2型巨噬细胞发挥免疫抑制作用[16]。(3)诱导Treg细胞的产生[17]。近年来,在血液系统疾病方面研究逐渐增多。体外实验表明,多发性骨髓瘤患者骨髓中的MDSCs可抑制T细胞活性,而正常人的MDSCs则未表现出相关免疫抑制活性[18]。GORGUN等[19]发现MDSCs对CD8+T细胞有较强的免疫抑制活性。在淋巴瘤小鼠模型中分离的MDSCs可影响CD8+T细胞增殖[20]。而在自身免疫性疾病方面,主要研究集中在动物模型上,部分研究表明MDSCs起保护性作用,部分研究表明其介导损伤作用。至于MDSCs在ITP患者发病的病理生理过程中起的什么作用,至今少有文献阐述。
文献报道[21],ITP患者体内MDSCs的数量及功能均被负向调控,大剂量地塞米松可以改变ITP患者体内MDSCs的功能。本研究通过检测ITP患者发病及治疗过程中的外周血MDSCs发现,ITP患者外周血中的MDSCs较健康者明显下降,与文献报道一致[21]。而治疗显效(CR+R)的患者体内MD⁃SCs、Treg细胞明显上升,提示MDSCs、Treg细胞可能参与改变ITP患者免疫失衡状态。进一步研究发现,治疗显效的患者体内iNOS、ARG表达水平高于发病时,提示MDSCs可能通过诱导iNOS活性的改变和干扰L-精氨酸代谢通路来实现其改变ITP患者免疫失衡状态。
综上,本研究表明,ITP患者外周血中的MDSCs较健康者明显下降。MDSCs、Treg细胞可能参与改变ITP患者免疫失衡状态,需要进一步实验证实。

