伴MLL基因异常白血病的检测及其临床意义
王振华 戢莉 王莉红 梁赜隐 刘微 许蔚林 孙玉华 欧晋平 邱志祥 岑溪南 董玉君 任汉云
北京大学第一医院(北京 100034)
混合谱系白血病(mixed lineage leukemia,MLL)基因位于人类染色体11q23,也被称为KMT2A、ALL⁃1或HRX等[1]。野生型MLL基因编码含3 972个氨基酸的蛋白,该蛋白与果蝇的trithorax(trx)具有同源性[2]。在急性白血病中,常发生11q23位点的断裂、易位、融合、重复、缺失等异常。在2001年的世界卫生组织(WHO)血液肿瘤分类标准中,将伴11q23/MLL异常的AML作为独立的一类白血病,最新版的WHO分类中属于“伴重现性基因异常的白血病”[3]。文献报道MLL相关急性白血病(AL)大约占了婴儿急性淋巴细胞白血病(ALL)的80%,以及幼儿急性髓细胞白血病(AML)的35%~50%,因此,婴幼儿成为11q23异常的第一个高发性群体[1,4]。这类异常的第二个高发性群体是药物(如拓扑异构酶抑制剂)治疗后所诱发的AML患者,即治疗诱导的 AML(t⁃AML)[5]。此外,散发MLL相关AL约占成人ALL的5%和成人AML的5%~10%[6]。因MLL相关伴侣基因非常复杂,采用检测方法的不同对检测结果影响很大。在本研究中,我们回顾性分析了2013年1月到2018年1月间我院血液科收治的初发急性白血病患者的临床资料,采用多重逆转录聚合酶链式反应(RT⁃PCR)的方法,检测出17例MLL相关白血病,并对其中资料完整的16例患者进行了随访和分析,从而探讨伴MLL基因异常白血病的临床特点及意义。
1 对象与方法
1.1 研究对象和资料获取研究对象为北京大学第一医院血液科2013年1月至2018年1月收治的所有初发急性白血病患者。所有患者均符合WHO 2001年急性白血病的诊断标准,且有完整的FAB分型及MICM分型资料。患者诊断和治疗信息均取自北京大学第一医院临床数据库。16例患者中,生存资料完整的共7例,其余采用门诊病例和电话随访。
1.2 MLL基因异常检测方法采用多重逆转录聚合酶链式反应(RT⁃PCR)的方法检测MLL基因异常。RT⁃PCR法采用上海源奇生物科技公司的试剂盒,可检测 MLL⁃AF9,MLL⁃AF6,MLL⁃AF4,MLL⁃AF10,MLL⁃MLL,MLL⁃ELL,MLL⁃ENL和MLL⁃SEPT6融合基因。
1.3 统计学方法采用SPSS 13.0软件进行分析。服从正态分布的计量资料,采用均数±标准差表示,非正态分布采用中位数(最小值,最大值)描述,组间比较采用非参数检验;计数资料采用百分率表示。OS等终点采用Kaplan⁃Meier进行描述。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者信息2013年1月到2018年1月间我院血液科收治的初发急性白血病患者223例(其中ALL 72例,AML 151例),采用RT⁃PCR的方法,检测出17例MLL相关白血病,并对其中资料完整的16患者进行了随访和分析。我们这组患者中,MLL相关白血病占ALL的4.2%,AML的8.6%。
16例患者的基本信息参见表1。其中男9例,女7例,年龄12~63岁,中位年龄32岁。疾病分类中ALL 3例,AML13例。AML患者的FAB分型结果如下:1例M1,2例M2,5例M4,4例M5,1例M6。
2.2 MLL基因异常的类型16例患者被检测出伴有MLL基因的融合,其中融合基因5例为MLL⁃AF4,2例MLL⁃AF6,3例MLL⁃AF9,1例MLL⁃AF6/AF10,2例 MLL⁃MLL,1例 MLL⁃ELL,1例 MLL⁃SEPT6。3例B⁃ALL患者全伴有MLL⁃AF4融合。16例患者的MLL异常,RT⁃PCR检出15例(15/16),另外一例FISH阳性,经转录组测序后发现为MLL⁃A9,因断裂点不同,导致常规的RT⁃PCR阴性。
2.3 临床治疗及结果16例伴MLL基因融合的患者均进行了化疗,常用诱导方案有DA(柔红霉素/去甲氧柔红霉素+阿糖胞苷),MA(米托蒽醌+阿糖胞苷),MAE(米托蒽醌+阿糖胞苷)等,2个疗程化疗后达到完全缓解7例,CR率仅为43.8%。
最终多次化疗后,11例患者达到CR并接受了异基因造血干细胞移植(Allo⁃HSCT)治疗,其中7例为单倍型移植,3例为同胞全合移植,另外1例为双份脐血移植。预处理方案为改良的Bu/Flu方案,其中1例加用了全身放疗(TBI)。10例骨髓和外周血移植回输的单个核细胞数量为(8.92±1.93)× 108/kg,CD34+细胞数为(6.79 ± 3.07)× 106/kg。WBC中位植活时间为12(10~ 22)d,1例患者血小板未植活,其余10例中位植活时间为16(7~67)d。急性移植物抗宿主病(aGVHD)的发生率为72.7%(8/11),大部分为Ⅰ度,Ⅱ~Ⅳ度GVHD发生率仅为18.2%(2/11)。
未进行HSCT的5例患者中,有4例患者持续未达缓解,最终因感染或出血死亡。11例移植患者中有5例移植后复发,包括1例中枢神经系统(CNS)白血病的复发,复发的患者均于复发后1~4个月内死亡。
2.4 患者随访16例患者均有随访资料。中位随访时间17个月(4~51个月)。随访期间9例患者死亡。未进行HSCT的5例患者中,有4例患者持续未达缓解,最终因感染或出血死亡。11例移植患者中有5例移植后复发,包括1例中枢神经系统(CNS)白血病的复发,复发的患者均于复发后1~4个月内死亡。
伴MLL融合基因的16例患者,生存分析结果见图1,显示这组患者的3年总生存率(OS)仅约40%,无进展生存率(PFS)约30%。

表1 16例MLL相关白血病患者临床信息Tab.1 Clinical information of 16 patients with MLL⁃related leukemia
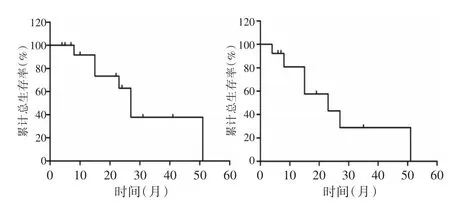
图1 16例MLL相关白血病患者的Kaplan⁃Meier生存曲线分析Fig.1 Kaplan⁃Meier survival curve analysis of 16 patients with MLL related leukemia
3 讨论
MLL基因异常白血病因对常规化疗不敏感,易复发,预后差,而备受关注。无论在儿童还是成人,ALL还是AML,MLL基因异常均是独立的预后危险因素。因此准确检测出MLL相关基因异常,进而针对性采取异基因移植等强化治疗措施,可能改善预后。
MLL相关基因异常非常复杂,已有报道的伴侣基因超过100种[7],因此导致临床上很容易漏诊。常用的MLL基因异常检测手段为RT⁃PCR和FISH。常规染色体核型分析敏感性差,价值不大;RT⁃PCR也有一定局限性:只能检出部分常见的MLL基因融合,同时因引物设计问题,对于一些少见或新型断裂点患者(如本文中例16),仍然会漏诊。本单位所用引物只能检出常见的几种MLL相关融合基因,其余少见类型不能检出。提示得出的MLL相关白血病占总AML(8.6%)和ALL(4.2%)的比例被低估。FISH检测MLL基因断裂有一定优势,其局限是不能鉴定具体的伴侣基因。因此,对于MLL基因异常白血病,最敏感的检测方式应该是转录组甚至全基因组测序。但因设备及数据分析等原因,该技术尚难以在临床普及,现阶段FISH和RT⁃PCR方法相结合,可能是比较理想的检测手段。
MLL相关白血病的治疗是目前血液学领域的难点之一。本组患者经2个疗程诱导化疗后达到完全缓解的只有7例,CR率仅43.8%,远远低于非MLL相关AML和ALL的缓解率。对于伴MLL异常的白血病患者,加大化疗剂量或增加疗程并不能有效地改善其生存,反而会增加化疗的毒性[6,8]。在本文中1例患者在进行9个疗程化疗后才达CR,1例患者在4个疗程化疗达CR后,MLL⁃AF4再次转为阳性,4例患者在化疗期间始终未达缓解。16例患者的生存分析结果显示,这组患者的3年总生存率(OS)仅约40%,无进展生存(PFS)率约30%。因病例数较少,生存分析结果价值有限,但仍可看出MLL相关白血病的不良预后。从而提示临床迫切需要开发靶向MLL相关基因的新型药物,目前已有相关新药基础研究取得进展的报道[9-11]。
异基因造血干细胞移植对于MLL相关白血病的治疗价值存在一定争议。本文中11例进行HSCT的患者,有5例移植后复发,其余6例在继续随访中。虽然本文病例数较少,随访时间也不够长,但超过50%的生存,提示异基因造血干细胞移植可能改善其预后,这也与国际上对于高危白血病治疗的共识一致[12-14]。当然也存在不同的观点,认为异基因移植并不能改善MLL相关白血病的预后[15]。需要进行多中心前瞻性随机对照试验来回答这一问题。

