两种新型功能化自组装多肽水凝胶的制备和体外研究
鲁长风,杨淑慧,王冲,杨轩,陈鹏,黄绍代,王玉,汪爱媛,林秋霞,许文静,卢世璧,彭江
自组装多肽(SAP)纳米纤维水凝胶近年来在组织工程和再生医学领域被广泛关注,并应用到脑、外周神经、心脏和骨的修复中[1]。分子的自组装是分子自发从无序变为有序的过程,依靠分子之间的电荷、氢键、离子键等非共价键作用力实现。RADA16-I[Ac(RADA)4CONH2]是一种合成的能自发组装的离子互补型短肽,由带正电精氨酸(R)、疏水丙氨酸(A)和带负电的天冬氨酸(D)交替周期性重复合成的,通过电荷的相互作用形成三维水凝胶,其含水量可达到 99% 以上[2]。RADA16-I水凝胶具有以下优点:成型方便;体内低细胞毒性、高生物相容性;纤维直径 7 ~ 10 nm,空隙直径 50 ~ 200 nm,类似天然细胞外基质,为细胞生长提供三维纳米结构环境;黏弹性好,与脑、脊髓和神经模量相接近[3-4]。研究表明,由 RADA16-I 制备的三维纳米纤维网络能够促进轴突生长和运动突触的形成,对于脑修复、轴突再生以及周围神经损伤后的功能恢复具有积极作用[5]。RADA16-I 可以通过固相合成法进一步用各种有生物活性的功能片段加以修饰,将 RADA16-I 作为小分子或蛋白质的载体,实现可控的分子释放。由于 RADA16-I溶液酸性很强,成胶之前 pH 为 3 ~ 4,直接接触可能会导致细胞毒性和炎症反应,因此植入体内之前需要将 pH 调到中性[6]。另外,RADA16-I 水凝胶中缺乏细胞外基质中的各种生长因子和活性蛋白,生物活性有限,对其进行改性,即接枝功能化片段合成功能化自组装多肽(fSAP),可以改善其强酸性的缺点,并且经过活性片段修饰的多肽分子自组装后,活性片段可以暴露在水凝胶的表面,赋予多肽材料一定的生物学活性,从而提高自组装多肽水凝胶的作用[7-8]。研究较多的活性片段包括层黏连蛋白来源的 IKVAV,脑源性神经营养因子(BDNF)来源的 RGI,血管内皮生长因子(VEGF)来源的 KLT,以及 BMHP1、BMHP2 等。
将功能化多肽分子 K LT 与同浓度的RADA16-I 水溶液等体积混合制备功能化自组装多肽水凝胶,在水凝胶上进行内皮细胞和平滑肌细胞的二维和三维培养,结果表明 KLT 多肽片段有利于内皮细胞和平滑肌细胞的生长、增殖和迁移,具有促血管生成的潜能[9]。将有生物活性的短肽片段 IKVAV(Ile-Lys-Val-Ala-Val)序列和 RGD(Arg-Gly-Asp)序列接枝到 RADA16-I 上,RGD序列与轴突生长高度相关,IKVAV 能选择性地促进神经元方向的分化和细胞黏附,而抑制胶质细胞方向的分化和黏附;将这两种功能化自组装多肽制备成混合的三维水凝胶,用于修复大鼠坐骨神经5 mm 缺损,结果表明,接枝功能化片段的水凝胶在促进轴突再生和雪旺细胞迁移上效果比单纯RADA16-I 水凝胶更好,证明了功能化自组装多肽纳米纤维水凝胶为周围神经再生提供了更好的微环境。
本文用模拟神经生长因子(NGF)和 BDNF 功能的多肽片段修饰 RADA16-I,得到功能化自组装多肽,该多肽能够在培养基环境中自组装成水凝胶,具有类似细胞外基质的微观形貌。将该水凝胶用于神经类细胞的培养,结果表明其具有良好的生物相容性,两者的协同作用能够明显促进轴突生长。

表 1 实验所用多肽Table 1 List of peptides
1 材料与方法
1.1 实验材料
1.1.1 实验动物及材料 SD 乳鼠由军事医学科学院试验动物中心提供;实验用自组装多肽均由上海强耀生物科技有限公司合成;离心管、培养瓶、24 孔培养板均购自美国 Corning 公司;细胞培养小室购自美国 Millipore 公司。
1.1.2 实验试剂 DMEM、胎牛血清 FBS 购自Gibco 公司;NB4 型胶原酶购自美国 Serna 公司;0.25% 胰蛋白酶购自美国 Sigma 公司;PBS、4%多聚甲醛、封闭山羊血清、Triton X-100 购自中国Solarbio 公司;小鼠来源 S100 单克隆抗体购自美国 Sigma 公司;山羊抗小鼠单克隆抗体 Alexa 488购自美国 Novus 公司;DAPI 染色液购自北京百奥莱博科技有限公司;罗丹明鬼笔环肽购自美国Cytoskeleton 公司。
1.1.3 细胞株及培养基 大鼠 PC12 细胞系购自北京天恩泽基因科技有限公司;RPMI1640 培养基购自美国 Invitrogen 公司;马血清、胎牛血清均购自美国 Gibco 公司;神经生长因子购自舒泰神(北京)制药有限公司。
1.1.4 实验仪器 Chirascan-plus 型圆二色光谱仪为英国 Applied Photophysis 公司产品;Dimension icon 原子力显微镜为德国 Bruker 公司产品;扫描电子显微镜(SEM)为德国 Zeiss 公司产品;LSM710 型共聚焦显微镜为德国 Leica 产品。
1.2 方法
1.2.1 自组装多肽水凝胶的制备 实验所用多肽及来源如表 1 所示,均由上海强耀生物科技有限公司使用多肽固相合成法合成,经过高效液相色谱法分析,纯度均大于 90%。将合成的多肽粉末以10 mg/ml 的浓度溶于超纯水中,用超声探针超声水溶液2 min,使粉末完全溶解。随后用一次性滤器进行过滤灭菌。将两种功能化多肽分别与 1% 的RADA16-I 溶液按照 1∶1 的体积比混合,得到RAD/RGI 和 RAD/CTD 溶液。将两种功能化多肽和 RADA16-I 按照 2∶1∶1 的体积比混合,得到RAD/CTD + RGI 溶液。
取出无菌培养容器放入 24 孔板中,向孔板中加入 DMEM 培养基将培养容器底部的膜润湿,然后小心地将 4 种自组装多肽溶液 RAD、RAD/CTD、RAD/RGI 和 RAD/CTD + RGI 分别加入到培养容器中,再加入 100 μl 培养基,放入37 ℃ 细胞培养箱中 30 min 后将孔板中培养基换成新的培养基,重复 3 ~ 4 次,孵育过夜。即可得到多肽水凝胶。
1.2.2 圆二色谱(CD)分析 将配制好的 1%RADA16-I、RAD/RGI、RAD/CTD 和 RAD/CTD +RGI 自组装多肽溶液用超纯水稀释 100 倍,各取200 μl 放入样品槽中,选择路径长度为 1 mm,波长范围 190 ~ 260 nm。
1.2.3 原子力显微镜(AFM)观察 将配制好的1% RADA16-I、RAD/RGI、RAD/CTD 和 RAD/CTD+ RGI 自组装多肽溶液用超纯水稀释 100 倍,各取 10 μl 稀释液滴加到新鲜的云母片上,然后用100 μl 超纯水冲洗。将云母片自然晾干后用原子力显微镜观察。
1.2.4 扫描电镜(SEM)观察 将制备好的自组装多肽水凝胶分别在 2.5% 的戊二醛溶液中固定过夜,采用乙醇梯度浓度(30%、50%、70%、80%、90%、95%、100%)逐级脱水,每个浓度 30 min。随后使用 CO2临界点干燥仪将脱水后的样品干燥。将干燥好的样品通过导电胶粘在样品台上,通过真空溅射的方法在样品表面均匀镀上一层金膜,采用 10 kV 电压对样品进行扫描电镜观察并记录。
1.2.5 雪旺细胞的三维培养 将出生 3 d 的 SD乳鼠处死,浸泡于医用酒精中消毒,随后在超净台中取出坐骨神经,剥除坐骨神经外膜,加入 1 ml NB4 型胶原酶,将神经剪碎,在 37 ℃ 恒温箱内磁力搅拌 10 min,使组织消化完全,加入 DMEM/F-12(10% FBS)终止消化,将细胞接种于培养瓶中,恒温箱中孵育 48 h。
种细胞前用 10%(W/V)的蔗糖溶液重悬雪旺细胞,将自组装多肽溶液与浓度为 20%(W/V)的蔗糖溶液以 2∶1 的比例混合均匀。迅速将 20 μl细胞悬液(500 000 个细胞)与 100 μl 含有蔗糖的自组装多肽溶液混合均匀,缓慢加入到 24 孔板中已润湿好的无菌培养容器中,并加入雪旺细胞所用的培养基使自组装多肽成凝胶。将孔板放入 37 ℃培养箱中 15 min,随后将孔板中的培养基换成新的,再次放入培养箱中,30 min 内置换 2 次,保证细胞处于合适的 pH 环境。培养 3 d 后,用 4%多聚甲醛固定 30 min,用 PBS 清洗 3 次,每次5 min,然后加入 0.3% Triton X-100 进行透膜处理 5 min,随后用 10% 山羊血清室温下封闭 1 h。PBS 清洗 3 次后加入小鼠来源 S100 单克隆抗体(1∶200)放于 4 ℃ 过夜,吸走一抗后 PBS 洗3 遍,加入山羊抗小鼠单克隆抗体 Alexa 488(1∶200)室温下孵育 1 h。PBS 清洗 3 遍后加入DAPI 染液对细胞核室温下染色 5 min。用激光共聚焦显微镜观察细胞情况。
1.2.6 水凝胶上 PC12 细胞的轴突生长 PC12细胞系在含有 10% 马血清和 5% 胎牛血清的RPMI1640 中培养。将 PC12 细胞以 2.5 × 104个细胞/水凝胶的密度接种在水凝胶 RAD、RAD/RGI、RAD/CTD 和 RAD/CTD + RGI 上,然后在含 5%CO2的环境中于 37 ℃ 孵育 48 h 使细胞黏附。然后用 PC12 分化培养基(RPMI1640、1% 马血清、50 ng/ml 神经生长因子)培养 3 d。之后,PC12细胞用罗丹明鬼笔环肽染色并通过共焦激光扫描显微镜成像。通过 Image Pro Plus 6.0 软件测量不同组中轴突生长的长度。
1.3 统计学处理
所得数据运用 SPSS 22 软件处理与分析,数据以±s表示,组间比较运用方差分析,两两比较运用 Student'st检验,以P< 0.05 为差异有统计学意义。
2 结果
2.1 自组装多肽水凝胶的表征
在缓冲液中多肽片段自组装形成柔软的不透明水凝胶,其中 β 折叠在自组装过程中起着重要作用。4 种自组装多肽均显示出典型的 β 折叠的色谱,在 195 nm 处有一个正峰,在 215 nm 处有一个负峰,如图 1 所示。功能化的自组装多肽与纯 RADA16-I 相比,表现出较小的峰,表明功能片段的加入降低了 β 折叠程度,原因是 RADA16-I是自组装的主要片段,单独的功能化片段不能自组装成水凝胶。
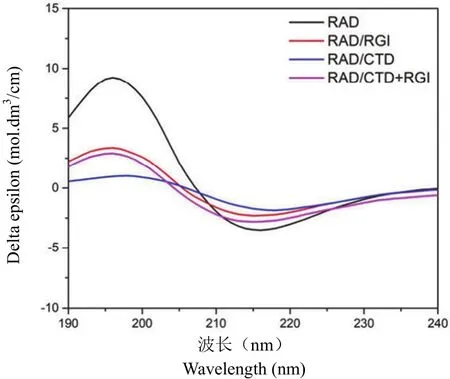
图 1 不同自组装多肽的圆二色谱Figure 1 CD spectra of different self-assembling peptide

图 2 扫描电镜观察自组装多肽水凝胶的微观形貌Figure 2 SEM microstructure of self-assembling peptide hydrogels
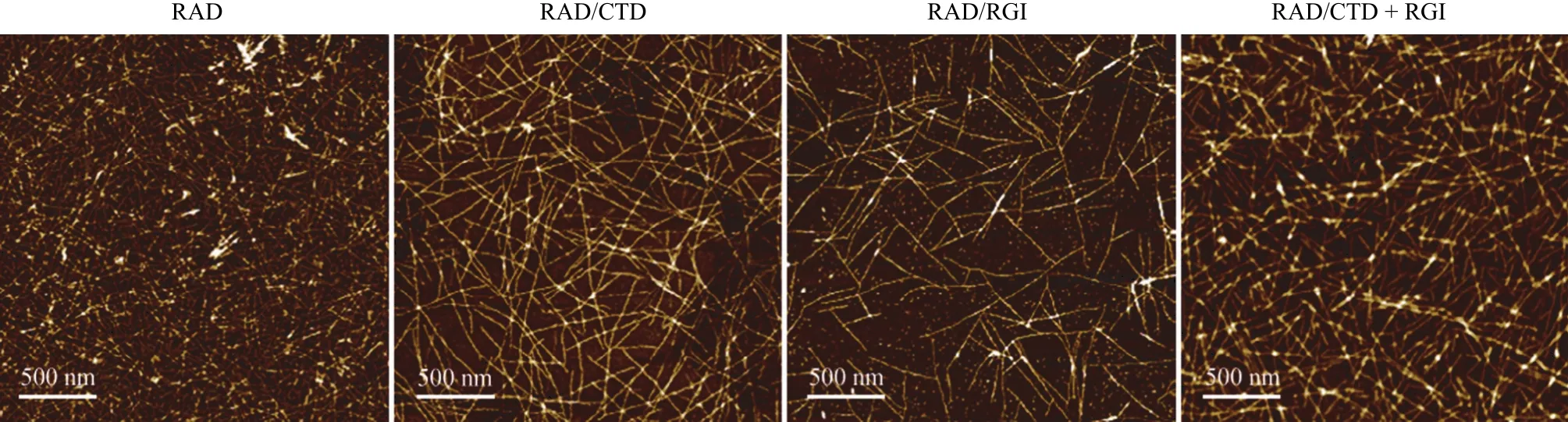
图 3 原子力显微镜观察自组装多肽的纤维形貌Figure 3 AFM microstructure of self-assembling peptide hydrogels

表 2 不同自组装多肽纤维直径Table 2 Diameters of SAP nanofibers
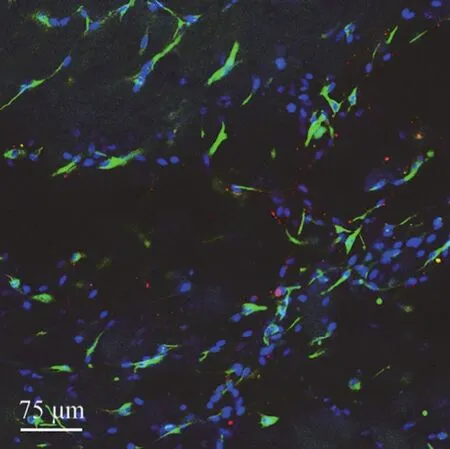
图 4 雪旺细胞在自组装多肽水凝胶中的三维培养Figure 4 SCs cultured on self-assembling peptide hydrogels
扫描电镜和原子力显微镜的结果表明,RADA16-I、RAD/RGI、RAD/CTD 和 RAD/CTD +RGI 4 种自组装多肽的宏观和微观结构没有明显差别,均形成纳米尺度的纤维,如图 2 和图 3 所示。由于不同自组装多肽的氨基酸数不同,因此自组装得到的纳米纤维的直径也不同,如表 2 所示。RADA16-I 多肽水凝胶的纤维直径最小,而RAD/CTD 的纤维直径最大,这与它们的氨基酸数一致。SEM 结果还表明,这种纳米纤维水凝胶具有类似细胞外基质的三维网络结构,其中孔的大小为 5 ~ 200 nm。
2.2 雪旺细胞在自组装多肽水凝胶上的生长
雪旺细胞与自组装多肽溶液混合,通过三维培养 3 d 后,细胞形态如图 4 所示。雪旺细胞在水凝胶中铺展良好,说明自组装多肽水凝胶对神经类细胞有良好的生物相容性,能够为神经类细胞提供适宜生长的环境。
2.3 自组装多肽水凝胶上 PC12 细胞轴突生长情况
PC12 在不同自组装多肽水凝胶上均有分化,图 5 结果表明,与其他组相比,RAD/CTD + RGI可以诱导轴突更快生长;此外,RAD/CTD 和RAD/RGI 组的平均轴突长度高于 RAD 组,说明功能化序列 CTDIKGKCTGACDGKQC 和RGIDKRHWNSQ 可以促进轴突生长。并且这两个功能片段的组合比单一组有更好的轴突生长,进一步证明了 CTDIKGKCTGACDGKQC 和RGIDKRHWNSQ 对神经生长的协同作用。
3 讨论
外周神经损伤修复中损伤神经再生微环境的构建十分重要,如果能为神经细胞和组织提供适宜生长的细胞外基质环境,就能够提高外周神经的修复速度。模拟细胞外基质环境是材料设计的关键[10]。本研究通过固相合成法将模拟神经因子 NGF 和BDNF 功能的多肽片段连接到 RADA16-I 自组装多肽上,并与 RADA16-I 混合,得到具有良好物理性能和生物相容性以及促神经功能的多肽水凝胶。该纳米纤维水凝胶的微观形貌与细胞外基质(ECM)相似,在体外与雪旺细胞和 PC12 细胞相容性良好,并且两种功能化多肽协同可以加速PC12 轴突快速生长。
在组织工程中,NGF 和 BDNF 被广泛用于神经修复,它们分别促进感觉和运动神经的修复。然而,应用外源性神经营养因子往往具有靶向性差、给药困难、因子半衰期短的问题。更重要的是,各种神经营养因子都有其自身的作用,在组织工程中添加多种生长因子是不现实的,这不仅会增加成本,而且会增加由于不适当的生长因子引起的癌症发病风险。而功能化的自组装多肽片段可以避免这些问题。首先,功能化片段在机制中具有可控的生物降解特征,随着多肽水凝胶的降解而逐步释放;其次,它们能发挥类似神经营养因子的功能,可以作为因子的有效替代物。因此,我们使用两种新型的功能化自组装多肽 CTD 和 RGI 分别模拟NGF 和 BDNF 的功能。
总之,我们通过向 RADA16-I 连接CTDIKGKCTGACDGKQC 和 RGIDKRHWNSQ(分别来自 NGF 和 BDNF)多肽片段合成功能化的自组装多肽水凝胶。通过多种表征方法证明该自组装多肽水凝胶具有类似细胞外基质的纳米纤维结构,与神经类细胞的生物相容性良好,并且两者的协同作用能够促进轴突快速生长。
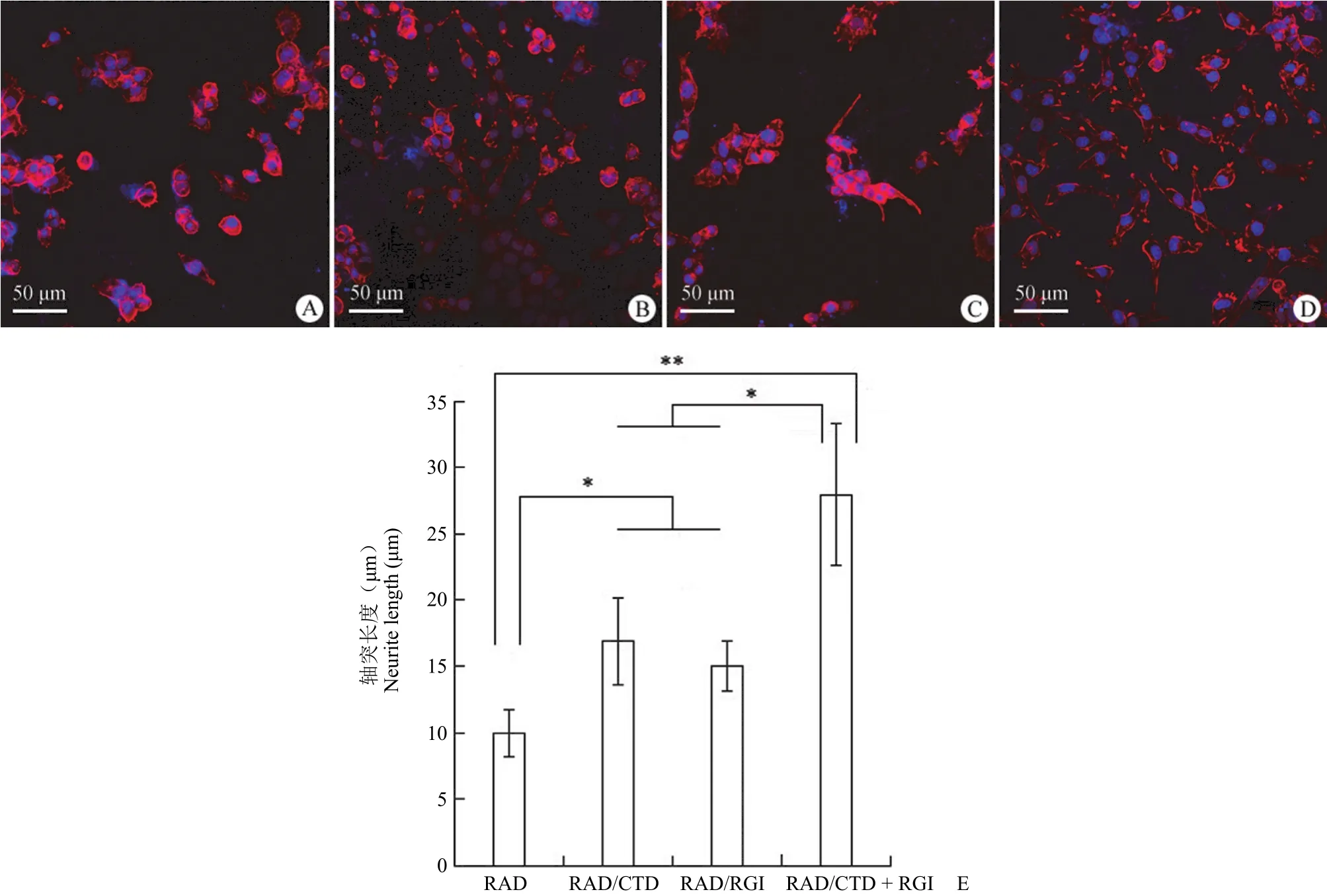
图 5 自组装多肽水凝胶 RAD(A)、RAD/CTD(B)、RAD/RGI(C)和 RAD/CTD + RGI(D)上 PC12 细胞分化情况和轴突长度统计(E)Figure 5 Neurite growth of PC12 cell on RAD (A), RAD/CTD (B), RAD/RGI (C) and RAD/CTD + RGI (D) hydrogels, the neurite length (E)

