激活的富血小板血浆促进Pellet 培养的脂肪间充质干细胞成软骨样分化
舒雄,杰永生,郑蕊,陈磊,靳少锋,綦惠,孙磊
关节软骨损伤是临床上的常见病,由于缺乏血供、淋巴和可迁移、增殖的未分化细胞,因而其自身修复与再生能力极为有限。临床上治疗关节软骨损伤的外科手术治疗方法包括:自体软骨移植、异体软骨移植、微骨折技术等[1-2],但这些都不同程度地存在着修复组织早期退变、供体来源受限、修复能力有限等问题,不能从根本上解决软骨损伤治疗的难题。目前,组织工程策略为软骨修复带来了新的希望。相比骨髓来源的间充质干细胞特性而言,脂肪组织来源的干细胞易于分离和大量获取,同时具有更好的分离重复性和更强的增殖能力,一直被认为是最适合临床应用的细胞[3-4]。富含血小板血浆(platelet-rich plasma,PRP)是一种来自全血的自体衍生物,是将新鲜血液离心、分离后获得的含有高浓度血小板的血浆,PRP 可被凝血酶或钙离子激活,激活后的 PRP 能大量释放多种不同的生长因子,其中包括:转化生长因子 β(TGF-β)、胰岛素样生长因子(IGF)、血小板衍生生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)和血管内皮生长因子(VEGF)等[5]。PRP 由于其来源丰富、制备简便、疗效显著且全面,在细胞生长分化和损伤组织的愈合中发挥重要作用。此外,先前软骨再生研究中表明,成纤维细胞生长因子-2(FGF-2)[6]、IGF-1[7]、TGF-β3[8]、骨形态发生蛋白-6(BMP-6)[9]等在间充质干细胞向软骨细胞分化中发挥重要作用。因此,近些年对 PRP 治疗关节软骨缺损的研究已经成为热点。另外,对于脂肪干细胞诱导分化成软骨细胞,合适的诱导培养体系也起到至关重要的作用。Pellet 培养体系作为无支架培养的代表,令长期培养中的软骨细胞保持较好生物学活性[10]。考虑到上述细节,本实验以人脂肪干细胞作为种子细胞,筛选不同比例激活 PRP 浓度比较成软骨效果的差异,探索是否有比激活 PRP诱导效果更好的培养体系,为下一步临床利用 PRP复合脂肪间充质干细胞修复软骨损伤提供相应的理论基础。
1 材料和方法
1.1 材料
1.1.1 主要试剂 人脂肪组织来源于北京知音创美医疗美容门诊部吸脂者,女性,抽吸部位为腹部,术后无菌保存。I 型胶原酶、胰酶、Trizol 试剂、高糖 DMEM、低糖 DMEM 和胎牛血清(FBS)购自美国 Gibco 公司;CaCl2溶液、阿利新蓝染料、番红 O 染料购自北京索莱宝生物科技有限公司;地塞米松、ITS+ 购自美国 Sigma 公司;TGF-β3 购自 Pepro Tech 公司;cDNA Synthesis SuperMix 和UltraSYBR Mixture 购自日本 Takara 公司;Sox-9、Gli-1 和 BMP-2 抗体购自美国 CST 公司;HRP-羊抗鼠 IgG 和 HRP-驴抗兔二抗购自 Jackson 公司;糖胺多糖(GAG)总含量二甲基亚甲基蓝比色法定量检测试剂盒购自上海杰美基因医药科技有限公司。
1.1.2 仪器 CO2细胞培养箱为美国 Shellab 公司产品;往复式真空泵为上海益化真空设备有限公司产品;倒置相差显微镜为日本 Olympus 公司产品;冷冻大容量离心机购自湖南湘仪离心机仪器有限公司;荧光定量 PCR 仪购自美国 Bio-Rad 公司;Nanodrop ND-2000 分光光度计购自美国Thermo Fisher 公司。
1.2 方法
1.2.1 hADSCs 的分离及培养 在无菌条件下取脂肪组织,将脂肪组织在 PBS 中清洗 3 次,彻底去除红细胞与脂肪组织碎片。按照课题组之前报道分离脂肪干细胞步骤进行[11],调整细胞密度接种于含 10% FBS 和 1% 的青、链霉素的低糖 DMEM培养基中,于 37 ℃、5% CO2培养箱中培养,至细胞增殖达到 80% ~ 90% 融合,取 P3代对数生长期细胞备用。
1.2.2 激活 PRP 制备和分离 预装有 5 ml 枸橼酸钠抗凝剂的 50 ml 一次性注射器经肘前静脉抽取志愿者血液 45 ml,温柔振荡,使血液与抗凝剂充分混匀,取 0.5 ml PRP 血小板计数。将剩余血液 4 ℃,1070 r/min 离心 20 min,离心后管内液体分为 3 层,上层血浆、中间为白膜层、下层为红细胞层。小心吸取上层血浆、中间层白膜及1 mm 红细胞层转至另一离心管内。再次将离心管置于离心机内,4 ℃,2130 r/min 离心 10 min,可见离心管上层为淡黄色透明血浆及贫血小板血浆(PPP),下层为灰白色血小板沉淀及少量红细胞沉淀,将全部液体上部 3/4 弃除,剩余部分吹打混匀,约为全血体积的 1/8。取 0.5 ml PRP 用于血小板计数。随后 10% CaCl2与 PRP 1∶9 的比例迅速混匀,37 ℃ 放置 1 h 后置于 4 ℃ 冰箱过夜。次日见大量淡黄色澄清液体析出,即为激活态PRP。将试管置于离心机内,4 ℃,5000 r/min 离心 30 min。将上清液小心分装至 0.5 ml EP 管内,若长期储存需置于 –80 ℃ 冰箱内。
1.2.3 激活的 PRP 对 hADSCs 增殖实验 将P3代 hADSCs 重悬计数,加入 96 孔板,每孔 5 ×103个细胞,贴壁后换液,分别加入 100 μl 的含5%、10% 和 15% PRP 的 DMEM/F12,对照组加入含 10% 的 FBS,分别按照所需的时间点观察。每孔加入 20 μl 的 MTT,孵育 4 h 后,加入 150 μl DMSO 终止反应,490 nm 测定吸收值。
1.2.4 Pellet 培养细胞微球 将 P3代 hADSCs重悬计数,在每个 15 ml 离心管中加入 2.5 × 105个细胞,300 ×g离心 5 min,分为 3 组:①对照组:2 ml 的高糖 DMEM 中加入 100 U/ml 青、链霉素、10% FBS。②激活 PRP 组:2 ml 的高糖 DMEM中加入 100 U/ml 青、链霉素、10% FBS 和 10%激活 PRP。③软骨诱导组:2 ml 完全软骨诱导培养基,其成分为:高糖 DMEM 中加入 100 U/ml青、链霉素、10% FBS、10 nmol/L 地塞米松、10 ng/ml TGF-β3、ITS+(含 6.25 μg/ml 胰岛素、6.25 μg/ml转铁蛋白、6.25 μg/ml 亚硒酸、5.33 μg/ml 亚油酸、1.25 mg/ml BSA)。24 h 后细胞聚集成球,每隔2 天全量换液,按照所需要时间培养后,收获细胞。
1.2.5 实时定量 PCR 检测基因表达 各组Pellet 培养细胞通过 Trizol 法提取总 RNA,根据试剂盒说明书进行逆转录和 real-time PCR 反应,反应条件:95 ℃,10 min;95 ℃,15 s;55 ℃,1 min,40 个循环;72 ℃ 延伸 1 min。检测相关目的基因,以 GAPDH 为内参基因,各引物序列见表 1,采用 ΔΔCt 法计算各组基因相对表达量。
1.2.6 组织学染色 各组 Pellet 培养细胞,PBS洗 1 次,4% 多聚甲醛 4 ℃ 固定过夜,脱水切片,分别进行阿利新蓝染色和苏木精-伊红染色,在倒置显微镜下观察。
1.2.7 糖胺多糖含量测定 将各组 Pellet 培养细胞留存的组织消化液 50 μl 加入 96 孔板,另外加入 200 μl 预先配置好的二甲基亚甲基蓝(DMMB)染色液。利用 DMMB 比色法测定糖胺多糖的含量,实验步骤依据 GENEMD 糖胺多糖总含量二甲基亚甲基蓝比色法定量检测试剂盒说明书进行。

表 1 PCR 引物序列Table 1 PCR primer sequence
1.2.8 Western blot 检测相关蛋白的表达 各组Pellet 培养通过 RIPA 裂解后,BCA 定量,经SDS-PAGE 凝胶电泳分离后,采用半干式电转移法将蛋白从凝胶转移到 PVDF 上。将 PVDF 膜在5% 的脱脂奶(溶于 PBS,pH 7.4)中,4 ℃ 封闭过夜,与 Gli-1、BMP-2 和 Sox-9 的一抗常温下孵育 1 h,TBST 洗膜 5 次后分别加入 HRP 驴抗兔 IgG 和 HRP 羊抗鼠 IgG(1∶1000)在常温下孵育 1 h。TBST 洗膜 5 次后,用 ECL 发光试剂盒显影和定影。
1.3 统计学处理
各组所得计量数据以±s表示,用 SPSS 10.0 进行统计学分析,两组间均数比较用t检验。检验水准 α = 0.05,P< 0.05 有统计学意义。
2 结果
2.1 激活的 PRP 有效促进 hADSCs 的增殖
为了评价激活不同比例 PRP 对 hADSCs 增殖能力的影响,采用 MTT 实验方法筛选合适的激活 PRP 比例。激活不同比例(5%、10% 和 15%)的 PRP 分别刺激已成功分离纯化和鉴定的hADSCs,在显微镜下观察,细胞呈多角形和斡旋状排列,而且与对照组形态十分相似(图 1A ~ D)。同时我们发现与对照组比较,3 d 后不同比例激活PRP 开始促进 hADSCs 的增殖,7 d 后不同比例激活 PRP 促 hADSCs 增殖具有显著差异。但是,10% PRP 与 15% PRP 之间差异不显著。因此,10% 激活的 PRP 对促进 hADSCs 的增殖促进最佳。
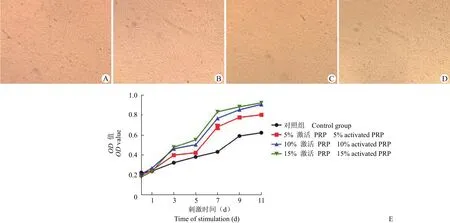
图 1 激活 PRP 刺激人脂肪干细胞增殖(A:5% PRP;B:10% PRP;C:15% PRP;D:对照组;E:不同比例激活 PRP 促进 hADSCs 增殖能力)Figure 1 Activated PRP increased hADSCs proliferation (A: 5% PRP; B: 10% PRP; C: 15% PRP; D: Control group; E: The proliferation ability of hADSCs by different proportions activated PRP)
2.2 激活 PRP 刺激 Pellet 培养 hADSCs 的组织学评价
激活 PRP 组和软骨诱导组分别在 Pellet 培养 21 d 后,发现激活 PRP 组与软骨诱导组刺激hADSCs 向软骨细胞分化的表达程度水平相似,同时诱导分化 hADSCs 的软骨特异性染色阿利新蓝呈阳性,证实其两组分化表达的细胞外基质蛋白聚糖表达呈阳性,但相比较而言软骨诱导组的阳性表达更强(图 2)。
2.3 荧光定量 PCR 检测激活 PRP 刺激 Pellet培养 hADSCs 的软骨相关基因表达
激活 PRP 组、软骨诱导组和对照组在 Pellet培养条件刺激后连续培养 21 d,real-time PCR 检测 3 组刺激 hADSCs 细胞团块中 Sox-9、Aggrecan 和 II 型胶原 mRNA 表达情况,发现软骨诱导组的 Sox-9、Aggrecan 和 II 型胶原 mRNA相对表达量显著高于激活 PRP 组,差异具有统计学意义(P< 0.05)(图 3A)。
2.4 DMMB 检测激活 PRP 刺激 Pellet 培养hADSCs 的 GAG 含量
按照 DMMB 比色法说明书测定 GAG 的含量,对照组、激活 PRP 组和软骨诱导组在 Pellet培养第 7 天、第 14 天和第 21 天 GAG 含量的表达。研究结果表明,第 7 天时,软骨诱导组 GAG含量高于激活 PRP 组,差异无统计学意义(P>0.05),第 14 天和第 21 天时,软骨诱导组 GAG含量显著高于激活 PRP 组,差异具有统计学意义(P< 0.05)(图 3B)。
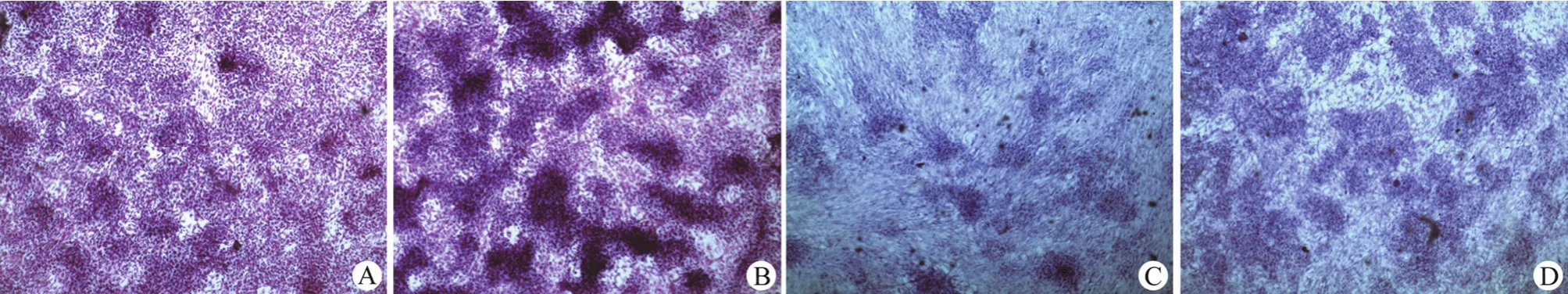
图 2 激活 PRP 和软骨诱导组 Pellet 培养 hADSCs 后组织学评价(× 40)(A:激活 PRP 组 H&E 染色;B:软骨诱导组 H&E 染色;C:激活 PRP 组阿利新蓝染色;D:软骨诱导组阿利新蓝染色)Figure 2 Histological evaluation of hADSCs after activated PRP and chondrogenic induction stimulation (× 40) (A: H&E staining of the activated PRP group; B: H&E staining of the chondrogenic induction group; C: Alcian blue staining of the activated PRP group; D: Alcian blue staining of the chondrogenic induction group)
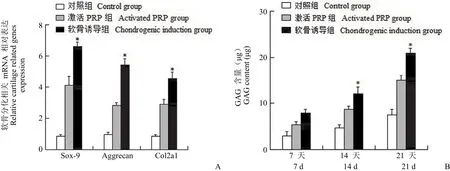
图 3 激活 PRP 和软骨诱导刺激 hADSCs 软骨特征的表现(A:Real-time PCR 测定各组软骨分化相关基因 mRNA 的含量;B:DMMB 比色法测定各组 GAG 含量;*P < 0.05)Figure 3 Activated PRP and chondrogenic induction stimulated hADSCs showed chondrogenic characteristics (A: Level of chondrogenic differentiation related genes mRNA in various groups by real-time PCR; B: Level of GAG in various groups by DMMB quantitative assay; *P < 0.05)
2.5 Western blot 检测激活 PRP 刺激 Pellet培养 hADSCs 中 Sox-9、Gli-1 和 BMP-2 蛋白表达
为了进一步探讨激活 PRP 刺激 Pellet 培养hADSCs 对 Hedgehog 信号转导通路与其他信号转导通路串话调控软骨细胞分化其相关信号通路的影响,对培养 P3代的 hADSCs 细胞,分为对照组和激活 PRP 组,10% PRP 在 Pellet 培养刺激21 d 后,Western blot 检测两组细胞中 Sox-9、Gli-1以及 BMP-2 蛋白的表达水平。结果显示,相比对照组,激活 PRP 组的 Gli-1 和 BMP-2 表达增强,而 Sox-9 蛋白表达水平相应增加(图 4)。说明激活 PRP 中的各种生长因子可通过激活 Hedgehog信号通路在 BMP 信号通路上游调控 hADSCs 成软骨分化,这证实 Hedgehog 通路与 BMP 通路在串话调控软骨形成中相互联系。

图 4 激活 PRP 刺激人脂肪干细胞对 Hedgehog 和 BMP信号通路的影响Figure 4 The effect of activated PRP on Hedgehog and BMP signaling pathway in hADSCs
3 讨论
关节表面覆盖一层透明软骨,对关节功能的发挥起着至关重要的作用。创伤、炎症、退行性改变等造成关节软骨缺损,如不及时治疗,通常会引起全骨关节炎,然而受损的关节软骨自身修复和再生能力差,如何对缺损的关节软骨进行修复,重建关节功能和防止关节退变,是在临床方面遇到的挑战。目前临床治疗骨关节炎主要采用对症治疗——关节腔冲洗、骨髓刺激和自体软骨移植,虽然取得了一定的疗效,但是上述方法均不能成功恢复正常的关节软骨面,也就不能确保其长期的功能恢复。
近年来,随着组织工程技术的发展,特别是以细胞治疗为主的组织工程技术,给软骨缺损的修复带来了新思路[12]。实践证明,由于自体软骨细胞移植有诸多限制,从而限制了临床应用,而来源于不同组织的间充质干细胞被用于组织工程修复的种子细胞,其中脂肪来源的间充质干细胞(ADSCs)因其来源广泛、在体内性能和含量稳定、对机体损伤很小、培养条件较简单、增殖能力较强等特点被广为关注。近年来多项实验显示 PRP 中富含高浓度的血小板,且含有多种生长因子,如 PDGF、TGF-β、IGF、表皮生长因子(EGF)和血管内皮生长因子(VEGF)等,这些生长因子参与肌腱、韧带等组织修复的关键过程,尤其是在关节软骨修复方面包括细胞增殖、趋化、迁移、分化和细胞外基质合成[13-15]。研究表明生长因子对组织工程化软骨的形成和软骨细胞增殖、胞外基质合成有着重要作用。
在本实验中,首先将分离的 hADSCs 培养到P3后,抽取 50 ml 健康人静脉血后用二次离心法制备出 PRP,加入氯化钙获得凝胶,离心得到激活 PRP 释放物,然后以激活 5% PRP、10% PRP、15% PRP 和 10% FBS 分别作为培养基,7 d 后发现,与激活 5% PRP 和 10% FBS 相比较,激活10% 和 15% PRP 对 hADSCs 的增殖具有显著效果,但是两者之间没有显著差异,故选定激活 10%PRP 作为 hADSCs 诱导分化培养的最佳比例。本实验研究中我们采用 Pellet 培养法,通过离心使细胞聚集成团,人为创造一个 3D 的培养环境,这样利于细胞外软骨基质形成。通过阿利新蓝和 H&E的染色,激活 PRP 组和软骨诱导组的染色显阳性,前者比后者阳性表达显低,进一步采用荧光定量PCR 检测其 Sox-9、Aggrecan 和 II 型胶原基因表达和 DMMB 法测定其 GAG 含量,发现与对照组比较,激活 PRP 组 GAG 含量相对偏低,分析发现对于潜在的临床应用,采用多次自体激活 PRP可以替代商业化软骨诱导剂,对保持软骨分化状态的维持更有利。最后我们研究激活 PRP 是如何调控 Sox-9 表达的机制促进 hADSCs 成软骨样分化,相比对照组来说,结果显示激活 PRP 的hADSCs 中 Gli-1 和 BMP-2 蛋白表述上调,进而促进 Sox-9 蛋白表达增强。该研究结果证明激活PRP 可以促进 Hedgehog 和 BMP 信号通路,增强Sox-9 基因的表达,维持脂肪干细胞分化而保持软骨化的表型。
研究结果提示激活 PRP 刺激 hADSCs 可以提高干细胞的软骨再生和降低经济成本。虽然在这项研究中探讨了 hADSCs 分离制备后诱导成软骨的临床前相关体外实验,但是,关节软骨的修复是一个包括生长因子参与的复杂网络调节过程,涉及细胞、胞外基质、生长因子、神经内分泌等,PRP 如何刺激 hADSCs 修复关节软骨的具体机制仍不清楚,需要进一步验证,同时,PRP 复合 hADSCs 在动物体内应用时间、频率、方法、最适浓度和关节局部环境等有待阐明。

