AMPKα2在高强度间歇运动激活小鼠骨骼肌细胞自噬过程中的作用
谢凌坚 张珊 刘素娟 傅力
天津医科大学基础医学院(天津 300070)
随着对运动改善机体代谢研究的不断深入,人们发现运动形式、频率、强度等是影响运动效果的重要因素。高强度间歇运动(high-intensity interval training,HIIT)作为一种省时高效的运动模式,逐渐受到人们的重视。HIIT是指短时间的间歇配合最大或接近于VO2max强度的运动训练[1]。有研究显示,与传统中等强度持续运动(moderate intensity continuous training,MICT)相比,HIIT表现出更为优越的减脂效应。不仅如此,HIIT对间接反映健康水平的体质指数(body mass index,BMI) 也有很好的控制效果[2]。
自噬是细胞内囊泡吞噬自身错误折叠蛋白或衰老细胞器,并与溶酶体融合形成自噬溶酶体以降解其内容物的细胞自我更新过程[3],细胞通过自噬调节细胞组分使其得到有序降解和更新[4,5]。自噬在疾病过程中被认为是对应激的适应性反应,通过自噬可增强细胞对应激的适应能力[6]。此外自噬还可为组织细胞快速提供燃料[7],在HIIT造成细胞能量迅速消耗时,骨骼肌细胞是否通过激活自噬应对“饥饿”状态,目前尚不清楚。研究发现AMPK(AMP activated protein kinase)在诱导细胞自噬过程中发挥着重要作用[22],而在HIIT影响骨骼肌细胞自噬过程中,AMPKα2(AMPK的催化亚基)在其中的作用如何目前未见报道。因此,本研究通过采用AMPKα2基因敲除小鼠并对小鼠进行6周HIIT干预,探讨在AMPKα2缺失的情况下,HIIT对小鼠代谢表型以及骨骼肌细胞自噬活性的影响,以期为揭示HIIT干预生物学效应的可能机制,以及AMPKα2在HIIT影响骨骼肌细胞自噬活性中的作用机制提供实验依据。
1 材料与方法
1.1 实验动物
AMPKα2基因敲除小鼠由法国国家卫生研究院Benoit Viollet博士提供,于天津医科大学实验动物中心饲养繁殖。取不同基因型 C57BL/6雄性小鼠共36只(4周龄),其中AMPKα2+/+,AMPKα2+/-,AMPKα2-/-各12只,期间小鼠自由进食、水,饲料为基础维持饲料(营养成分包含:水分≤8.0%,粗脂肪≥4.0%,粗纤维≤5.0%,粗蛋白≥18.0%)。
1.2 运动方案
小鼠经适应性喂养1周后,各基因型分别随机分为安静对照组(Control组)和高强度间歇运动组(HIIT组),每组6只。运动干预6周,强度为2分钟85%VO2max与1分钟50%VO2max(参照Fernando等制定的速度与最大摄氧量对应表)的跑台运动交替进行12个循环[8],1次/天、5次/周。实验过程中每周测量小鼠体重,6周运动干预结束后小鼠安静24小时后开始进行后续实验。
1.3 体成分检测
各组小鼠使用ImpediVET进行体成分分析,步骤如下:(1)使用异氟烷麻醉受试小鼠,使其四肢张开、鼠尾伸直,俯卧位置于实验台上,将插电极处皮肤经备皮处理;(2)按电极布置图将插入电极与导线相连接,测量中间两个电极间距离;(3)输入受试小鼠体重以及两电极间距等信息,最后点击“Measure”开始测量。测试完成后,ImpediVET软件将生成综合报告,记录小鼠的总体液量(total body water)、体质指数(BMI)、体脂含量(fat mass)等指标。
1.4 动物取材
不同组小鼠干预结束后,禁食12小时,采用眼内眦采血法收集小鼠血液样本,提取血清。随后迅速断颈处死,分离小鼠股四头肌,经液氮速冻后,转存于-80℃ 冰箱备用。
1.5 柠檬酸合酶(Citrate synthase,CCSS)活性检测
操作步骤如下:
(1)经液氮研磨的100 mg股四头肌组织放入预冷裂解液中充分混匀,13000 g离心10分钟,取上清,采用BCA法测蛋白浓度;

(3)200 μl CS待测液中各组分为:1)0.1 mM DTNB;2)10%Triton X-100;3)0.31 mM acetyl CoA;4)5 μg待测骨骼肌蛋白。
(4)加入10 μl 10 mM oxalacetate后将待测液放入30°C恒温分光光度计,测定412 nm波长处光密度值,持续3 min,每隔 20 s记录一次。
(5)酶活力单位是U/min/g,计算公式如下:

1.6 Western Blot法检测各组小鼠骨骼肌AMPKα2,pAMPK-Thr172,以及自噬相关蛋白LC3Ⅱ/Ⅰ,p62,Beclin1表达。
1.6.1 样品提取
(1)1%NP-40法提取股四头肌总蛋白,其中裂解液包含:1%NP-40+EDTA 15 mM(pH 8.0)+Na-Cl 150 mM+Tris 50 mM,充分混匀;(2)1×Phosphatase Inhibitor+1×Protease Inhibitor+400 μl裂解液/100 mg组织,电动匀浆;(3)低温离心机15000 g、4°C,离心20 min,回收上清,取上清液测定蛋白浓度。
1.6.2 SDS-PAGE凝胶电泳
制备5%积层胶,根据目的蛋白分子量,制备不同浓度分离胶,等量总蛋白加入样品孔,预染蛋白Marker 3 μl加入一侧加样孔。于凝胶电泳缓冲液(pH 7.6)内60 V电压电泳30分钟后,再转换成100 V电压继续电泳2小时。
1.6.3 电转印
采用湿法电转印法,转膜2小时(电流:300 mA)。根据预染蛋白Marker的转移情况,判断蛋白转移情况。
1.6.4 Western Blot
转膜结束→1×TBST洗涤PVDF膜(1次)→5%脱脂牛奶封闭(1小时)→1×TBST洗涤 PVDF膜(1次),5%BSA稀释一抗,具体比例见表1,4°C过夜孵育。次日,1×TBST洗膜(10分钟×3次)→二抗(5%BSA按照不同二抗说明书稀释)室温孵育(1小时)→1×TBST洗膜(10分钟×3次);ECL反应液做发光底物,暗室曝光(X光胶片)→显影→定影→观察、扫描、应用相关软件分析结果。
1.6.5 抗体稀释比例
1.7 数理统计处理
采用SPSS 13.0统计软件处理数据,计算均值和标准差(±s),单因素方差分析(One-way ANOVA)进行统计学分析,P<0.05为组间显著差异性标准。

表1 抗体稀释比例
2 实验结果
2.1 HIIT对各组小鼠体重增长的影响
本实验各组小鼠自4周龄起每周测量体重(body weight)并记录。小鼠体重变化情况如图1所示。在适应性喂养1周后和运动干预开始后第1周末,各基因型组小鼠与安静对照同基因型组小鼠相比体重无显著性差异(P>0.05)。但是,自HIIT干预第2周起,HIIT组各基因型与安静对照组相比体重开始下降,到6周运动干预结束后,HIIT组与安静对照组小鼠相比体重分别下降 9.62%(AMPKα2+/+),8.40%(AMPKα2+/-) 和3.53%(AMPKα2-/-),具显著性差异(P<0.05)。

图1 各组小鼠体重变化
2.2 HIIT对各组小鼠体成分的影响
6周运动干预后,对各组小鼠分别进行体成分分析,结果如表2所示。HIIT干预的野生型AMPKα2+/+和杂合子AMPKα2+/-组与安静对照Control组同基因型小鼠相比BMI值下降显著,分别下降了18.61%和20.35%(P<0.05);各组小鼠身体水分总量无显著性差异(P>0.05);HIIT干预的AMPKα2+/+和AMPKα2+/-组小鼠与Control组同基因型小鼠相比,体脂含量显著下降,分别下 降 了 48.96% (AMPKα2+/+) 和 34.05% (AMPKα 2+/-)(P<0.05)。但是,HIIT干预对AMPKα2-/-组小鼠BMI和体脂含量的影响无统计学显著意义(P>0.05)。

表2 各组小鼠体成分
2.3 HIIT对各组小鼠骨骼肌柠檬酸合酶的影响
柠檬酸合酶是组织细胞葡萄糖有氧氧化过程中三羧酸循环的关键限速酶,本研究检测HIIT干预后小鼠股四头肌组织CS活性,以评价运动干预效果。结果如图2所示,6周HIIT可显著增加AMPKα2+/+及AMPKα 2+/-组小鼠股四头肌CS活性(P<0.05);而在AMPKα2-/-小鼠股四头肌组织CS活性增加无显著性(P>0.05)。

图2 HIIT对各组小鼠骨骼肌柠檬酸合酶的影响
2.4 AMPKα2在HIIT影响骨骼肌自噬中的作用
为探究AMPKα2在其中发挥的作用,我们对三种基因型小鼠骨骼肌组织AMPKα2蛋白水平进行检测,结果如图3所示,基因敲除小鼠AMPKα2蛋白表达缺失,验证小鼠基因型准确无误。
为探究HIIT所造成的细胞能量应激能否对骨骼肌细胞自噬活性产生影响以及AMPKα2在其中的可能作用,我们对不同基因型小鼠股四头肌自噬相关蛋白进行检测,结果如图4所示,经过6周的HIIT后,AMPKα 2+/+和AMPKα2+/-组小鼠骨骼肌AMPK-Thr172位点磷酸化水平显著提高,自噬相关蛋白LC3Ⅱ/Ⅰ,Beclin1的表达显著增加(P<0.05),p62表达显著减少(P<0.05),提示HIIT能够促进AMPK-Thr172位点的磷酸化,进而提高骨骼肌细胞自噬水平。而AMPKα2-/-小鼠HIIT组与Control组相比,股四头肌LC3Ⅱ/Ⅰ,Beclin1和p62差异不具统计学意义(P>0.05)。
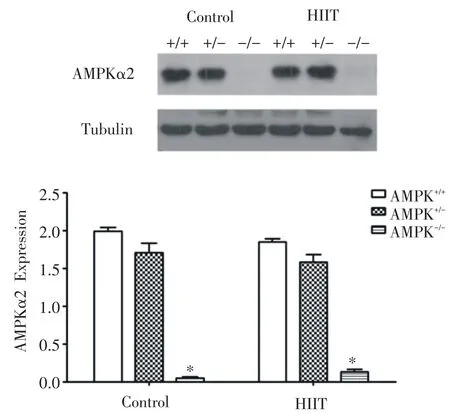
图3 Western blot检测各组小鼠AMPKα2表达量

图4 HIIT对各组小鼠骨骼肌自噬活性的影响
3 讨论
3.1 AMPKα2在HIIT控制体重和BMIBMI、改善体成分方面发挥重要作用
近年来随着HIIT在全民健身运动中的逐步应用,其在增强人体循环、呼吸、代谢功能方面的作用也日渐凸显。有研究发现,每周3次、持续3周的HIIT可显著降低青少年个体的体重、BMI,同时增加瘦体重[9]。此外,HIIT结合地中海饮食(素食为主,注重营养质量)能够显著改善肥胖患者身体组成和胰岛素敏感性[10]。因此,HIIT对改善机体代谢的调控机制急需进一步深入探讨。
AMPK是细胞能量代谢调节中的关键分子,也是糖尿病及其他代谢相关疾病研究的核心分子之一。AMPK由α (α1和α2),β(β1和β2)和γ(γ1,γ2,γ3)三种亚基构成的异源三聚体,α亚基N端含有一个典型的丝氨酸/苏氨酸激酶结构域,而苏氨酸172位点(Thr172)的磷酸化对于激活AMPK是必需的。不同亚基的各亚型具有组织分布特异性,在骨骼肌组织中以α2,β2和γ3亚型的表达为主[11]。在健康或糖尿病个体中,大于70%VO2max的运动可激活含α2催化亚基的AMPK复合体[12,13]。另有研究发现,激活AMPK可增加糖和脂质的利用[10],表明运动所激活的AMPK可能通过调控糖、脂代谢改善机体能量代谢。
研究显示,HIIT可有效增加AMPKα2磷酸化活性。Gibala等人发现HIIT能显著增加股外侧肌AMPKα2的mRNA水平,推测HIIT所引起AMPKα2的表达增加可能影响细胞线粒体生物合成、增加葡萄糖摄取利用和脂肪酸氧化等[14]。为揭示AMPKα2在HIIT改善机体代谢中的作用,本研究采用AMPKα2敲除小鼠为模型对其进行HIIT干预,通过与各基因型安静对照小鼠进行对比,探讨AMPKα2在其中的作用。本研究发现,尽管HIIT可控制AMPKα2-/-小鼠体重,但作用弱于其对野生型小鼠的效果,更值得注意的是,HIIT在控制AMPKα2-/-小鼠BMI、降低脂肪量方面,未表现出显著的统计学差异,提示AMPKα2在HIIT控制体重、降低BMI,改善体脂含量等重要健康指标方面发挥着重要作用。
3.2 AMPKα2在HIIT增加骨骼肌柠檬酸合酶活性过程中的作用
CS主要位于真核细胞线粒体基质[15],是能量产生代谢途径中的关键调节酶之一,其活性及表达量常被用作判定组织细胞氧化能力的重要指标[16]。本实验结果显示,6周HIIT干预显著增加了小鼠股四头肌组织CS活性,提示运动干预效果显著,骨骼肌有氧氧化能力显著增加。
骨骼肌作为机体糖和脂质有氧氧化的主要组织,在调节全身能量代谢过程中发挥着重要作用。大量研究表明,AMPK在调节机体运动能力、骨骼肌线粒体融合分裂和细胞葡萄糖摄取等方面发挥重要作用[17]。诸多研究发现,通过AICAR或其他细胞因子激活AMPK可显著增加骨骼肌脂肪酸氧化[18]。骨骼肌组织过表达AMPK可增加脂肪酸氧化,并防止高脂饮食诱导的骨骼肌脂质沉积[19]。以上研究表明骨骼肌AMPK在调节脂肪酸氧化中的重要作用。本研究也证实骨骼肌组织AMPKα2缺失,影响了三羧酸循环限速酶——CS的活性,推测AMPKα2在调控骨骼肌能量代谢中可能发挥着重要作用。
3.3 AMPKα2在HIIT影响骨骼肌细胞自噬中的作用
机体基础自噬水平随着衰老而逐渐减弱,导致清除错误折叠蛋白和衰老细胞器的效率降低[20,21],8周有氧运动干预可使老年小鼠骨骼肌组织Atg7,Beclin-1和LC3Ⅱ表达上调[21],提示有氧运动可增加老年小鼠骨骼肌基础自噬水平、改善衰老小鼠机体健康状态。另有研究发现,2小时低强度或高强度运动干预后,股外侧肌组织LC3Ⅱ,p62/SQSTM1的mRNA水平仅在高强度运动干预后显著增加,推测骨骼肌细胞自噬活性的增加与运动干预强度有关。不仅如此,Schwalm等人还发现,高强度运动后增加的自噬水平可能与AMPKα活性增加有关,其依据是高强度运动组比低强度运动组表现出更高的pAMPK-Thr172和pACC-Ser79磷酸化水平[22]。由此可见,HIIT可有效激活细胞自噬水平,提高机体对应激状态的适应能力。本研究也发现,6周HIIT能显著增加小鼠骨骼肌组织自噬相关蛋白表达、增强自噬活性,同时AMPK-Thr172位点磷酸化水平显著提高。但是,6周HIIT干预对AMPKα2基因敲除组小鼠骨骼肌自噬活性无明显增加效应,提示AMPKα2在HIIT激活自噬过程中可能发挥重要作用。
4 结论
高强度间歇运动可明显改善小鼠体成分、增强骨骼肌有氧代谢能力和自噬活性,AMPKα2在此过程中发挥着重要调节作用。

