牛乳粉中乳蛋白糖基化分析及其水解程度研究
孙静丽,杜瑶,朱莉莉,牛鹏飞,李林强
(陕西师范大学 食品工程与营养科学学院,陕西 西安, 710119)
糖蛋白是一种致敏因子[1-2],食用乳粉可能会因消化不良而引起过敏反应[3-4]。近年来食品资源中糖蛋白的来源及其致敏性一直是研究热点。1908年美国生物化学家协会的蛋白质命名协会将糖蛋白定义为:由蛋白质分子和包含有碳水化合物基团的物质共同组成的但又不是核酸的一类复合物[5]。糖蛋白具有增强免疫调节、抑制肿瘤、降血糖、降血脂、抗氧化、防衰老等十分重要的生理作用[6],在新型特种药物及功能性食品开发方面具有广阔的运用前景,但糖蛋白也可能会引起致敏作用[7-8]。对部分人群而言,饮用牛乳会引起过敏反应,乳中的主要过敏原为:α-乳白蛋白、β-乳球蛋白[9-10]、牛血清蛋白[11]和 γ-球蛋白[12],这些蛋白引起过敏反应是蛋白本身结构引起的过敏,还是由于加热过程中蛋白质发生糖基化后引起的过敏,相关的报道较少[13]。
牛乳中主要含有酪蛋白和乳清蛋白,同时含有丰富的乳糖,牛乳在热处理的过程中极易发生羰氨反应,产生糖基化蛋白,这些糖基化蛋白是否会影响乳蛋白的水解,进一步引起过敏反应,鲜有相关的研究报道。
本文主要研究分析牛乳粉中酪蛋白和乳清蛋白的糖基化程度及其水解特性,以分析牛乳粉中糖蛋白的来源及其水解特性,完善乳粉营养功能评价理论体系,并为乳粉生产过程中营养品质控制提供理论依据和技术参数。
1 材料与方法
1.1 材料与试剂
全脂牛乳粉,新西兰恒天然公司;蛋白Mark(18~90 ku,26~120 ku),美国Thermo公司;木瓜蛋白酶(≥3 500 U/mg),美国Bioreagent公司;双歧杆菌,北京川秀科技有限公司;三羟甲基氨基甲烷(Tris)、N,N,N,N-四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)、考马斯亮蓝G-250、高碘酸、碱性品红、α-萘酚、茚三酮,均为分析纯。
1.2 仪器与设备
800B台式离心机,上海安亭科学仪器厂;PowerPac TM Universal电泳系统,美国Bio-rad公司;KQ-250DB数控超声波清洗器,昆山市超声仪器有限公司;HY-2往复振荡器,金坛市富华仪器有限公司;722可见分光光度计,上海光谱仪器有限公司。
1.3 实验方法
1.3.1 酪蛋白的提取
乳粉经索氏抽提法脱脂后,与水以1∶7(g∶mL)的比例配制为复原乳。依次取复原乳5 mL,分别加入10 mL的pH 4.6的乙酸-乙酸钠缓冲溶液(盐析法)、pH 4.6的乙酸溶液(酸提法)、1 g/L鞣酸溶液(生物碱沉淀法)、无水乙醇(有机溶剂沉淀法)、50 g/L乙酸锌溶液(重金属离子法)[14-17],待蛋白沉淀后用滤纸过滤,将过滤所得沉淀放置40 ℃烘箱中烘干至其质量不再发生变化后进行称重,按下式计算酪蛋白的质量百分数。
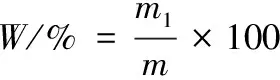
(1)
式中:W,酪蛋白质量分数,%;m1,沉淀的酪蛋白质量,g;m,每次所取的复原乳样液质量,g。
1.3.2 乳清蛋白的提取
1.3.2.1 酸提法和重金属离子法
依次取复原乳5 mL,分别加入10 mL pH 4.6乳酸溶液、50 g/L乙酸锌溶液,振荡混匀,待蛋白沉淀后过滤,取滤液于40 ℃烘箱中烘干浓缩使水分挥发,浓缩比为1∶10,将所得的浓缩后的滤液置于4 ℃冰箱中保存,所得即分别为酸提法、重金属离子法提取的乳清蛋白。
1.3.2.2 有机溶剂沉淀法
取5 mL的复原乳于离心管中,分别加无水乙醇至体积分数达20%,搅拌,静置30 min后过滤,所得滤液加无水乙醇,使无水乙醇体积分数达35%,继续添加无水乙醇直至乙醇体积分数逐渐达到55%,搅拌,静置30 min,200×g离心5 min,倾去上清液,取沉淀置于4 ℃冰箱中保存。
1.3.2.3 乳酸发酵法
取40 g乳粉索氏抽提脱脂,与水以1∶7(g∶mL)的比例配制为复原乳,加热至95 ℃,保持15 min,冷却至42 ℃,添加双歧杆菌1 g,42 ℃培养6 h,小心吸取上层黄绿色清液,离心沉淀,取清液于40 ℃浓缩至其体积的1/10,浓缩液置4 ℃冰箱中保存。
1.3.3 乳蛋白的SDS-PAGE分析
SDS-PAGE凝胶电泳参考文献[18-20],稍作修改。电泳样品制备:取制备的酪蛋白沉淀物用蒸馏水洗涤3次,200×g离心5 min,取沉淀于40 ℃烘干至恒重,研磨成粉末,取酪蛋白2 mg溶于1 mL样品缓冲液中,沸水浴处理10 min,冷却至室温,即为酪蛋白电泳样品;取制备的乳清蛋白2 mg溶于1 mL样品缓冲液中,即为乳清蛋白电泳样品。SDS-PAGE凝胶电泳:向凝胶板间灌注7 mL 15%的分离胶,立即覆一层蒸馏水,凝固40 min后将上层蒸馏水倾去用滤纸吸干,灌注3 mL 3%浓缩胶,插入样品梳子,凝固40 min后,将电极缓冲液倒入电泳槽,直至没过短板,拔梳子,加样12 μL,开始电泳。80 V恒压至蛋白染液进入分离胶,120 V恒压至蛋白染液停在分离胶底部,停止电泳。考马氏亮蓝G-250染液振荡染色2 h,蒸馏水冲洗,然后加入脱色液至背景透亮、条带清晰为止。
1.3.4 蛋白的糖基化鉴定
1.3.4.1 高碘酸-希夫碱染色
取制备的酪蛋白、乳清蛋白电泳样品左右对称加样进行SDS-PAGE电泳,将胶从中间均匀地切成两部分,左边考马氏蓝染色,右边对称样液进行高碘酸-希夫碱染色[21](简称糖染)。
高碘酸-希夫碱染色步骤:将凝胶置于10%三氯乙酸固定1 h,蒸馏水漂洗2次(共0.5 h),然后置于1%高碘酸水溶液氧化1 h,用水漂洗2次(共0.5 h),再用Schiff试剂染色1 h(Schiff试剂配制:碱性品红1 g溶于蒸馏水400 mL,加12 mol/L HCl 4.2 mL,加偏重亚硫酸钠3.2 g,4 ℃搅匀12 h,加活性炭2 g,振荡1 min过滤),最后用脱色液(0.5%的偏重亚硫酸钠及7%乙酸水溶液按体积比1∶1混合)脱色,4 ℃,若是糖蛋白则呈红色谱带。
1.3.4.2 莫氏试验
参考文献[22],修改如下:取3只试管编号,分别加入1 mL的10 g/L葡萄糖溶液、10 g/L酪蛋白溶液(溶于1 g/L的NaCl溶液中)、乳清蛋白,然后加入莫氏试剂(50 g/L的α-萘酚溶液,溶于体积分数95%的乙醇,现配现用)2滴,摇匀。将试管倾斜,沿管壁慢慢加入浓硫酸1.5 mL。硫酸层沉淀于试管底部与糖溶液分成两层,观察液面交界处有无紫红色环出现。
1.3.5 蛋白水解及氨基酸含量测定
1.3.5.1 蛋白水解
发酵法分别制取牛乳和乳粉的酪蛋白和乳清蛋白,并冷冻干燥成粉末,将蛋白分别配置为1 g/L的蛋白溶液(蛋白溶液溶于1 g/L的NaCl溶液中),各取10 mL,均加1 mL的1 g/L木瓜蛋白酶液,37 ℃恒温水浴酶解6 h。
1.3.5.2 氨基酸含量测定
采用茚三酮比色法[23-24]。取标准系列溶液(0.0、1.0、2.0、5.0、10、15、20 μg/mL)各1 mL于7支试管中,均加入2 mL pH 5.5的乙酸-乙酸钠缓冲液,摇匀,再加2 mL 2%茚三酮溶液(2 g溶于100 mL无水乙醇中,现配现用)。沸水浴15 min,冷却至室温后,于570 nm波长处测定吸光值,得回归方程(y=0.031 9x+0.002 5,R2=0.999 5)。将酶解后的样品用上述同种方法测定蛋白溶液的吸光值,计算其氨基酸含量。
1.4 数据处理
2 结果与分析
2.1 酪蛋白提取方法的筛选
由图1可知,鞣酸提取的酪蛋白质量百分数为(46.13±0.36)%显著高于其他组(p<0.05),乙酸提取的酪蛋白质量百分数显著高于乙酸锌、乙醇、乙酸-乙酸钠组(p<0.05),乙醇及乙酸-乙酸钠组对酪蛋白的提取质量百分数无显著性差异(p>0.05)。综上结果表明,鞣酸生物碱法是提取酪蛋白的一种较为理想的方法。文献[25-26]也有类似的报道。鞣酸是一种活性物质,具有抗氧化、抗衰老,预防心血管疾病等作用,具有凝乳的作用,因此鞣酸在乳蛋白的提取中有较大的应用前景。其他方法多为等电点提取法,其中,乙酸沉淀较好于其他几组,这与文献[27-28]乙酸沉淀效果好结果相似,但相对于生物碱沉淀法,提取效果显著低于鞣酸生物碱沉淀法(p<0.05),这可能是由于等电点法具有一定的可逆性。
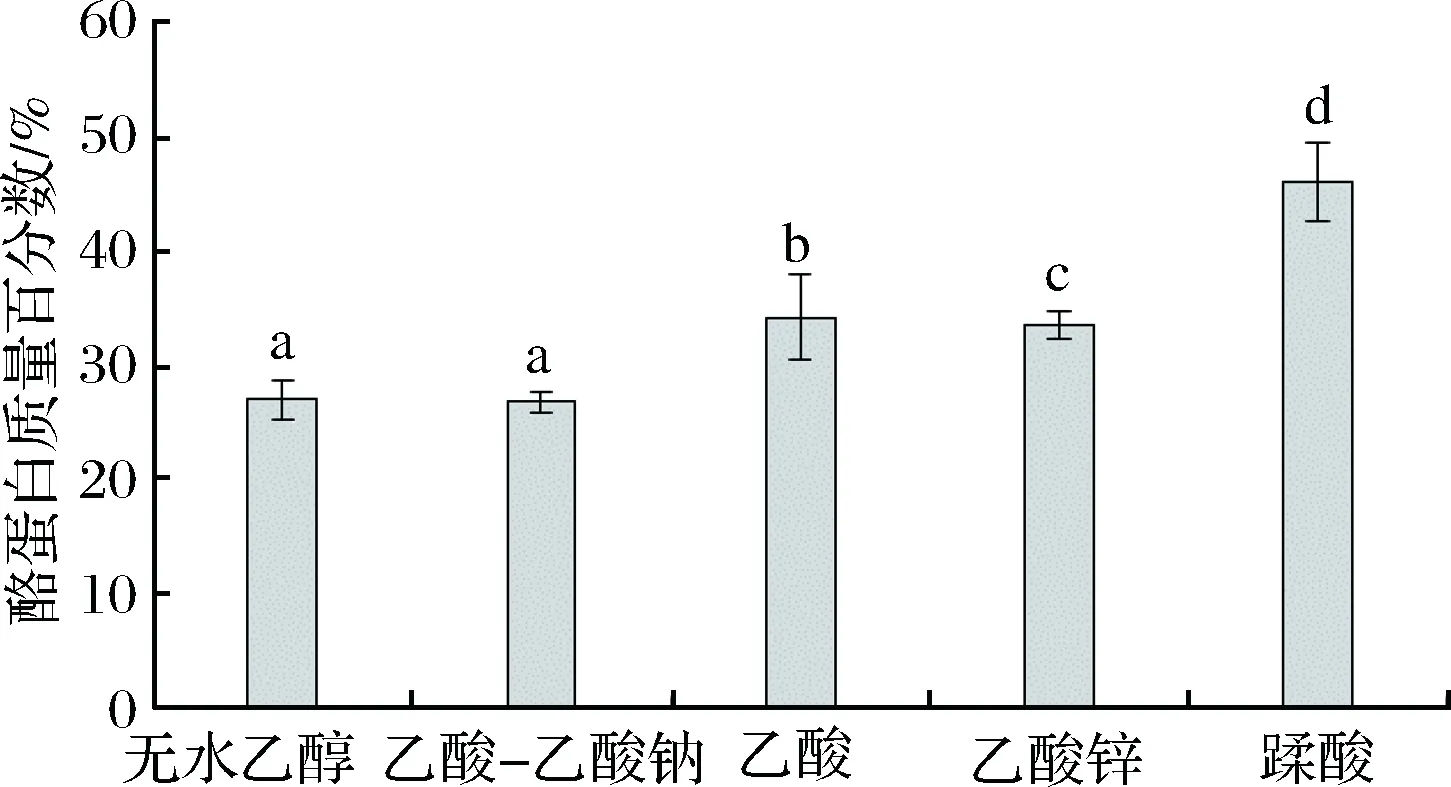
图1 不同方法对酪蛋白提取率的影响Fig.1 Influence of different methods on protein extraction rate注:不同小写字母表示差异显著(p<0.05)。
2.2 酪蛋白的SDS-PAGE电泳结果
由图2可知,不同方法提取的酪蛋白均有3条带,依据标准蛋白Mark条带比对,其分子质量分别约为24、34和60 ku,这与文献[29-30]对酪蛋白分子质量的研究结果一致。且不同方法提取的酪蛋白条带之间位置基本相同,表明不同方法处理对复原乳酪蛋白分子大小影响不大。
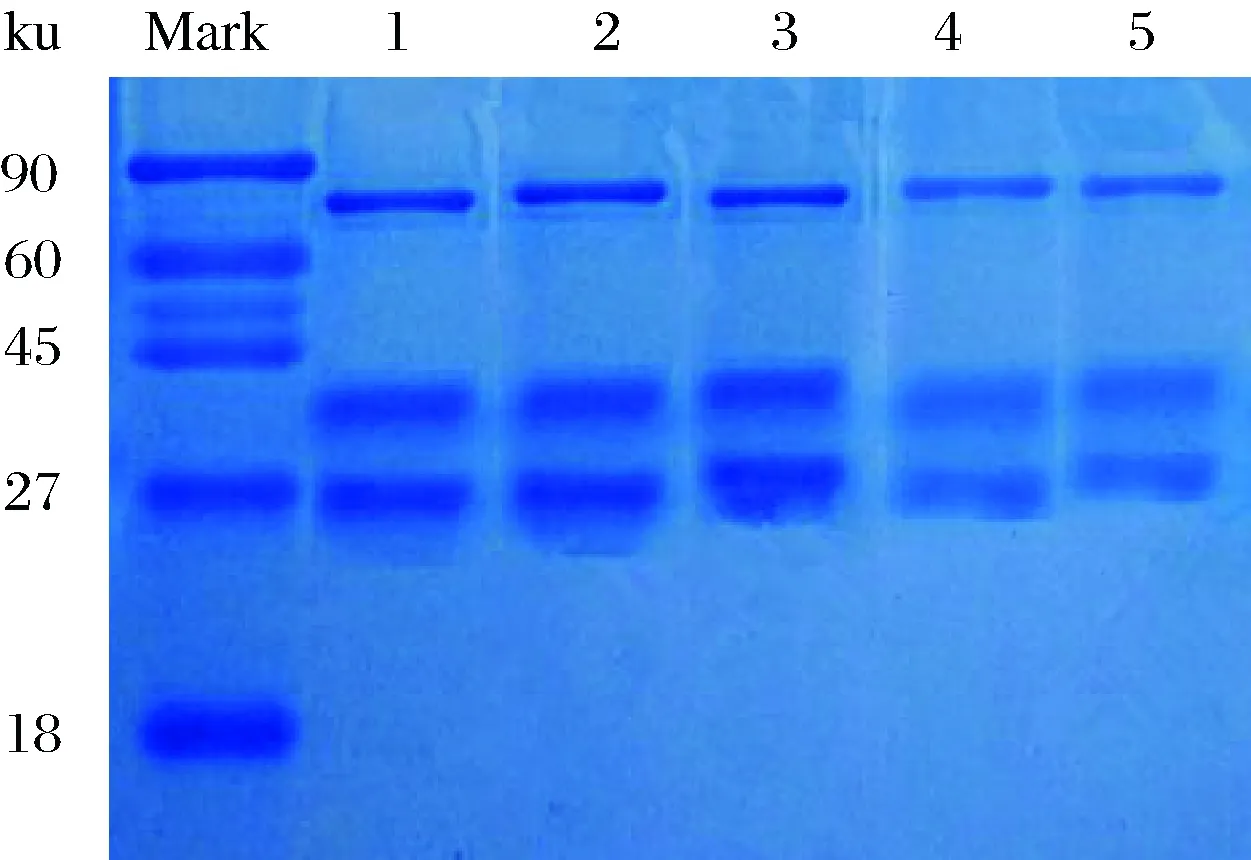
1~5.依次为乙酸-乙酸钠、无水乙醇、鞣酸、乙酸、乙酸锌提取的酪蛋白图2 不同方法提取的乳粉酪蛋白SDS-PAGE分析Fig.2 Analysis of SDS-PAGE on casein from milk powder treated by different extraction methods
2.3 乳清蛋白的SDS-PAGE电泳结果
不同方法(乳酸、乙酸锌、乙醇、发酵)提取的乳清蛋白的SDS-PAGE的结果(见图3)显示,仅有乳酸发酵法提取的乳清蛋白具有明晰的电泳条带,其分子质量分别约为14和18 ku,分别是α-乳白蛋白和β-乳球蛋白,这与文献[31]关于乳清蛋白分子质量的结果一致。

1~4. 依次为乳酸、乙酸锌、乙醇、发酵提取的乳清蛋白图3 不同方法提取的乳粉乳清蛋白SDS-PAGE分析Fig.3 Analysis of SDS-PAGE on whey protein from milk powder treated by different extraction methods
综上表明,酸提法、重金属离子法、乙醇沉淀法提取乳清蛋白效果不理想。酸提法可能使酪蛋白迅速达到了等电点、重金属离子法迅速使蛋白变形沉淀、乙醇沉淀法迅速破坏蛋白质外的水膜,以上沉淀法迅速形成网状进行聚沉,酪蛋白包埋了大部分的乳清蛋白,乳清蛋白无法析出[32]。文献[33-34]中采用了酸提法和乙醇沉淀法提取乳清蛋白,这与本文的结果有出入,具体原因还需进一步研究。而乳酸发酵法是一个蛋白缓慢凝聚,乳清逐渐释放的过程,这也印证了生产奶酪是生产乳清的一种常用的工业方法。
2.4 酪蛋白高碘酸-希夫碱染色结果
酪蛋白SDS-PAGE考马氏亮蓝染色和高碘酸-希夫碱染色结果见图4。考马氏亮蓝染色有3条带(图4-a),其分子质量分别约为24、34和60 ku。高碘酸-希夫碱染色有2条带(图4 b),其分子质量分别为24和34 ku,为糖基化酪蛋白。分子质量60 ku的酪蛋白不是糖基化蛋白,这与文献[35-36]中分子质量60 ku的蛋白在糖染结果中不出现条带的结果一致。
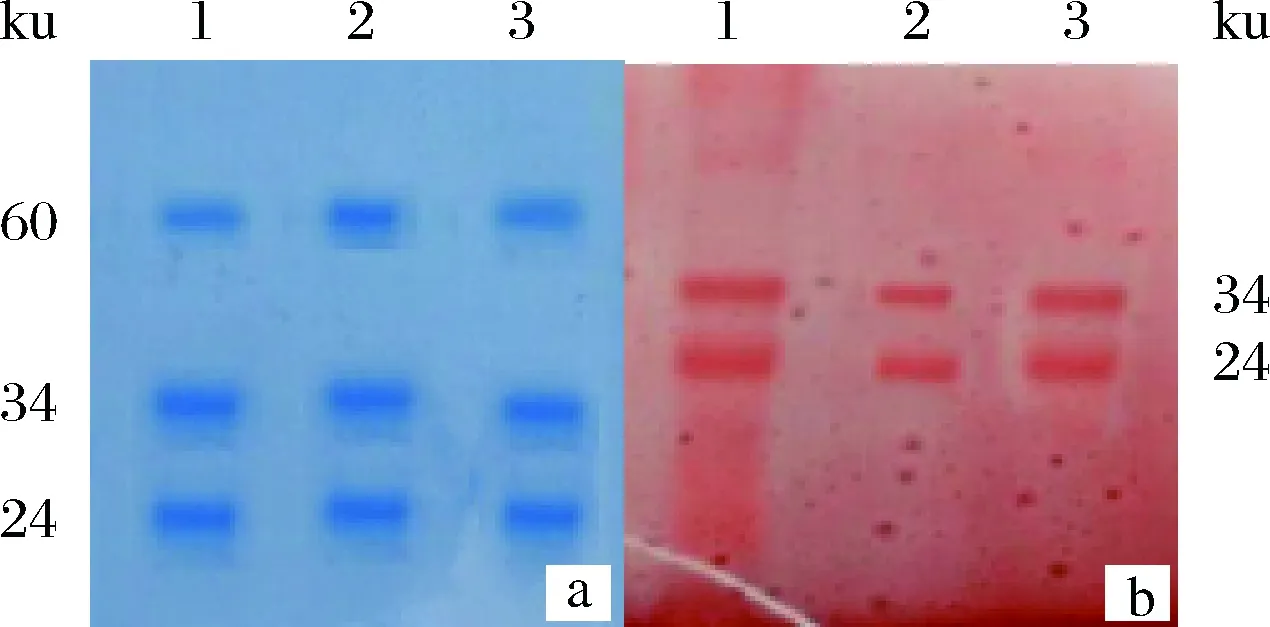
1~3-依次为乙酸、乙酸锌、乙醇提取的酪蛋白;a-考马氏亮蓝G-250染色;b-高碘酸—希夫碱染色图4 乳粉酪蛋白的不同染色方法SDS-PAGE分析Fig.4 Analysis of SDS-PAGE on casein from milk powder treated by different dyeing methods
2.5 乳清蛋白高碘酸-希夫碱染色结果
由图5可见,泳道1、2在考马氏亮蓝G-250染色的条带中,共有2条带,经过与标准蛋白Mark比对,其分子质量约为14和18 ku。在高碘酸-希夫碱条带中则只有分子质量为14 ku的蛋白,则可说明在牛乳粉乳清蛋白中分子质量14 ku的蛋白是糖基化蛋白,分子质量18 ku的蛋白不是糖基化蛋白。
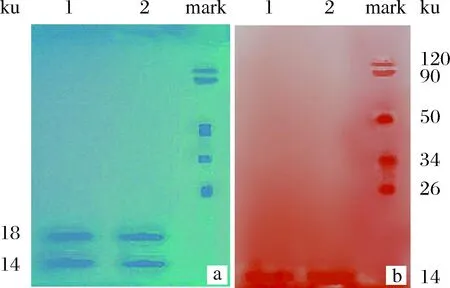
a-考马氏考马氏亮蓝G-250染色(蓝色);b-高碘酸—希夫碱染色(红色);1~2-均为发酵法提取的乳清蛋白图5 乳粉乳清蛋白的不同染色方法SDS-PAGE分析Fig.5 Analysis of SDS-PAGE on whey protein from milk powder treated by different dyeing methods
2.6 蛋白的莫氏试验鉴定结果
葡萄糖标准溶液莫氏试验有很明显的紫色环(图6-a),酪蛋白莫氏试验中,糖液与硫酸交界处呈淡淡的紫环(图6-b);乳清蛋白莫氏试验也呈现明显的紫色环(图6-c)。结果表明,酪蛋白及乳清蛋白中都含有糖蛋白,这与上文中电泳的糖染的结果保持一致,进一步证实牛乳粉中存在糖基化的酪蛋白与乳清蛋白。

a-葡萄糖标准溶液;b-酪蛋白;c-乳清蛋白图6 乳清蛋白和酪蛋白莫氏试验颜色比较Fig.6 Comparison on color of whey protein and casein treated by morse experiment
2.7 乳蛋白水解程度比较
由图7可见,乳粉酪蛋白和乳清蛋白木瓜蛋白酶水解后游离氨基酸含量均显著低于鲜乳酪蛋白和乳清蛋白(p<0.05),说明牛乳经过一系列单元热处理后乳蛋白水解程度降低。
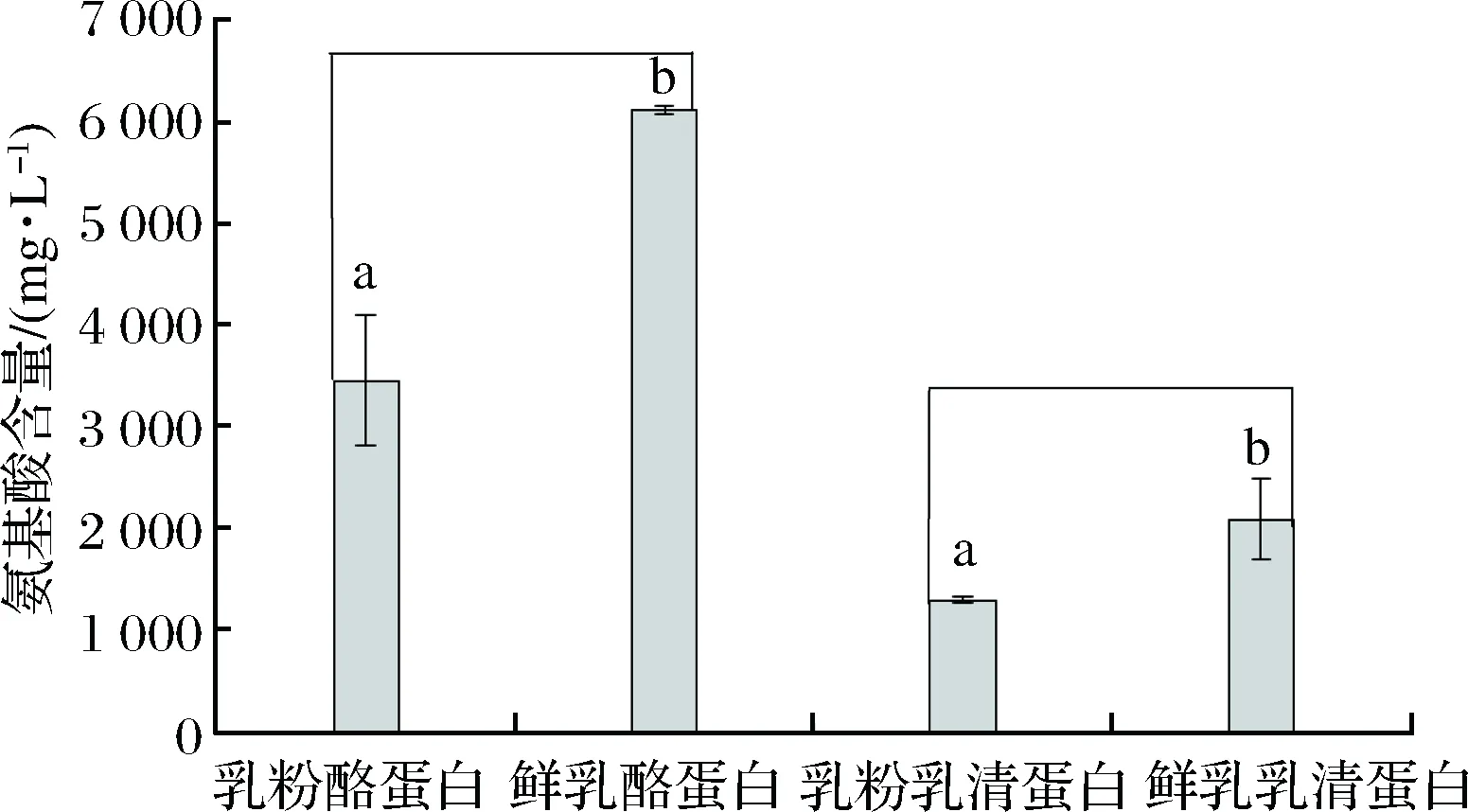
图7 乳粉与鲜乳中乳蛋白水解程度比较Fig.7 Comparison of degree of hydrolysis by papain between milk powder and fresh milk注:不同小写字母表示差异显著(p<0.05)。
本文酪蛋白SDS-PAGE分析结果表明,其主要有分子质量约为24、34和60 ku的3种蛋白,其中,前2种均为糖基化蛋白,文献[37]报道,它们分别占牛乳总蛋白的40.8%和28%,是酪蛋白的主要组成部分,文献[38]中报道糖基化改变蛋白的化学稳定性和热稳定性,进而可能影响蛋白的水解,这与本文的结果相近,显然糖基化的酪蛋白是影响酪蛋白水解程度的主要因素之一。
本研究结果表明,乳清蛋白主要含有分子质量为14 和18 ku的2种蛋白,其中14 ku的乳清蛋白为糖基化蛋白,其在牛乳总蛋白含量为3.7%[32]。文献[39-40]报道α-乳白蛋白为牛乳中主要过敏原之一,显然其水解程度是导致其致敏性的主要原因。综上所述,乳蛋白糖基化对其水解程度有一定影响,文献[37]称,加热导致牛乳蛋白的二、三级结构受到破坏,导致牛乳不好溶解,并未与蛋白的水解程度有直接关系。因此水解程度可能是由于蛋白糖基化引起的,但是这些糖基化乳蛋白是乳在加热过程产生的还是牛乳本身固有的,还有待进一步研究。另外,若针对乳粉产品中具有致敏性的糖蛋白加入其专一性的水解酶,可能是降低或消除某些糖蛋白致敏性的一条有效途径。
3 结论
本文分析了牛乳粉中酪蛋白和乳清蛋白的糖基化及其水解特性,结果表明牛乳粉中分子质量为24和34 ku的酪蛋白和分子质量14 ku的乳清蛋白为糖基化蛋白。蛋白酶水解试验结果表明,牛乳粉中酪蛋白和乳清蛋白水解程度均显著低于鲜乳,这是由于加热后蛋白空间结构的变化所致还是由于蛋白糖基化引起的,有待进一步研究。

