诺邓火腿抗氧化肽的分离纯化与鉴定
吴宝森,王桂瑛*,谷大海,程志斌,王雪峰,徐志强,范江平,普岳红,廖国周*
1 (云南农业大学 食品科学技术学院,云南 昆明, 650201) 2(云南农业大学,云南省畜产品加工工程技术研究中心,云南 昆明, 650201)
诺邓火腿是云南的名特产,因配料独特,制作精细,质优而味美,切口肉色嫩红,具有浓郁的乡土风味和白族腊制品的风格而闻名。诺邓火腿中的蛋白质在发酵过程中受组织内源性酶和微生物酶的作用,降解产生小分子肽类,研究发现发酵肉制品中蛋白质降解生成的多肽具有抗氧化活性[1]。天然抗氧化肽具有清除重金属,降低细胞自氧化速率,防止脂肪过氧化,减少自由基的生成等作用[2]。目前对诺邓火腿抗氧化肽的研究很少,对抗氧化肽的分离纯化与鉴定尚无报道。
本试验通过提取诺邓火腿抗氧化肽,经Sephadex G-25凝胶色谱和Sephadex G-15凝胶色谱对诺邓火腿抗氧化肽进行分离纯化,通过多种体外抗氧化试验(清除·OH、清除DPPH自由基、螯合Fe2+)研究其抗氧化活性,最后对抗氧化活性最强的诺邓火腿抗氧化肽使用MALDI-TOF-MS进行测序鉴定。
1 材料与方法
1.1 材料
以8条诺邓当地黑毛土猪的后腿(日龄相似、腿重相近)为原料,按传统加工工艺加工诺邓火腿,在云南省大理白族自治州云龙县诺邓火腿食品厂进行加工,加工时长2年,加工时间:2013年12月至2015年12月。随机选取5条诺邓火腿,并取股二头肌肉样,真空包装,置于-80 ℃冰箱保存。
1.2 设备
冷冻离心机(湖南可成仪器设备有限公司;H2-16KR);高速离心机(Thermo Scientific,Pico 17 Centrifuge);匀浆机(德国IKA,T25);冷冻干燥机(Hanil,Cleanvac8);紫外分光光度计(北京谱析通用仪器有限责任公司,TU-1950);磁力搅拌器(江苏金坛医疗仪器厂,HJ-3);自动部分收集器(上海青浦沪西仪器厂,BSZ-100);恒流泵(上海青浦沪西仪器厂,HL-2);移液器(吉尔森,Eppendorf);质谱(AB SCIEX,MALDI-TOF4800);液相(Thermo Scientific,Ultimate 3000);NanoDrop(Thermo Scientific,2000C)。
1.3 实验方法
1.3.1 诺邓火腿抗氧化肽的提取及多肽含量测定
参考ZHU等[3]的方法,适当调整;取诺邓火腿股二头肌部位肉样,去除瘦肉中肌腱及肌膜,切碎斩匀后称取30 g,加入100 mL磷酸盐缓冲液( 0.2 mol/L,pH 7.2) ;冰浴匀浆3次,转速24 000 r/min,每次10 s,中间间歇10 s。匀浆液于4 ℃下静置2 h后,4 ℃、10 000 r/min冷冻离心10 min;取上清液,用纱布过滤掉上浮的油脂,再加入3倍体积的体积分数40%的乙醇,4 ℃下静置12 h后,4 ℃、10 000 r/min离心10 min。然后取上清液置100 Da透析袋中,在4 ℃环境中,置于磁力搅拌器上,透析4 h,去除小分子物质。最后冷冻干燥,即为诺邓火腿抗氧化肽粗肽粉,-80 ℃冰箱中保存备用。
多肽含量的测定:参考CHURCH等[4]的方法,稍作调整。邻苯二甲醛混合试剂的配制:取40 mg邻苯二甲醛溶解于1 mL甲醇中,依次加入25 mL四硼酸钠溶液(0.1 mol/L) 、2.5 mL SDS(质量分数20%) 和100 μL β-巯基乙醇,最后用去离子水将溶液定容至50 mL;为保证试验数据准确性,试剂现用现配。取100 μL的粗肽溶液(1 mg/mL)与2.0 mL邻苯二甲醛混合试剂,混匀,室温下孵育2 min。测定反应液在340 nm波长处的吸光值。用胰酪蛋白胨作为标准蛋白配制梯度溶液,制定标准曲线,换算诺邓火腿粗肽粉中的多肽含量。
1.3.2 诺邓火腿抗氧化肽的抗氧化活性测定
诺邓火腿抗氧化肽·OH清除率测定:根据LI等[5]的方法,将抗氧化肽配成质量浓度为1.0 mg/mL溶液。样品管:取0.6 mL邻二氮菲溶液(5 mmol/L)加入0.4 mL磷酸盐缓冲液(0.2 mol/L、pH 7.2)混匀后,加0.6 mL样品溶液及0.6 mL EDTA(15 mmol/L),再次混匀,之后加入0.6 mL FeSO4溶液(5 mmol/L),充分混匀后加入0.8 mL H2O2(0.1%),摇匀后于37 ℃保温1 h,测536 nm波长处吸光度记A样品;损伤管:去离子水代替样品,其余步骤同样品管,测吸光度计记A损伤;未损伤管:分别以去离子水代替样品和H2O2,其余步骤同样品管,测吸光度计记A未损伤。同时配制相同浓度的谷胱甘肽溶液,相同操作下测定GSH清除·OH的效果。·OH清除率计算:
(1)
诺邓火腿抗氧化肽对DPPH自由基清除率测定:参考WU等[6]的方法,将诺邓火腿抗氧化肽配成质量浓度为1.0 mg/mL的溶液。将2 mL DPPH自由基溶液(0.2 mmol/L,溶于体积分数95%乙醇)置于试管中,加入2 mL样品溶液,振荡混匀,室温避光放置30 min后,在517 nm波长处测样品的吸光度,以2 mL 95%乙醇加入2 mL样品为空白,2 mL DPPH自由基溶液加上2 mL 95%乙醇为对照组测的吸光度为A对照组。同时配制相同浓度的谷胱甘肽溶液,相同操作下测定GSH清除DPPH自由基的效果。DPPH自由基的清除能力计算:
(2)
诺邓火腿抗氧化肽螯合Fe2+能力的测定:根据LEE等[7]的方法,将诺邓火腿抗氧化肽配成质量浓度为1.0 mg/mL的溶液。分别取1 mL样品溶液于试管中,加入0.05 mL FeCl2(2 mmol/L),混匀后加入0.2 mL菲啰嗪 (5 mmol/L)试剂启动反应,将混合物剧烈摇动混匀后,室温下静置10 min,在562 nm波长处测定溶液的吸光度。相同操作条件下,对照管以去离子水代替样品测得吸光度记A对照组。同时配制相同浓度的谷胱甘肽溶液,相同操作下测定GSH螯合Fe2+的效果。Fe2+螯合率计算方法:

(3)
1.3.3 通过SephadexG-25分离纯化诺邓火腿抗氧化肽
分离纯化条件:选择26 mm×1 m层析柱,诺邓火腿粗肽配制成20 mg/mL溶液,过滤,上样量5 mL,蒸馏水经过45 nm过滤后作洗脱液进行洗脱,调节流速0.5 mL/min,每管收集5 mL洗脱液,保持4 ℃环境下。各管在220 nm处测定吸光值,以洗脱体积为横坐标,吸光值为纵坐标作图。分别收集各峰处的洗脱液,既得诺邓火腿抗氧化肽的各组分,记A、B、C、D,冷冻干燥,置-80 ℃保存。
1.3.4 诺邓火腿抗氧化肽各组分抗氧化活性研究
方法同1.3.2。
1.3.5 通过SephadexG-15分离纯化诺邓火腿抗氧化肽
分离纯化条件:选择26 mm×1 m层析柱,诺邓火腿抗氧化肽组分C(由1.3.4可知选取组分C进行分离纯化)配制成10 mg/mL溶液,过滤,不用进行透析处理,上样量为1 mL,蒸馏水经过45 nm过滤后作为洗脱液进行洗脱,保持在4 ℃的环境下,调节流速0.25 mL/min,每管收集2.5 mL洗脱液。各管在220 nm处测定吸光值,以洗脱体积为横坐标,吸光值为纵坐标作图。分别收集各峰处的洗脱液,既得诺邓火腿抗氧化肽的各组分,记C1、C2、C3、C4和C5,冷冻干燥,置-80 ℃保存。
1.3.6 诺邓火腿抗氧化肽各组分抗氧化活性研究
方法同1.3.3。
1.3.7 通过MALDI-TOF- LC-MS诺邓火腿抗氧化肽的鉴定
使用基质辅助激光解析电离飞行时间质谱仪(MALDI-TOF-MS)进行样品的质谱分析。取1 μL样品点在干净的不锈钢样品靶上,待室温干燥后,加入1 μL的基质溶液,待干燥后进行质谱分析。用标准品对质谱仪进行校正,校准至误差≤10 Da。一级质谱数据采集使用MS-2 KV反射模式,加速电压设为20 kV,扫描范围100~10 000 Da、10~60 kDa,激光能量≥3 900,同一样品同一结晶点,调整采集点,累加至少8个点的数据,保存累加的图谱,质谱图累积叠加1 500 次。
样品经MALDI-TOF-MS采集一级质谱数据后采用纳升流速HPLC液相系统Ultimate 3000进行鉴定。缓冲液:A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液。色谱柱以95%的A液平衡。样品由自动进样器上样到质谱预柱C18trap column (C183 μm×0.10 mm×20 mm),再经分析柱C18column (C181.9 μm×0.15 mm×120 mm) 分离,流速为600 nL/min。
1.3.8 数据分析
试验重复5次,所有数据均以“平均数±标准差”表示,采用SPSS 19.0软件进行数据统计与分析,对各组进行单因素方差分析和Duncan′s多重比较,p<0.05做显著差异检验的标准。
质谱分析原始数据为RAW文件,使用软件Sequest HT和Proteome Discoverer (Thermo)进行查库鉴定及定量分析。使用数据库:gi_pig.fasta;查库时将RAW文件通过Proteome Discoverer提交至Sequest HT服务器,选择已经建立好的数据库,然后进行数据库搜索。
2 试验结果与分析
2.1 诺邓火腿抗氧化肽的提取及多肽含量的测定
胰酪蛋白胨标准曲线线性标准方程为Y=0.049 7X+2.078 8(R2=0.994 4)线性好;根据标准曲线换算得诺邓火腿粗肽中多肽的含量为(72.00±0.99)%。
2.2 诺邓火腿抗氧化肽抗氧化活性的测定
初步提取的诺邓火腿抗氧化肽具有一定抗氧化活性,但活性较弱。质量浓度为1 mg/mL的时候、DPPH自由基清除率和·OH清除率分别为14.63%和9.74%,与相同浓度下GSH相比存在极显著差异,分别降低了61.42%和5.41%。Fe2+螯合率为9.57%,与相同浓度下GSH相比存在极显著差异,螯合率增加了3.75。
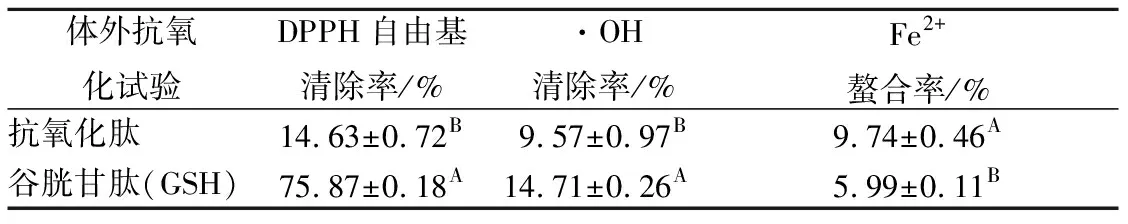
表1 诺邓火腿抗氧化肽抗氧化活性Table 1 Nuodeng ham antioxidant peptide of antioxidantactivity
注:大写字母表示同列相比较,相同字母表示无显著差异(p>0.05);不同字母表示极显著差异(p<0.01)。表2、表3同。
2.3 通过SephadexG-25分离纯化诺邓火腿抗氧化肽
图1为诺邓火腿抗氧化肽Sephadex G-25柱洗脱图谱,总洗脱体积为340 mL,诺邓火腿抗氧化肽经Sephadex G-25色谱分为4个组分(A、B、C和D),A组分洗脱区间50~125 mL,B组分洗脱区间160~200 mL,C组分洗脱区间200~245 mL,C组分由于有分子量相接近的部分,因此不完全分离,D组分洗脱区间为245~315 mL。

图1 诺邓火腿抗氧化肽的Sephadex G-25柱洗脱图谱Fig.1 The Sephadex G-25 column Nuodeng ham antioxidant peptide elution pattern
2.4 诺邓火腿抗氧化肽各组分抗氧化活性的测定
由表2可知,分离纯化后各组分抗氧化活性差异较大,其中组分C抗氧化活性最强。质量浓度为1 mg/mL时,组分C的DPPH自由基清除率、Fe2+螯合率和·OH清除率分别达到50.01%、34.37%和48.32%,相同质量浓度下,与其他组分相比,差异极显著(p<0.01)。

表2 诺邓火腿抗氧化肽各组分抗氧化活性Table 2 Nuodeng ham antioxidant peptide componentsof antioxidant activity
2.5 通过SephadexG-15分离纯化诺邓火腿抗氧化肽组分C
图2所示为诺邓火腿抗氧化肽组分C的Sephadex G-15柱洗脱图谱,总洗脱体积为450 mL,组分C经Sephadex G-15色谱分为4个组分(C1、C2、C3、C4和C5)。C1组分洗脱区间70~105 mL,C2组分洗脱区间135~160 mL,C3组分洗脱区间185~275 mL,C4组分洗脱区间为245~315 mL,C5组分洗脱区间为360~400 mL,其中C3组分为最高峰。
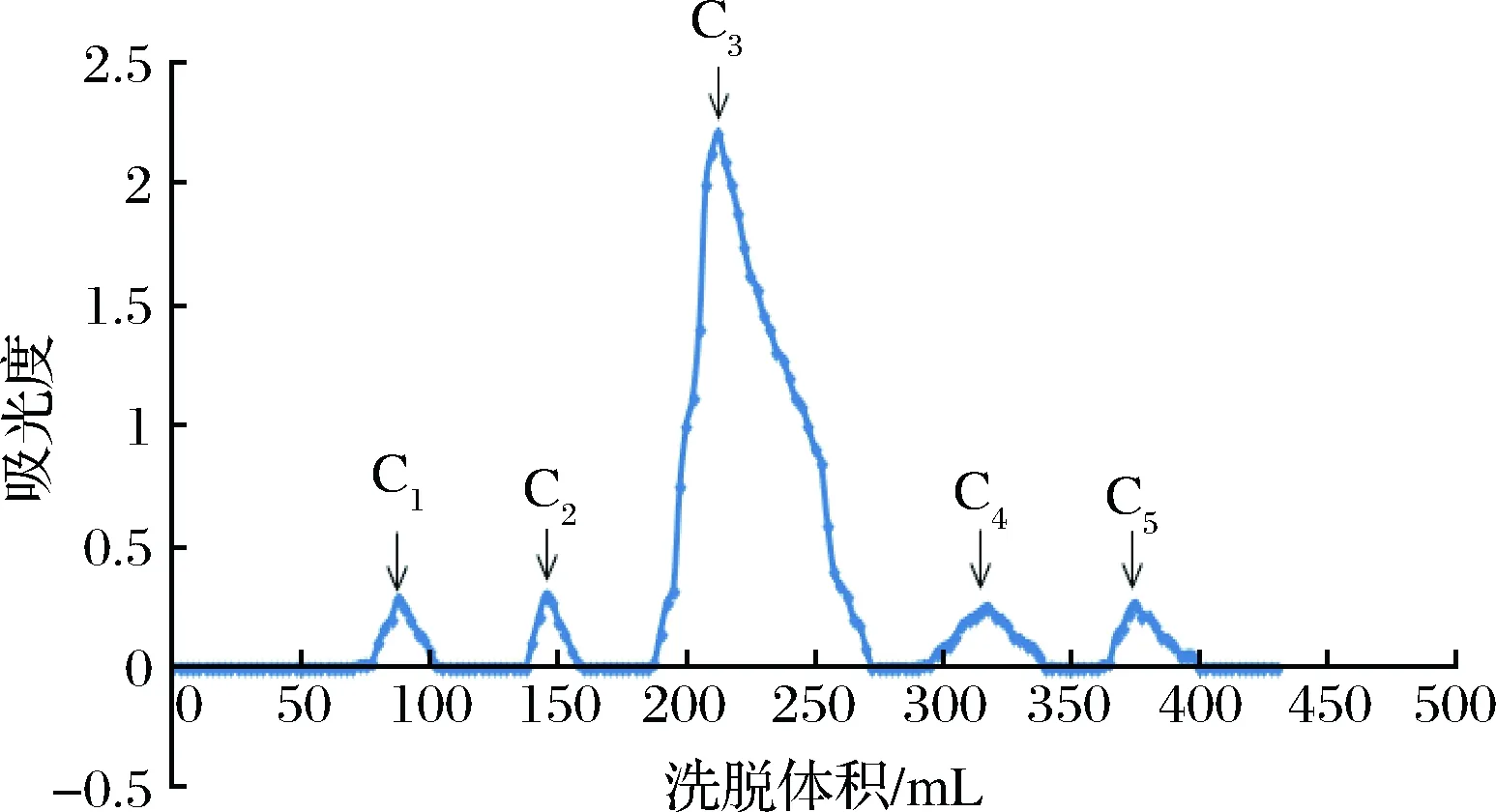
图2 诺邓火腿抗氧化肽组分C的Sephadex G-15柱洗脱图谱Fig.2 Sephadex G-15 column Nuodeng ham antioxidant peptide fraction C elution profile
2.6 诺邓火腿抗氧化肽各组分抗氧化活性的测定
由表3可知,组分C分离纯化后各组分抗氧化活性差异较大,其中组分C3抗氧化活性最强。当质量浓度为1 mg/mL时,组分C的·OH清除率、DPPH自由基清除率、Fe2+螯合率分别达到73.01%、51.21%、65.23%,相同浓度下,与其他组分相比较差异极显著(p<0.01)。
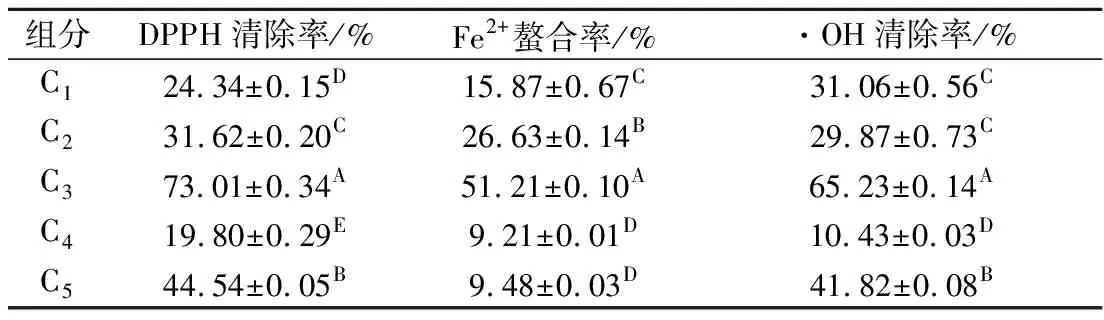
表3 诺邓火腿抗氧化肽各组分抗氧化活性Table 3 Nuodeng ham antioxidant peptide components ofantioxidant activity
2.7 通过MALDI-TOF-MS鉴定诺邓火腿抗氧化肽C3
使用MALDI-TOF- LC-MS对抗氧化活性最强的组分C3进行肽序鉴定,测得抗氧化肽离子流图如图3所示。诺邓火腿抗氧化肽肽段信息如表4所示,经质谱鉴定诺邓火腿抗氧化肽8个肽段质谱图分别如图3所示,通过对 1号分子离子峰的二级质谱解析,质核比为 881.89,通过与数据库中蛋白质序列比对可确定 1 号抗氧化肽的序列为 :QVTSLSGQcHHHDEK,带2个正电荷,其中C9半胱氨酸甲基修饰;2号分子离子峰二级质谱结合软件分析及蛋白质数据库,确定荷质比为:893.48,带2个正电荷,其氨基酸序列为:VHQYFNVGLIQPGSVK;3号分子离子峰二级质谱结合软件分析及蛋白质数据库,确定荷质比为:903.96,带2个正电荷,其氨基酸序列为:QNLLSQSHAHQQFLR;4号离子峰二级质谱结合软件分析及蛋白质数据库,确定荷质比为:912.94,带两个正电荷,其氨基酸序列为:GcFKPIVAGDQNVEYK ,其中C2甲基修饰;5号离子峰二级质谱结合软件分析及蛋白质数据库,确定荷质比为:923.46,带2个正电荷,其氨基酸序列为:AIQISYNPEDLSKPDR;6号离子峰二级质谱结合软件分析及蛋白质数据库,确定荷质比为945.45,带2个正电荷:其氨基酸序列为:NLHPELGTDADKEHWK;7号离子峰二级质谱结合软件分析及蛋白质数据库,确定荷质比为:768.37,带3个正电荷,其氨基酸序列为:IRELESQISELQEDLESER;8号离子峰二级质谱结合软件分析及蛋白质数据库,确定其荷质比为:671.58,带4个正电荷,其氨基酸序列为:IHVSDQELQSANASVDDSRLEELK。
3 讨论
3.1 火腿中抗氧化肽的提取
提取火腿中抗氧化肽的一般是用盐酸或磷酸缓冲液,ESCUDERO等[8-9]用0.01 mol/L的HCl溶液从西班牙火腿中提取并分离纯化出具有抗高血压和抗氧化活性的短肽。祝智超等[10]用0.01 mol/L的HCl溶液提取金华火腿中的粗肽, 并用多种体外抗氧化实验证明金华火腿粗肽具有抗氧化活性。邢陆娟等[11]用0.2 mol/L的磷酸盐缓冲液(pH 7.2)提取宣威火腿中的粗肽,测定粗肽粉中的多肽含量60%。本试验用磷酸盐缓冲液提取不同加工时长诺邓火腿多肽,测得诺邓火腿粗肽中多肽的含量分别为72.00%;其他使用磷酸盐缓冲液来提取火腿多肽的研究者的结果相比,多肽含量较高。粗肽粉中可能还含有大分子蛋白质、小分子氨基酸和无机盐等,因此还可以进一步分离纯化,以获得高纯度的多肽。
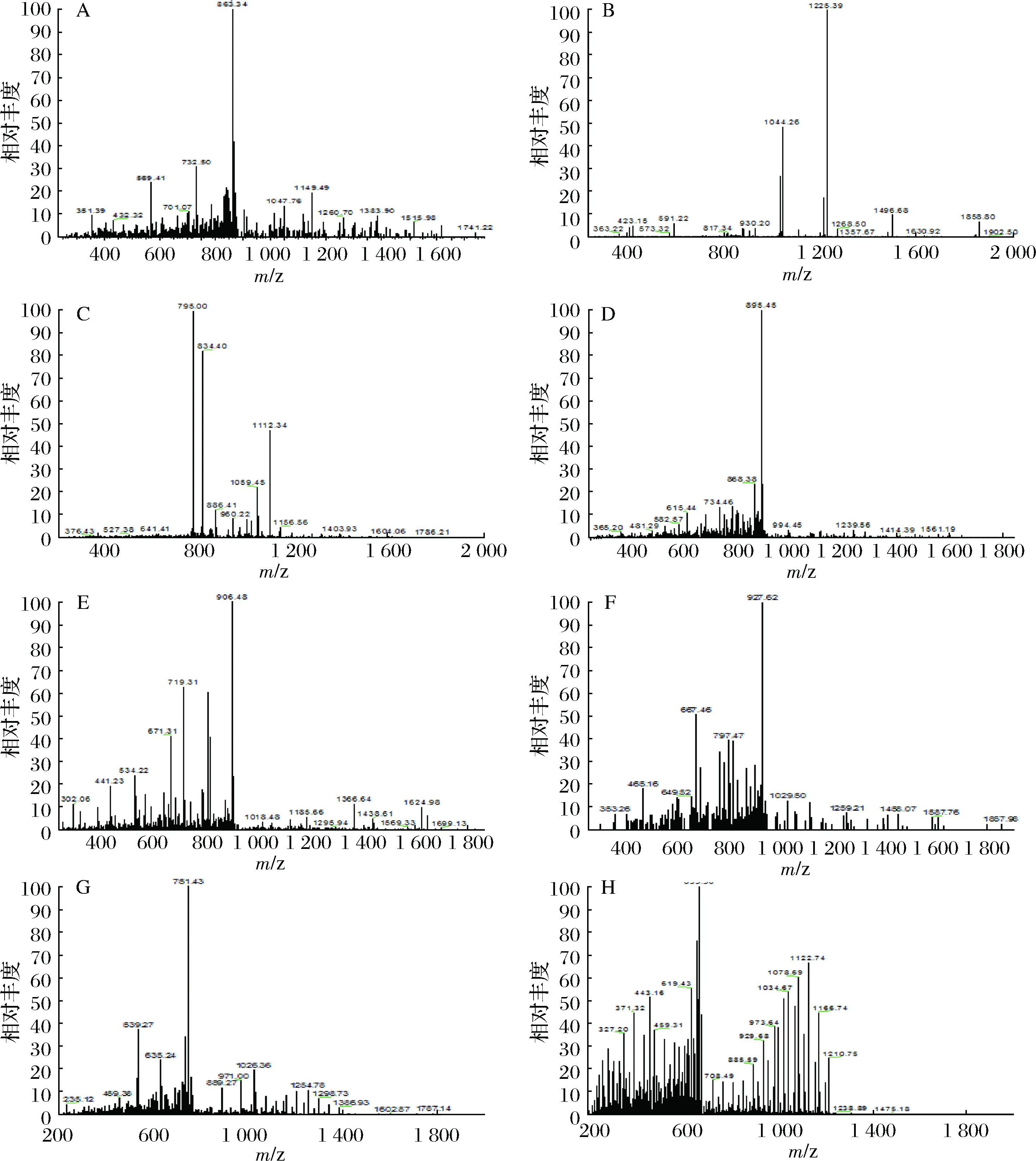
ABCDEFGH分别表示QVTSLSGQcHHHDEK、VHQYFNVGLIQPGSVK、QNLLSQSHAHQQFLR、GcFKPIVAGDQNVEYK、AIQISYNPEDLSKPDR、NLHPELGTDADKEHWK、IRELESQISEL-QEDLESER、IHVSDQELQSANASVDDSRLEELK 8个肽段的质谱图图3 各肽段质谱图Fig.3 the peptides of mass spectrum

序号氨基酸序列修饰蛋白编号肽段电荷分子质量质荷比检测方式相对含量1QVTSLSGQcHHHDEKC9(Carbam-idomethyl)I3LQX021 762.78881.89HCD1.0002VHQYFNVGLIQPGSVKI3LTB821 785.95893.48HCD0.9223QNLLSQSHAHQQFLRK9IWG621 806.92903.96HCD0.8884GcFKPIVAGDQNVEYKC2(Carbam-idomethyl)Q9GJV421 824.88912.94HCD0.8345AIQISYNPEDLSKPDRF1RX3521 845.92923.46HCD0.8326NLHPELGTDADKEHWKD2SW9621 889.90945.45HCD0.7277IRELESQISELQEDLESERK9IVP532 303.12768.37HCD0.4178IHVSDQELQSANASVDDSRLEELKK7GRY042 683.30671.58HCD0.325
3.2 火腿抗氧化肽分离纯化与鉴定
凝胶过滤色谱是目前最广泛使用的多肽分离方法之一,基于样品分子质量达到分离效果,依分子质量从大到小依次洗脱出来,其特点是分离条件温和,样品回收率高、操作简单等[12]。ESCUDERO等[8]研究了西班牙干腌火腿中水溶性的抗高血压肽和抗氧化肽,在4℃条件下,根据分子质量使用Sephadex G-25凝胶色谱柱,分离肽提取物得到3个组分。实验结果表明,分离所得的肽具有抗氧化活性,且不同洗脱区间的肽液的抗氧化活性有一定的差异。XING等[13]多次分离纯化宣威火腿中的抗氧化肽,使用Sephadex G-25凝胶色谱柱分离得到4个组分,其中第3组分的抗氧化活性最强,然后使用阴离子交换色谱对第3组分进一步分离纯化,得到5个组分(C1、C2、C3、C4和C5),C5组分抗氧化活性高于其他4个组分。本试验经过Sephadex G-25凝胶色谱和Sephadex G-15凝胶色谱2次分离纯化,得到组分C3在质量浓度为1 mg/mL时,·OH清除率、DPPH自由基清除率和螯合Fe2+分别达到73.01%、51.21%和65.23%,与其他组分(C1、C2、C4和C5)相比,差异极显著(p<0.01)。因此,分子质量小的火腿多肽比分子质量大的活性较高。
抗氧化肽肽肽分离纯化后, 用基质辅助激光解吸电离飞行时间质谱法(MALDI-TOF-MS)分析其氨基酸序列[14],进一步推测分析其抗氧化作用机制。基质辅助激光解吸电离(MALDI)是一种软电离法,使用特定波长的激光常用的是和紫外激光等照射到样品靶上,样品靶上的基质将吸收到的能量传递给样品,使样品产生瞬间膨胀相变而发生本体解吸,使样品离子化,从而使基质被激发并辅助质子传递。飞行时间质谱法(TOF-MS)在所有的质谱仪中分析速度最快微秒级、质量检测范围最宽、离子传输率最高[15]。因此MALDI-TOF-MS具有准确率高、分辨率高、灵敏度高、质量测定范围广、图谱直观等优点,是检测鉴定微量甚至是痕量蛋白质分子的重要手段。本试验使用MALDI-TOF-MS分析其氨基酸序列,得到8个肽序。
3.3 抗氧化机理
肽的抗氧化性主要与其分子质量、所含氨基酸种类和氨基酸序列等有关。
3.3.1 多肽分子质量对抗氧化效果的影响
抗氧化肽主要是含有少于20个氨基酸残基的分子且分子质量小于6 000 Da[16]。LI等[5]的研究表明, 具有强抗氧化活性的肽的分子质量分布在500~1 500 Da之间。火腿的多肽组成可分为5个分子质量范围, 即4 500~2 700、2 700~1 200、1 200~500、500~375和375~160 Da[17]。金华火腿中的小肽类物质大多由5~16个氨基酸组成,具有一定的疏水性,因此随着浓度的增加,小肽类物质对自由基的捕获能力增加,抗氧化性增强[10]。本试验中抗氧化肽的分子质量分布在881.89~2 683.30 Da,由15~24个氨基酸残基组成,其中1 762.66 Da含量最高分子质量及氨基酸残基数较其他研究者稍大,其可能发挥的可能发挥抗氧化作用最大。
3.3.2 多肽所含氨基酸种类对抗氧化效果的影响
氨基酸在抗氧化反应中起着不同的作用, 其主要是作为电子供体, 具有疏水性、能够直接与自由基结合、形成有利于发挥其抗氧化性及能够螯合金属离子等的构象。许多氨基酸本身具有抗氧化性, 如Cys(半胱氨酸)、His(组氨酸)、Trp(色氨酸)、Tyr(络氨酸)和Ile(异亮氨酸)等。Trp、Tyr和组氨酸能够作为电子供体, Glu(谷氨酸)能够与自由基结合起到清除自由基的作用;疏水性氨基酸如Met(蛋氨酸)、Trp、Phe(苯丙氨酸)、Val(缬氨酸)、Leu(亮氨酸)、Ile、Pro(脯氨酸)和Ala(丙氨酸)可以捕获脂类的自由基, 加强抗氧化肽与疏水性多不饱和脂肪酸间的相互作用, 从而延缓脂质的氧化反应。酸性氨基酸如Asp(天冬氨酸)和Glu侧链的羧基可以与金属离子发生相互作用, 钝化金属离子,达到抗氧化效果[18-19]。CHEN等[18]发现, 抗氧化肽的金属离子亲和力与His含量呈正相关。本试验中测得多肽的氨基酸组成中含大量的Glu、His、Ile、Pro等。
3.3.3 多肽氨基酸序列对抗氧化效果的影响
N-端含有疏水性氨基酸的肽具有更高的抗氧化性,因为疏水性氨基酸可以捕获脂类自由基和加强抗氧化肽与疏水性多不饱和脂肪酸相互作用,从而延缓脂质氧化反应[19-21]。本试验中有6个多肽序列是疏水性氨基酸为N-端,相对含量最高的多肽(QVTSLSGQcHHHDEK)也是是疏水性氨基酸为N-端。酸性氨基酸(Asp和Glu)侧链的羧基可以与金属离子相互作用,钝化金属离子,达到抗氧化效果[20]。本实验中的8个多肽序列有4个多肽C-端是Asp,因此,Asp位于C-端可能是有利于发挥抗氧化活性的构象。本试验中测得的肽序含有多个电荷,有研究表明正电荷肽可能在抑制LDL(低密度脂蛋白)氧化上发挥重要的作用[21]。
4 结论
磷酸提取法提取的诺邓火腿抗氧化肽具有抗氧化活性,抗氧化肽经过Sephadex G-25凝胶色谱分离纯化后得到4个组分(A、B、C和D),通过体外抗氧化试验(·OH清除活性、DPPH自由基清除活性、螯合Fe2+能力)得出组分C抗氧化活性最强;组分C通过Sephadex G-15凝胶色谱分离纯化后得到5个组分(C1、C2、C3、C4和C5)。通过体外抗氧化试验得出C3体外抗氧化活性最强,C3组分抗氧化活性最强,质量浓度为1 mg/mL时,·OH清除率、DPPH自由基清除率和螯合Fe2+分别达到73.01%、51.21%和65.23%,与其他组分(C1、C2、C4和C5)相比,差异极显著(p<0.01),进一步通过MALDI-TOF-MS鉴定C3组分,得抗氧化肽序为:QVTSLSGQcHHHDEK、VHQYFNVGLIQPGSVK、QNLLSQSHAHQQFLR、GcFKPIVAGDQNVEYK、AIQISYNPEDLSKPDR、NLHPELGTDADKEHWK、IRELESQISELQEDLESER、IHVSDQEL-QSANASVDDSRLEELK。

