鸡白痢沙门氏菌invA基因的克隆与原核表达
刘志科,张秋雨,杨宁宁,徐锦凤,徐明国,荆明龙,吴文星,曹旭东,任 艳,石 峰,陈创夫
(1 石河子大学 a动物科技学院,b生命科学学院,c医学院,新疆 石河子832003;2 河南科技学院 动物科学学院,河南 新乡 453003)
鸡白痢沙门氏菌病是由沙门氏菌属中一个或多个成员引起的禽类传染病,给养禽业造成了严重的危害。沙门氏菌染色体区域的转录因子由9个侵袭蛋白(inv)基因(invA、invB、invC、invE~invJ)组成,这9个基因的核苷酸序列大多数相对保守,沙门氏菌的侵袭力受多种复杂因素的影响[1]。Clark等[2]研究了鼠伤寒沙门氏菌对小鼠肠道淋巴滤泡组织M细胞的入侵机制,发现鼠伤寒沙门氏菌缺失invA和invG基因会导致其入侵能力下降,表明invA和invG蛋白在沙门氏菌入侵肠道M细胞中起着重要作用。沙门氏菌invA蛋白不仅与宿主细胞存在互作效应,而且与Ⅲ型分泌系统(T3SS-1)和双组分信号转导系统有着密切的关系[3]。最近研究发现,Ⅲ型分泌系统是沙门氏菌最重要的毒力因子之一,其中起主要作用的毒力岛主要包括SPI1、SPI2和SPI3[4-6]。SPI1编码的T3SS-1与沙门氏菌对肠道上皮细胞的侵袭力有关[7]。SPI2毒力岛与沙门氏菌在巨噬细胞内的存活和上皮细胞内的复制有关。SPI3与Mg2+的摄取有重要关系,可以介导沙门氏菌黏附在宿主细胞表面,从而使沙门氏菌可以在低含量Mg2+营养条件下存活。近年来的研究也表明,invA蛋白含量的高低与沙门氏菌毒力呈正相关[8]。上述研究提示,高度保守的invA是有毒力沙门氏菌在宿主体内定殖或致病的关键。目前,对invA蛋白的功能与致病机制尚不明确。本试验以临床分离的沙门氏菌为材料,克隆其invA基因,通过在线生物信息学软件预测分析invA基因编码蛋白的结构和功能,并在大肠杆菌中高效表达重组蛋白invA,旨在为沙门氏菌快速诊断试纸条和新型表位疫苗的研发提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 试验菌株及标准株 鸡白痢沙门氏菌分离株(D1型),本课题组分离鉴定;鸡白痢沙门氏菌标准株(CVCC538)购于中国兽医微生物菌种保藏管理中心。
1.1.2 主要试剂及仪器 细菌基因组DNA提取试剂盒、2×ESTaqMasterMix、 限制性内切酶EcoRⅠ和HindⅢ以及其他常用试剂,均购自TIANGEN BIOTECH(北京);克隆载体pMD19-T,购于TaKaRa生物公司;COIGTP/X-gal、T4 DNA连接酶,购于北京全式金生物有限技术公司;BCA Protein Assay Kit,购于Thermo ScientificTM;山羊抗鼠IgG(HRP)、快速琼脂糖凝胶DNA回收试剂盒,均购于康为世纪公司;大肠杆菌(E.coli)DH5α和BL21(DE3)感受态细胞、pET-30a表达载体质粒和鼠抗鸡白痢沙门氏菌阳性血清,均由石河子大学人畜共患病实验室保存;Proteinsimple凝胶成像系统,购于Santa Clara,CA USA。
1.2 方 法
1.2.1 引物设计与合成 根据NCBI中GenBank已公布的鸡白痢沙门氏菌invA基因序列(GenBank登录号:NC003197.1),利用Preimer Preimer 5.0软件设计invA基因的上、下游引物invAF和invAR,在5′端分别加上限制性酶切位点HindⅢ和EcoRⅠ,invAF序列为:5′-CGGAATTCTCCTCCGCCCTGTCTACTT-3′,下划线部分为HindⅢ酶切位点;invAR序列为5′-CCAAGCTTCCCTT-TGCGAATAACATCCT-3′,下划线部分为EcoRⅠ酶切位点。引物由生工生物工程(上海)股份有限公司合成,预期扩增片段长度为1 143 bp。
1.2.2 细菌核酸的提取 取经液体LB培养基37 ℃下过夜培养的鸡白痢沙门氏菌标准株和分离株菌液各20 mL,用细菌基因组DNA提取试剂盒提取DNA,用核酸蛋白仪测定其浓度,于-20 ℃冰箱保存。
1.2.3invA基因的PCR扩增 PCR反应体系为20 μL:ddH2O 8.2 μL,引物invAF和invAR各0.3 μL,DNA模板1.5 μL,2×ESTaqMasterMix 10 μL。PCR反应条件为:95 ℃预变性5 min;95 ℃变性40 s,58 ℃退火30 s,72 ℃延伸100 s,35个循环;72 ℃终延伸10 min。试验同时设以蒸馏水代替模板的扩增产物作为阴性对照。取PCR产物进行1.5%琼脂糖凝胶电泳检测。用快速琼脂糖凝胶DNA回收试剂盒回收分离株扩增所得的目的条带。
1.2.4invA基因的克隆及序列分析 将回收的invA基因与pMD19-T载体在16 ℃下连接过夜,构建重组载体pMD19-T-invA,连接产物转化到大肠杆菌 DH5α感受态细胞中,进行蓝白斑筛选,挑取白色克隆菌落进行LB液体培养,用PCR鉴定阳性菌液提取质粒,用限制性内切酶Hind Ⅲ和EcoRⅠ进行双酶切鉴定。然后将PCR和双酶切鉴定正确的阳性质粒送到北京华大生物测序公司进行DNA测序,将测序结果与GenBank中已公布的鸡白痢沙门氏菌invA基因的核酸序列(GenBank登录号:NC003197.1)进行比对。
1.2.5invA基因编码蛋白的生物信息学分析 采用SOPMA程序(https://nps a-prabi.i bcp.fr/cgi-bin/npsa_automat. pl?page=/NPS A/npsasopma.htm//)和SWISS-MODEL软件首选模式的同源建模方法(http://ww w.expasy.ch/swis smod/SWISS-MODEL.html/)在线预测invA蛋白的高级结构。利用 Predicting Antigenic Peptides 在线软件(http://imed.med.ucm.es/Tools/anti genic.pl/)预测invA蛋白的抗原决定簇。使用SMART数据库(http://smart.embl-heidelberg.de/)对invA蛋白的结构域进行分析;利用信号肽在线预测软件SignalP 3.0(http://www.cbs.dtu.dk/service SignalP s/ /)预测invA蛋白的信号肽;利用 PDBsum Generate 在线软件(http://www.eb i.ac.uk/thornton-srv/databases/pdbs um/Gen era te.html)对invA蛋白的结构模型进行评估。
1.2.6 原核表达载体pET-30a-invA的构建 将测序验证正确的质粒pMD19-T-invA与pET-30a质粒分别用Hind Ⅲ和EcoRⅠ进行双酶切,回收invA目的基因和载体pET-30a线性大片段,用T4 DNA连接酶进行连接。将连接产物转化至大肠杆菌DH5α感受态细胞中,用含100 mg/mL卡那霉素(Kan)的琼脂培养基筛选阳性转化子,对阳性转化子进行菌落PCR鉴定。提取阳性转化子的质粒,进行Hind Ⅲ和EcoRⅠ双酶切鉴定。将3次鉴定正确的阳性重组质粒转化大肠杆菌 BL21(DE3) 感受态细胞,用含100 mg/mLKan的LB平板进行筛选,挑取单个菌落进行增菌培养后提取质粒,送上海生工生物工程股份有限公司进行测序。将测序结果与GenBank中已公布的鸡白痢沙门氏菌invA基因的核酸序列(GenBank登录号:NC003197.1)用DNASTAR软件进行序列比对。将测序正确的重组子命名为pET-30a-invA,并用体积分数50%甘油管进行保菌,放于-80 ℃保存备用。
1.2.7invA基因重组蛋白的诱导表达 将含有pET-30a-invA的重组菌接种100 mg/mL含Kan的LB液体培养基,于37 ℃摇床培养过夜;之后按体积比1∶200转接到新的液体培养基(含Kan150 μg/mL),37 ℃振荡培养2 h左右,待菌液D600 nm值为0.6~0.8时加入异丙基硫代半乳糖苷(IPTG)使其终浓度为1 mmol/L(600 μL)进行诱导表达,分别在诱导0,2,4和5 h 时取菌液样品, 5 000 r/min离心20 min,收集菌体。将收集的菌体于液氮和37 ℃水浴反复冻融3次之后,进行超声破碎(每次超声破碎10 s,间隔10 s,90次/周期,重复2~3次)直至菌体清亮为止。将上述处理过的菌液于4 ℃下12 000 r/min离心30 min,分别取上清液和沉淀,沉淀用ddH2O重悬,备用。取80 μL上清液或沉淀重悬液于无菌的EP管中,加20 μL蛋白上样液混匀,封口膜封口,100 ℃水煮10 min,取出进行12% SDS-PAGE电泳鉴定重组蛋白的表达形式。
1.2.8 表达产物的Western-blot分析 将上述诱导表达的产物经12% SDS-PAGE电泳检测后,用半干式电转仪将表达的目的蛋白转移到PVDF膜上,用含30 g/L牛血清白蛋白(BSA)的PBS封闭2 h,以加入接种鸡白痢沙门氏菌野毒株2周后的小鼠血清(按1∶50体积比稀释)为一抗,37 ℃孵育3 h;冲膜后,以HRP标记的羊抗鼠IgG为二抗(1∶4 000体积比稀释),37 ℃作用1 h,之后用TBST洗膜3次。最后用DAB底物溶液染色2~3 min,双蒸水终止反应,观察结果。
2 结果与分析
2.1 鸡白痢沙门氏菌invA基因的PCR扩增、克隆及鉴定
分别以鸡白痢沙门氏菌标准株和分离株的DNA作为模板,扩增invA基因,二者PCR扩增目的条带相同,长度均为1 143 bp(图1),与预期的结果一致。经蓝白斑筛选的白色克隆,其菌液PCR扩增也获得了预期的1 143 bp片段。重组质粒pMD19-T-invA的EcoRⅠ和Hind Ⅲ双酶切鉴定结果显示,获得了1 143 bp的目的片段和2 692 bp的载体片段(图2),与预期片段长度相符。将测序结果与GenBank数据库中的invA标准序列(GenBank登录号:NC003197.1)比对,其同源性为99.2%,表明invA基因已正确插入到克隆载体pMD19-T上。

M.DL2000 DNA Marker;1.阴性对照;2.分离株的invA基因扩增片段;3.标准株的invA基因扩增片段M.DL2000 DNA Marker;1.Negative control;2.Fragment size of invA gene of the isolated strain;3.Fragment size of invA gene of the standard strain图1 鸡白痢沙门氏菌invA基因的PCR扩增结果Fig.1 PCR amplification results of invA gene from Salmonella pullorum
2.2 鸡白痢沙门氏菌分离株invA基因编码蛋白的生物信息学分析
利用SOPMA在线软件服务器Prodiction分析发现,invA分子的二级结构元件组分中,α-螺旋(Hh)所占比例最大(50.8%),β-转角(Tt)次之(占21.02%),无规则卷曲(Cc)和β-折叠(Ee)所占比例较小(分别占17.1%和11.08%),结果表明,invA蛋白主要属于α型蛋白,α-螺旋在invA蛋白结构的稳定中可能起主要作用。将获得的沙门氏菌分离株的氨基酸序列提交到SWISS-MODEL软件后,得到invA蛋白的三级结构预测模型,结果见图3。经PDBsum Generate在线评估,结果表明,在总的381个氨基酸中,invA蛋白92.5%的氨基酸残基处于核心区,3.6%的氨基酸残基处于允许区,3.9%的氨基酸残基处于额外允许区,无不可信区域氨基酸残基,可见其可接受区域氨基酸残基达到了100%,表明构建的蛋白结构模型可信度较高。根据Predicting Antigenic Peptides在线软件预测得出invA蛋白有17个抗原决定簇(表1)。通过SMART数据库分析invA蛋白的结构域,结果表明,invA蛋白92-105位氨基酸序列为low complexity 结构域,包含14个氨基酸。通过SignaIP 3.0在线预测软件,利用神经网络算法预测invA蛋白的信号肽区域,结果表明,其S的平均值为0.821,远远大于分泌型蛋白的标准(S>0.5),说明该蛋白存在信号肽,其在进化上并不保守;信号肽剪切位点位于第29和30位氨基酸之间(可能性为0.695);信号肽的具体氨基酸序列为MHPASLPOLRCSLLLLVTMVFVFTPVTT,成熟肽始于第29位氨基酸。
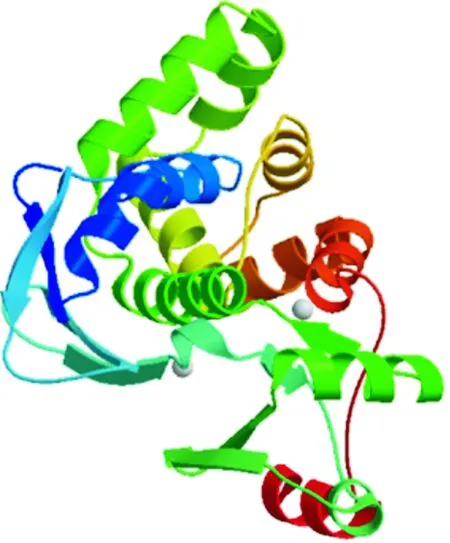
红色部分为α-螺旋,黄色部分为β-折叠,灰色部分与Mg2+有关,蓝色部分为跨膜区域The red part is the α-helix,the yellow part is β-sheet,the gray part is related to Mg2+,the blue part is the transmembrane region
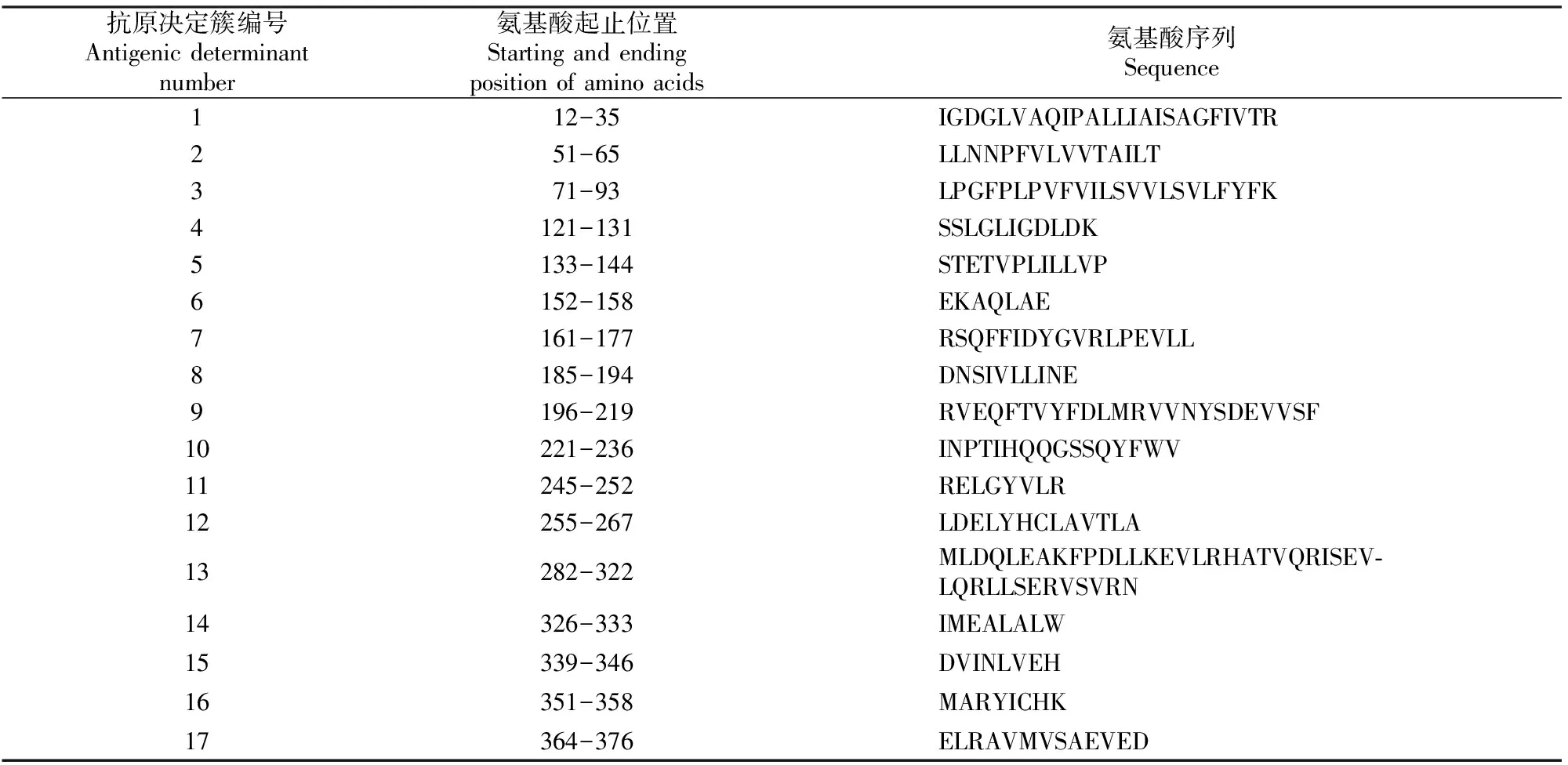
抗原决定簇编号Antigenic determinant number氨基酸起止位置 Starting and ending position of amino acids氨基酸序列Sequence112-35IGDGLVAQIPALLIAISAGFIVTR251-65LLNNPFVLVVTAILT371-93LPGFPLPVFVILSVVLSVLFYFK4121-131SSLGLIGDLDK5133-144STETVPLILLVP6152-158EKAQLAE7161-177RSQFFIDYGVRLPEVLL8185-194DNSIVLLINE9196-219RVEQFTVYFDLMRVVNYSDEVVSF10221-236INPTIHQQGSSQYFWV11245-252RELGYVLR12255-267LDELYHCLAVTLA13282-322MLDQLEAKFPDLLKEVLRHATVQRISEV-LQRLLSERVSVRN14326-333IMEALALW15339-346DVINLVEH16351-358MARYICHK17364-376ELRAVMVSAEVED
2.3 invA基因原核表达载体pET-30a-invA的PCR和酶切鉴定
重组表达质粒pET-30a-invA的PCR鉴定结果显示,获得了预期的1 143 bp的invA基因片段;EcoRⅠ和Hind Ⅲ双酶切鉴定显示,获得了5 422 bp的表达载体片段和1 143 bp的invA基因目的片段(图4),均与预期的结果相符。
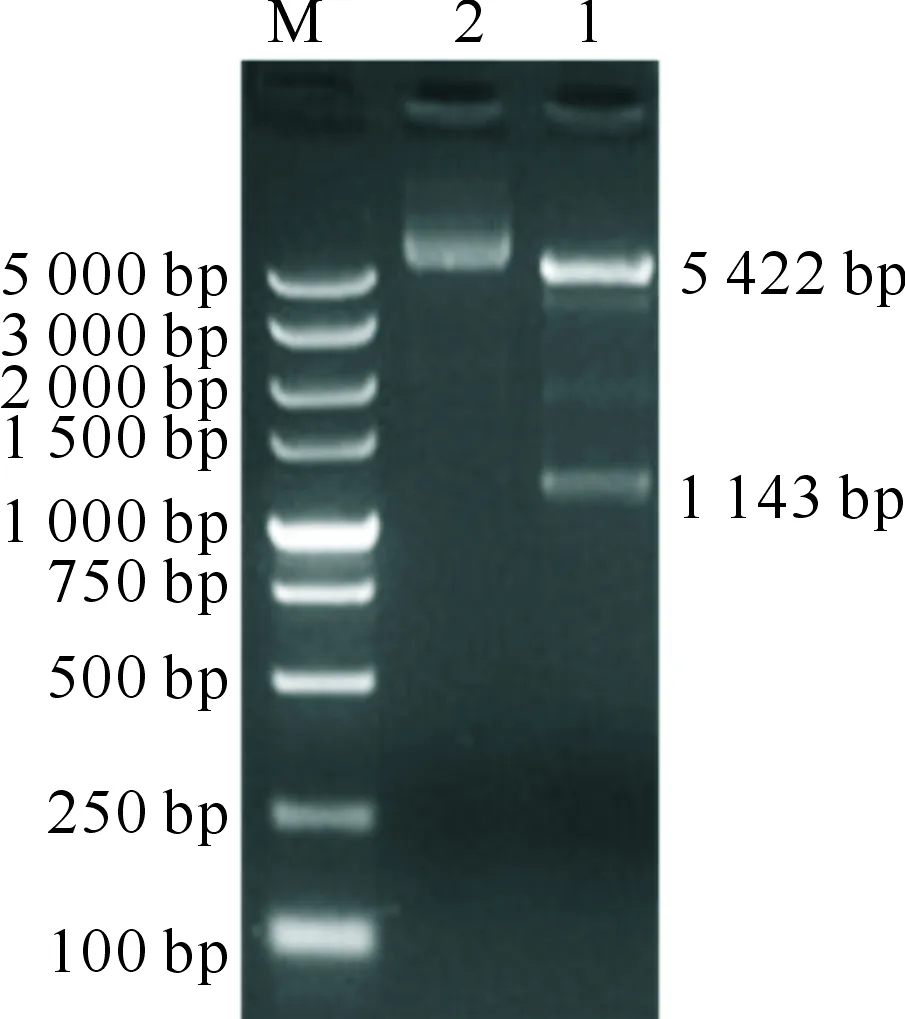
M.DL5000 DNA Marker;1.重组质粒的EcoRⅠ/Hind Ⅲ双酶切鉴定结果;2.pET-30a-invA质粒对照M.DL5000 DNA Marker;1.Identification of recombinant plasmid EcoRⅠ/Hind Ⅲ by double enzyme digestion;2.pET-30a-invA plasmid control图4 重组质粒pET-30a-invA酶切电泳图Fig.4 Restriction analysis results of recombinant plasmid pET-30a-invA
测序结果经DNASTAR软件比对,与invA基因标准序列(GenBank登录号:NC003197.1)的相似性为98.9%,表明invA已成功克隆到了表达载体pET-30a上,并具有正确的读码框。
2.4 invA重组蛋白在大肠杆菌BL21(DE3)中的诱导表达
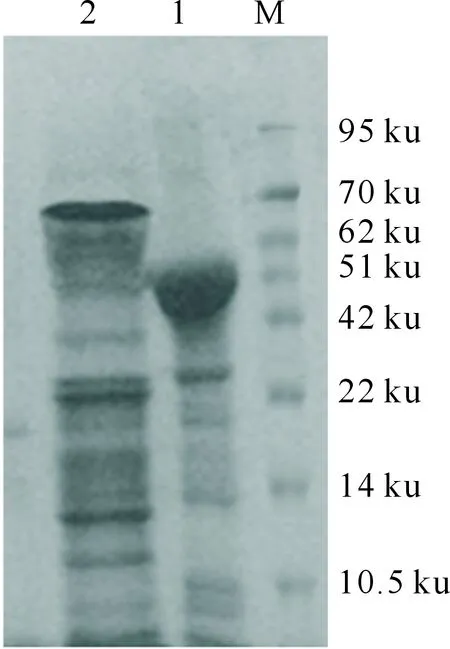
重组表达克隆菌在37 ℃条件下经IPTG诱导、超声破碎后,分别取上清和沉淀进行SDS-PAGE电泳,结果发现,invA重组融合蛋白主要以包涵体的形式存在,细菌裂解上清液中的重组融合蛋白很少(图5)。SDS-PAGE分析结果显示,当诱导时间为4 h时,可以获得最佳的表达效果,pET-30a-invA的诱导表达产物(包涵体)在51 ku左右出现了明显的蛋白条带(图6),与预期结果一致。
M.蛋白质Marker;1,2.分别为重组质粒转化菌IPTG诱导4 h超声破碎后的沉淀和上清液M.Protein molecular standard Marker;1,2.The sediment and supernatant after ultrasonic dispersion for 4 h by IPTG,respectively图5 鸡白痢沙门氏菌invA重组蛋白的可溶性分析Fig.5 Soluble analysis of recombinant protein invA from Salmonella pullorum

M.蛋白质分子标准Marker;1~4.重组质粒转化菌分别经IPTG诱导0,2,4,5 h的表达产物M.Protein molecular standard Marker;1-4.Expression products of the recombinant plasmid transformed for0,2,4 and 5 h by IPTG图6 鸡白痢沙门氏菌invA重组蛋白的SDS-PAGE分析Fig.6 SDS-PAGE expression profile of recombinant protein invA from Salmonella pullorum
2.5 invA重组蛋白的Western-blot分析
Western-blot结果表明,在大肠杆菌BL21(DE3)中经诱导表达的产物在51 ku处出现了特异性的抗体结合带(图7),表明invA重组蛋白表达正确,与沙门氏菌阳性血清有较好的免疫反应性。
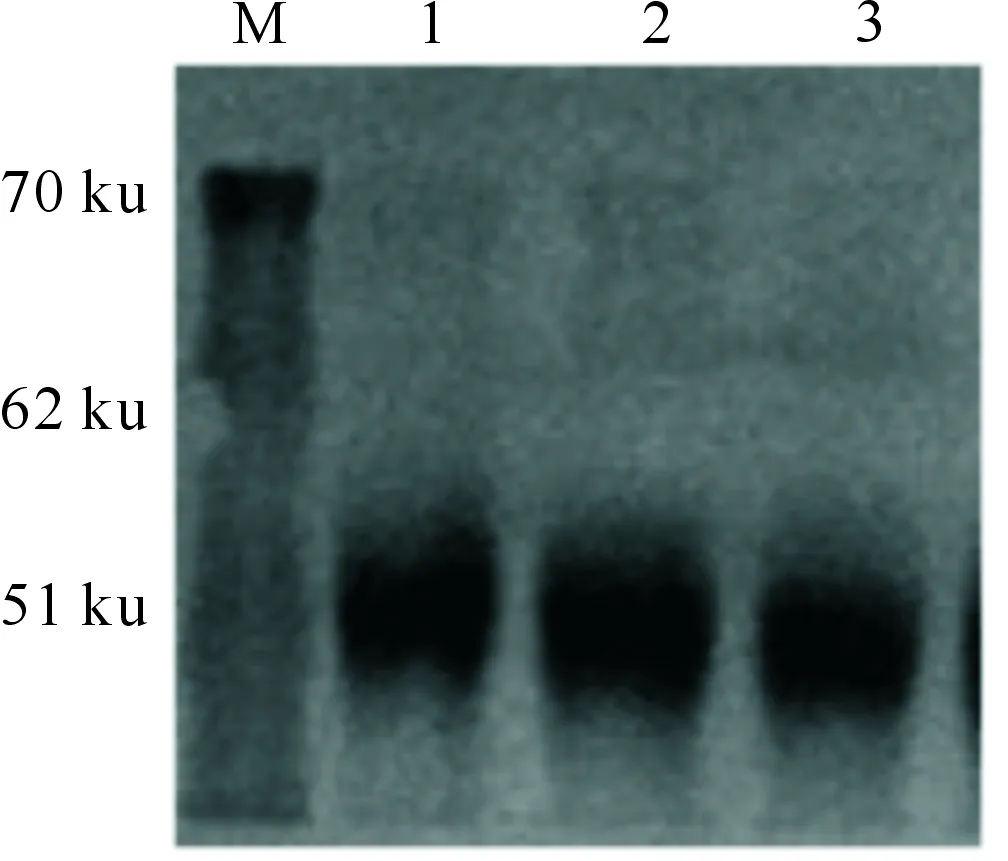
M.蛋白质分子标准Marker;1~3.invA重组蛋白M.Protein molecular standard Marker;1-3.invA recombinant protein图7 鸡白痢沙门氏菌invA重组蛋白的Western-blot分析Fig.7 Western-blot analysis results of recombinant protein invA from Salmonella pullorum
3 讨 论
随着现代养鸡业集约化饲养规模的扩大,鸡白痢沙门氏菌的传播和耐药性变得越来越复杂。到目前为止,已报道的沙门氏菌属大约有2 500个不同血清型,而99%以上的血清型为肠道沙门氏菌[9-10]。病鸡和带菌鸡是鸡白痢的主要传染源,因卵巢带菌,故携带病原的种鸡可以经种蛋垂直传播,进而导致该病在鸡场中难以彻底净化。发展中国家的禽肉消费总量占世界肉类消费量的30%左右,而被沙门氏菌污染的家禽产品始终高居榜首,人感染后常常可以造成急性胃肠炎、败血症和中毒等症状[11-13]。所以探索鸡白痢沙门氏菌病的致病机制、研发快速诊断产品,对该病的预防和控制有重要意义。
国外关于鸡白痢沙门氏菌的研究主要集中在疾病的诊断方法上,例如胶体金、酶联免疫吸附实验(ELISA)、LAMP和qPCR等方法[14-17],国内仅限于对该病原的分离及耐药性方面,而对于该病的发病机制和毒力基因的研究报道较少。在沙门氏菌侵袭过程中,多种毒力因子的共同存在是沙门氏菌致病的关键性因素,其中较为重要的毒力因子包括脂多糖(LPS)、毒素、鞭毛和毒力质粒等[18]。invA基因广泛存在于沙门氏菌染色体上,是沙门氏菌SPI1毒力岛中最重要的编码基因,与该菌的毒性质粒共同发挥作用,其编码的invA蛋白有助于病原体在动物体内定殖、移行和营养吸收,进而造成机体细胞损伤引起发病。同时,invA蛋白还可以刺激机体产生相应的抗体[19]。本研究以鸡白痢沙门氏菌野毒株作为供试菌,克隆获得了invA基因的DNA片段,通过DNA序列信息,对该基因编码的蛋白进行生物信息学预测,发现invA蛋白的二级结构主要属于α-螺旋、β-转角,还有少部分的无规则卷曲参与,主要靠氢键来维持其稳定性;invA蛋白有信号肽,但能否分泌到细菌体外发挥作用,尚待进一步证实;invA蛋白有17个抗原决定簇,提示它有良好的抗原特性。进一步将invA基因进行原核表达,亚克隆到pET-30a表达载体上,发现该重组蛋白一部分存在于重组细菌裂解的上清液中,还有很大一部分以包涵体的形式存在。Western-blot结果显示,invA蛋白和沙门氏菌野毒株阳性血清呈阳性反应,具有良好的免疫反应性,可作为候选的血清学诊断抗原,但是否可以作为最理想的抗原识别区域以及亚单位疫苗还有待进一步研究。
本研究通过原核表达成功获得了鸡白痢沙门氏菌的invA重组蛋白,对其免疫反应性进行了验证,并用生物信息学技术对其功能和结构进行了分析,为今后鸡白痢沙门氏菌相应的诊断抗原和亚单位疫苗的研发奠定了重要的理论基础。

