一种专用于双能CT测量电子密度的体模原型
陈婷,王建杰,金浩宇
1.广东省食品药品职业技术学校 医药工程系,广东 广州 501663;2.陆军军医大学 生物医学工程学院,重庆 400037;3.广东食品药品职业学院 医疗器械学院,广东 广州 510520
引言
从CT图像中获得电子密度信息,是X(γ)射线放疗治疗计划设计的基础。由于X射线衰减系数与射线能量、物质的电子密度和有效原子序数有关,CT值与电子密度之间并不存在一一对应的关系。所以,采用电子密度体模实现的传统CT模拟所得到校准曲线本质上是基于分段线性假设的映射关系。体模等效材料的数量和元素组成决定所分线段的数量及其边界取决于,直接影响电子密度的准确性和可靠性[1-4]。Vanderstraeten等[5]多中心的实验结果表明,传统CT模拟在放疗临床应用中所产生的剂量计算误差超过10%,在头颈部等复杂部位甚至达到40%。
双能CT(DECT)同时采集两组不同能谱X射线的投影数据,理论上能够准确获得电子密度和有效原子序数[6]。医用CT的球管产生的是广谱X射线,射束硬化效应导致衰减系数不规则变化,严格解析计算电子密度和有效原子序数是很困难的[7]。为此,Saito[8]提出了DECT测量电子密度的简单线性模型,特点是无需先验获得球管产生的X射线的谱信息,易于实现。体模实验表明存在CT值对的减权计算与电子密度有极高的线性关系,测量误差低于2.5%[8-10]。比较研究发现,采用不同技术的DECT和不同的体模,测量结果接近,证明了方法学的可靠性[11-12]。
与传统校准法不同,DECT模拟直接从一对CT值中求解组织参数,体模的作用是为了确定数学模型的系数。所以我们认为,DECT模拟应采用不同的体模。从测量学角度,既然DECT模拟是为了得到体内的电子密度信息,那么只要电子密度已知的物质理论上均可以作为体模材料。本文的目的就是提出专用于DECT模拟的体模原型。
1 材料与方法
1.1 体模
以中位数以下原子序数为主的人体组织与医用千伏X线的相互作用的主要形式为光电吸收和康普顿散射。其中,对于较低原子序数物质,康普顿散射占比较高;对于较高原子序数物质,光电吸收占比较高。对于同一物质,当X线能量增加时,康普顿散射占比增加;反之亦然。所以,体内任意组织在辐射衰减效应上总可以等效为一定比例的两种基质,如碘和水,它们与X射线的相互作用分别以光电吸收和康普顿散射为主。
大部分软组织以H、C、O为主要元素,所以选择水和乙醇作为康普顿散射基质,后者的元素组成接近脂肪组织;碘的原子序数较高,具有较大的k边缘(33.2 keV)而常用作对比剂材料,且少量存在体内,所以选择作为光电吸收基质。将纯碘晶体溶于无水乙醇,配制浓度为0、2、4、6、8、10、12和14 mgI/mL溶液,封装于直径约15 mm×150 mm聚乙烯(PE,密度为0.95 mg/mL)试管中,分别标记为1~8;将碘比醇注射液(XENETIX@300,法国加柏GUERBET)用蒸馏水稀释,配制浓度为0、2、4、6、8、10、12和14 mgI/mL溶液,封装于同样的试管中,分别标记为9~16。封装过程注意避免气泡残留。对于已知的混合物,相对电子密度(Relative Electron Density,RED):

其中,ρ为质量密度,NA为阿伏加德罗常数6.022×1023,ci、Zi、Ai分别表示某种组成元素的质量份额、原子序数、质量数。
衬底为水等效材料的CIRS 062电子密度体模由内外两部分组成,分别有9个和8个同轴的圆孔,用于放置不同的等效组织插件和不同溶液。为便于区分,圆孔放置溶液称之为“自制体模”。
1.2 CT扫描
在Siemens SOMATOM Definition Flash扫描仪上,小心摆放体模使中心线与扫描野中心重合,选择常用上腹部协议,先后执行常规螺旋扫描和双能扫描。前者的参数设置如下:120 kVp,管电流参考值210 mAs并勾选CARE Dose4D,准直器宽度128×0.6 mm,螺距0.6,机架旋转周期0.5 s。为便于比较,后者选择两组扫描协议,其参数设置如下:A、B球管电压80/140 kVp/Sn,管电流参考值461/178 mAs,勾选CARE Dose4D,准直器宽度2×40×0.6 mm,余与前同。重建图像选择同样的层厚(5 mm)和卷积核(D30f)。
螺旋单能扫描双能扫描的容积CT剂量指数(CTDIvol)分别为9.80 mGy和11.10 mGy。
1.3 图像分析
在CT图像中,对插件(等效材料或溶液)选取直径约1 cm、包含200左右个像素点的圆形感兴趣区(Region of Interest,ROI)并尽量使之居于目标图像的中心,计算并记录CT均值和标准差。对于DECT图像,根据Saito提出的算法,定义:

其中,下标H和L分别对应于管电压为高和低的图像CT值;w为权重,与采用的CT扫描仪和扫描参数有关,通过体模实验确定。假设相对电子密度与ΔHU存在线性关系:
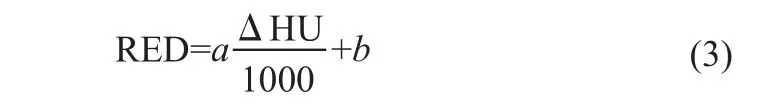
其中,a、b为拟合方程系数。理论上,由于水和空气的CT值分别定义为0和-1000,a=b=1。待定系数的计算过程如下:先通过线性拟合的可决系数r2的极大值确定对于的w值,a和b也随之确定。这样,RED测量值可写成:

2 结果
2.1 120 kVp图像CT值与RED的关系
120 kVp图像CT值与电子密度的关系,见图1。从图1看出,CIRS 062体模的等效材料模拟软组织,RED多集中于1附近。当RED处于(0,1)区间,与CT值呈线性关系;当RED大于1时,CT值突然增大,连线的斜率也随之变化。

图1 120 kVp图像CT值与电子密度的关系
碘水和碘乙醇溶液的RED与CT值分别呈高度线性正相关关系(r2分别为0.9988和0.9977),但总体而言,二者显然没有确定关系。对于特定的CT值,存在两种浓度不同的溶液与之对应,它们的RED不同。例如,50 HU对应于浓度分别为1.90和11.61 mgI/mL的碘水和碘乙醇溶液,RED分别为0.83和1.00。同理,对于特定的RED,存在两种浓度不同的溶液与之对应,其CT值不同。
2.2 RED-ΔHU的线性关系
80/140 kVp/Sn条件下RED-ΔHU线性可决系数r2随权重系数w的变化,见图2,对于CIRS 062体模和自制体模,线性拟合的可决系数r2随w呈抛物线变化。虽然开口大小存在明显差别,但是两个顶点的坐标接近。也就是说,当w的值在小范围内变化时,r2最大值均大于0.99,线性关系不会受到影响。实验结果显示,在顶点位置w值分别为-0.447和-0.428。如果交替把它们代入抛物线,即对CIRS 062体模,把w值从-0.447换成-0.428,r2值为0.9932,仍然大于0.99;对于自制体模,r2值降为0.9918,也仍然大于0.99。

图2 80/140 kVp/Sn条件下RED-ΔHU线性可决系数r2随权重系数w的变化
线性模型的其它系数取值,见表1。a和b的值因采用的体模不同存在微小差别,但都接近1。按照公式(4)计算,水和空气的RED测量值显然存在偏差,其中CIRS 062体模实验结果为0.983和-0.009,自制体模的为1.004和0.012。

表1 体模实验确定的Saito线性模型系数比较
两组体模实验的误差分析结果,见图3。其中,CIRS 062体模实验的最大误差1.75%,出现在吸气末肺组织等效材料;而自制体模实验的为-1.31%。

图3 80/140 kVp/Sn条件下RED的测量误差
3 讨论
放射成像存在辐射伤害,所以相关研究普遍采用体模。DECT确定组织参数的研究无一例外都采用了组织等效体模,如CIRS 062和Gammex 467。这种体模的特点就是准确模拟体内的主要组织和器官,比如肌肉和肝脏,所以RED度多集中于1附近,与水相当。Saito算法的基础是ΔHU和RED的线性关系,所以DECT可理解为测量RED的工具。从测量学的角度,体模没有必要模拟体内组织,而只需RED已知即可。本文采用与千伏级X射线相互作用分别以康普顿散射和光电效应为主的水、乙醇和碘配制得到RED不同的溶液,制成原型体模。实验表明,自制体模实验确定的线性模型系数与CIRS 062体模的接近,二者间RED的测量误差也在同一数量级,与相关文献报道一致。
比较实验证明,自制体模可以替代放疗临床常用的组织等效体模,确定Saito模型的系数。实验中,如果把CIRS 062体模的数据代入自制体模实验确定的模型中,RED测量误差没有显著变化,最大误差为1.76,仍然出现在吸气末肺等效材料。同样,如果把自制体模的数据代入CIRS 062体模实验确定的模型,RED测量误差为-1.33%,结论一致。另一方面,因体模不同而确定的Saito模型系数的微小差异,不会显著影响RED测量结果的准确性。这也正说明了该方法的稳定可靠性。
对Saito线性模型可以简单理解为:较高能量的X射线与物质相互作用以康普顿散射为主,较低能量的X射线与物质相互作用则以光电效应为主;通过减权运算去掉较高能量的CT值中的光电效应成分,剩余康普顿散射成分自然就与电子密度成正比。但是,实际上千伏级X射线与物质相互作用并非这么简单,减权运算是个近似过程。这是系统误差的主要来源。其次,CT扫描仪和选择的扫描参数会影响图像图像质量,导致测量误差。医用CT采用球管产生广谱X射线的特点决定了CT值不存在绝对真值。实际上,同样标称120 kVp的两只不同球管的X射线谱是不同的。在扫描参数中,除了千伏以外,mAs决定了图像白噪声水平,间接影响CT值。
组织等效体模准确模拟体内组织,不但对密度、电子密度和元素组成等理化特性有详细规定,而且要求高度的均匀性和稳定性,所以工艺难度高[13]。对于密度和电子密度很低的肺组织,用固体合成材料模拟尤其困难,导致成品价格高昂。更重要的,这样的物质可能本身存在缺陷,已经有文献质疑它的均匀性和稳定性。有可能这也是导致RED测量误差的原因。本研究结果提示DECT体模无需模拟特定的组织,那么实现就会容易得多。在体模设计合理的条件下,有可能更加客观准确地评价测量方法的可靠性和准确性。
随着CT技术的不断发展和普及应用,DECT因独特的物质定量分析能力在肿瘤良恶判断、血管成像、结石分析和抑制金属伪影体现明显优势。尽管到目前为止,DECT应用于放疗尚处于研究阶段,但是文献报道预示了乐观的前景:DECT可以显著去除金属伪影,更加准确地确定肿瘤靶区的边界;更重要的,它可以准确测量组织参数,包括电子密度、有效原子序数和电离阻止本领,从而提高治疗计划设计的剂量计算的准确性,最终达到精确治疗的目的[14-15]。未来的DECT模拟需要解决许多的问题,比如扫描协议的设计。其中,体模研究显得尤为重要。它不仅决定整个测量系统的性能,而且也可用于评价系统的性能,这在现行的质量检测标准中尚未涉及[16]。
研究工作也存在不足。首先,溶液配制过程难免存在误差,RED的标称不可能完全的准确。其次,所配溶液的RED分布不合理。可以推测,溶液品种越多,系统误差将越大。如何设计体模使得RED合理分布足以真实反映系统性能,是下一步工作重点。还有,溶液易发生挥发、沉淀和变性等,不利于长期稳定,只有采用固体材料才具有实用性。