乳腺包裹性乳头状癌的超声、MRI影像特征*
1.广东省妇幼保健院放射科(广东 广州 510010)
2.广东省妇幼保健院病理科(广东 广州 510010)
3.广东省妇幼保健院超声科(广东 广州 510010)
陈园园1 王 霞1 饶 金2潘云祥3 张 嫣1
乳腺包裹性乳头状癌(encapsulated papillary carcinoma)是一种少见来源于上皮的恶性肿瘤,典型的病理特征是肿瘤周围有纤维包囊,病灶缺乏肌上皮成分,以乳头状癌病灶位于扩张积液的导管内为特征,发病率占乳腺恶性肿瘤的0.5%-2%,该病好发于中老年女性,临床预后良好[1]。超声、MRI及X线是乳腺常用的三种检查方法,本院自2013年1月至2017年11月其间经病理证实仅5例,只有4例具有相对完整的影像资料,包括4例超声影像,3例MRI影像,乳腺X线检查均在外院,因此本研究对该病的超声及MRI影像特点进行回顾性分析,结合文献报道,以提高对本病的认识及诊断水平。
1 资料与方法
1.1 临床资料收集广东省妇幼保健院2013年1月至2017年10月共4例在我院行手术或穿刺病理证实为EPC的病例,4例有完整的超声图像资料,3例行MR检查。所有4例均为女性患者,年龄分别为49岁、70岁、72岁、79岁,平均年龄为67.5岁。左乳3例,右乳1例。病灶大小2.1cm、2.3cm、4.0cm、5.9cm,平均为3.6cm。4例均为无明显诱因出现乳房肿块就诊,病史长度介于10天到2年,其中1例为一年前发现肿块,近几个月发现肿块明显增大,其中1例为2年前发现左乳8点肿块(EPC),1年前左乳外上2点新发肿块(浸润性导管癌)就诊。触诊病灶均边界不清,活动性差,质稍硬,均无乳头溢液,无红肿热痛,无外伤。
1.2 仪器与方法
1.2.1 超声检查方法:采用日立 HITACHI HI Vision Preirus及Aloka prosound-SSD4000彩色多普勒超声诊断仪,高频线阵探头,频率5~13MHz。对患者行双侧乳房及腋窝常规超声检查。
1.2.2 乳腺MRI检查方法:采用1.5T乳腺专用磁共振AURORA,患者俯卧位,双乳自然下垂,常规预扫后行双乳横断位平扫加增强扫描(Spiral Axial B):层厚1.125mm,TE 5ms,TR 29ms,FOV:36×36,矩阵:360×360×128。动态增强前先行Spiral平扫蒙片,然后由高压注射器经手背静脉团注方式注入造影剂GD-DTPA,剂量为0.2mmol/kg,注射速率2.0ml/s,并注入等量生理盐水,即刻连续4回合增强扫描。扫描结束,自动重建并传至医生诊断工作站AURORA-CAD。显示包括多期扫描的MPR、MIP及减影图像。
1.3 资料分析
1.3.1 超声分析:观察肿块大小、形态、边缘、内部回声、有无微钙化、后方回声、腋窝淋巴结、肿块内部及周边的血流分布,并记录各项超声表现及数据,按照美国放射学会超声BIRADS 分级标准[2]书写超声检查报告。
1.3.2 MRI分析:评估参照美国放射学会提出的乳腺影像报告和数据系统I[3-4],平扫分析病变的信号强度,增强后分析病变的大小、形态、边界、内部强化特征及时间信号强度曲线(timesignal intensity curve,TIC)。病灶的形态描述包括圆形、卵圆形、分叶状、不规则形,边界清楚或欠清,病灶内部强化分为环形强化、非环形强化。TIC曲线选取病灶强化最明显的实性部分作为感兴趣区(region of interest,ROI),不少于3piexl,TIC分为3型:Ⅰ型:渐进型,在观察时间内信号强度持续上升;Ⅱ型:平台型,早期快速增强,中晚期信号上升或下降在10%范围内;Ⅲ型:廓清型,早期快速明显强化,达到峰值后信号迅速减低,超过峰值强度的10%。腋窝淋巴结具备以下征象中的2条以上即可疑转移:皮质异常增厚;长径>1.0cm;异常强化;淋巴门结构消失。MRI图像由2名专门从事乳腺影像诊断的放射科医师阅片。
2 结 果
2.1 超声表现4例肿块影,分叶状3例,卵圆形1例,边界清晰3例,不清1例,内部回声均不均匀,后方回声增强3例,后方回声无改变1例,病灶实性形态不规则,其内可见到至少1条血管。
2.2 MRI表现3例肿块,分叶状3例,边界清晰2例,不清1例(病灶周围可见斑片状异常强化),实性成分T1WI呈等高信号,T2WI呈稍高信号,囊性成分T1WI呈高信号,T2WI呈高信号;增强后病灶实性成分明显强化,形态不规则,实性成分TIC为平台型2例,流出型1例,见图1-15。
3 讨 论
3.1 包裹性乳头状癌的概述2003年WHO分类中将EPC作为导管内乳头状癌的一种特殊亚型[5],后病理学研究发现EPC并非完全位于导管内,且缺乏肌上皮,可能是浸润性癌,2012年将EPC作为一种特殊类型的乳腺恶性乳头状病变[6],是浸润性癌的低级别或惰性形式。本病常发生在绝经后中老年女性,也可发生于老年男性,本研究均为中老年女性,平均年龄为67.5岁,本研究中无老年男性的病例,但国内外文献中有个案报道[7-8],研究多认为与中老年男性乳房女性化及雌激素/雄激素比例升高有关。EPC临床表现多以乳房肿块为首发症状就诊,可伴有乳头溢液,触诊肿块活动度欠佳,质地中等偏硬[9],本研究均以乳房肿块就诊,无乳头溢液的病史,触诊与文献报道相仿。
3.2 包裹性乳头状癌的病理特点及US、MRI表现EPC典型的病理表现是以乳头状癌出现在一个明显囊性扩张的导管内,囊壁内衬的细胞为肿瘤性,壁增厚,并纤维化。徐树明等[10]报道5例EPC,强调病灶大部分病灶为单房结构,本研究中3例MRI表现均表现为多房结构,与文献报道出入较大,希望进一步扩大样本量进行研究。在超声表现上,囊壁结构清晰可见,囊壁勾勒出病灶的边缘形态,呈分叶状,在乳头状结构的壁内,可见丰富的血流信号,无乳头状结构的壁上血流信号少。在MRI表现上,囊壁较超声显示更加清晰,囊壁早期明显强化,与周围腺体及囊性成分形态鲜明对比,且无乳头状结构壁呈均匀薄壁表现。
EPC囊腔内多出现血性液体,可见EPC病灶实性成分容易出血。在X线上表现为明确的稍高密度肿块影。在MRI信号特点表现为短T1长T2的出血信号特点,如果有分层现象,MRI常规T1WI、T2WI序列对分层的成分进行界定,位于底部的多为血细胞沉淀,上方多为相对血清液体信号,在超声表现为囊性回声内欠均匀,可伴有细点状强回声,王广珊等[11]报道病灶出血出现分层致使囊内回声复杂时,可以通过改变患者体位进行分析。
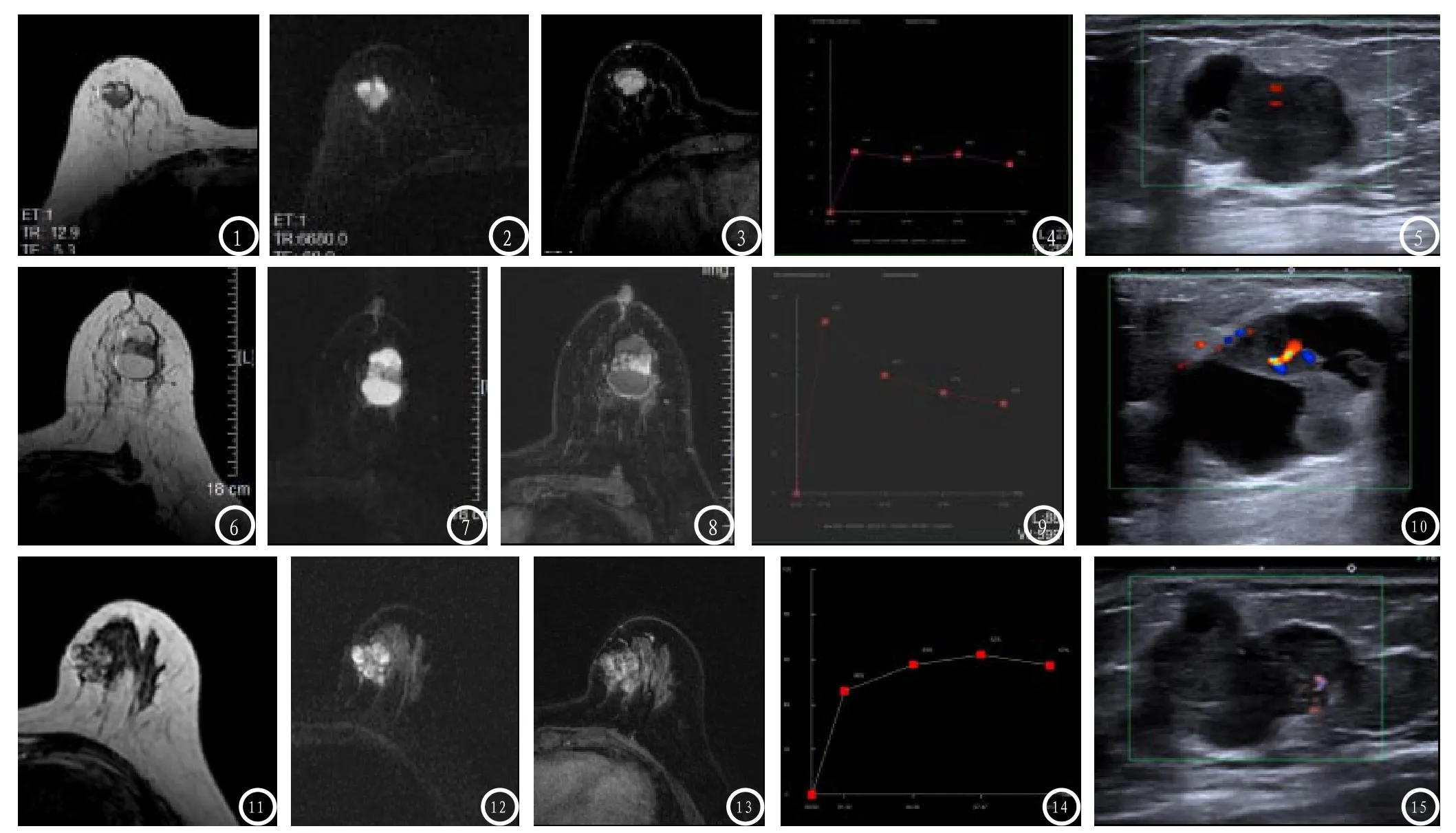
图1-5 病例1,女性,72岁,无明显诱因出现右乳房肿块。图1 T1WI序列显示右乳肿块,实性成分呈等信号,囊性成分呈高信号;图2 T2WI显示实性成分稍高信号,囊性成分高信号;图3 T1WI脂肪抑制序列显示增强后实性成分明显强化;图4 TIC曲线为平台型,早期强化率为35%;图5 超声显示病灶分叶状改变,混合回声,后方回声无增强。图6-10 病例2,女性,70岁,无明显诱因出现右乳房肿块。T1WI序列显示右乳肿块,实性成分呈等信号,囊性成分呈高信号(图6);T2WI显示实性成分稍高信号,囊性成分高信号(图7);T1WI脂肪抑制序列显示增强后实性成分明显强化(图8):TIC曲线为平台型,早期强化率为85%(图9)。超声显示病灶分叶状改变,混合回声,后方回声增强,实性成分可见丰富血流信号(图10)。图11-15 病例3:女性,49岁,左乳内两个病灶,1例为浸润性导管癌(2点方向),左乳内下8点方向为囊内乳头状瘤。T1WI序列显示左乳肿块,呈分叶状,实性成分呈等信号,囊性成分呈高信号(图11);T2WI显示实性成分稍高信号,囊性成分高信号(图12);T1WI脂肪抑制序列显示增强后实性成分明显强化(图13);TIC曲线为平台型,早期强化率为46%(图14)。超声显示病灶分叶状改变,混合回声,后方回声增强,实性成分可见丰富血流信号,实性成分位于囊性成分内(图15)。
EPC病灶周围缺乏间质反应,国内孙琨等[12]报道3例,认为其MRI表现缺乏典型的恶性征象,这可能与病灶的边缘清晰有关。本研究中4例病灶,超声及MRI均表现为病灶大部分边界清晰,虽然合并有IDC或者DCIS,但病灶的边界仍然是大部分清晰,只有部分显示边缘模糊,边界模糊的原因是病灶合并浸润性癌成分,囊壁不规则断裂,癌灶突破囊壁进入周围组织。
EPC病灶多为囊实性的病变,实性的乳头状癌结构在超声及MRI表现上有一定特点。本研究中病灶内多有分隔,实性成分形态不规则,与文献报道相仿。郑雪松等[13]报道1例EPC的超声表现,认为囊内部乳头状结构,壁较厚,乳头内血流丰富是其主要特征。金明花等[14]报道1例,肿块于X线和超声表现上无特异性,但在MRI表现为具有形态学特征,主要表现为囊性液体包裹的肿块,实性成分表现为廓清型曲线。徐树明、王广珊等[10-11]报道16例EPC,强调当囊内实性成分形态不规则、基底部较宽、囊内有或无分隔对诊断EPC有意义,可以作为与导管内乳头状瘤鉴别的依据,
EPC单发多见,可伴有DCIS和IDC[15-17]。本研究中2例病灶MRI检查发现病灶周围可见结节样及斑片状异常强化,结合病理,考虑为浸润性导管癌成分及导管内癌成分;1例病灶经病理证实病灶周围伴IDC,但仅做了US,没有MRI影像资料,无法对病灶周围癌灶进行评价,最后1例病理患乳内可见2个病灶,病理证实一处为EPC,另一处为浸润性导管癌,US检查两个病灶对EPC病灶的诊断不及浸润性导管癌的诊断效能(BIRADS 4b)及(BI-RADS 5),MRI对两个病灶的分级更加准确,均达到了(BI-RADS 5),患者选择乳房全切及腋窝淋巴结清扫,术后2年至今无复发。因此,笔者同文献研究有相同的体会,对于老年女性可疑EPC的诊断时,除了常规超声诊断外,一定要进行MRI扫描,避免漏诊及二次手术。
3.3 包裹性乳头状癌的鉴别诊断①导管内乳头状瘤:导管内乳头状瘤发病年龄小于EPC,超声多囊内突起形态多规则,MRI多表现为沿导管分布的结节样强化,多合并有导管扩张,TIC曲线以廓清型为主[12],虽然部分MRI表现可也可以表现为液体包绕的实性肿块,但体积相对较小,与EPC体积较大可鉴别,且实性成分形态规则可与EPC鉴别。②乳腺囊肿:乳腺囊肿好发于中年女性,超声多表现为低回声肿块影,边界清晰,后方回声增强。MRI表现为长T1长T2信号或者短T1长T2信号,增强后未见强化或壁轻度强化,信号改变主要与囊内容物有关,当蛋白含量高或合并出血时表现为短T1长T2信号。③黏液腺癌:乳腺黏液癌发病年龄较高,与EPC相仿,临床及MRI多表现为肿块,T2WI一般呈明显或不均匀高信号,肿块内可见低信号的分隔(分隔黏液湖的纤维带),增强早期多为轻度环形强化或不均匀强化,延迟有向病灶中心逐渐充填的趋势,TIC平台型及上升型曲线多见,与EPC流出型居多相鉴别,钼靶及超声检查对该病缺乏特征性征象,多表现为边界清晰肿块影,难以做出定性诊断[19]。④叶状肿瘤:叶状肿瘤发病年龄稍小于EPC,发病高峰为30-40岁,肿块深分叶形态、多结节融合的改变比较典型[20],病灶内分隔多见,良性叶状肿瘤内囊变成分不多,交界性及恶性叶状肿瘤可有囊变,但无附壁乳头状结构,这些征象均可与EPC鉴别。
本次研究最大的局限在于病例数量少,但是乳腺包裹性乳头状癌的影像学表现具有一定的特点,US及MRI表现多典型,表现为分叶状形态,边界清楚,US表现为混合回声,MRI上的囊内成分短T1长T2信号及囊内的不规则实性结构具有诊断意义。将乳腺超声及MRI影像检查方法相结合,可提高对本病的诊断认识。

