先天性冠状动脉瘘64层CT血管造影的影像学特征及诊断应用
广东省清远市中医院影像科(广东 清远 511500)
李焯洪 范洁银 阮卫锋
先天性冠状动脉瘘(coronary artery fistula,CAF)是指冠状动脉主干或其分支与心腔或大血管(肺静脉、动脉、上腔静脉等)直接相连,从而使冠状动脉血流绕过心肌毛细血管床并产生分流[1]。CAF是一种临床上较为少见先天性疾病,在人群中的发病率仅为0.002%,约占先天性心脏病的0.3%~0.4%[2]。由于缺乏临床特异性表现及检测设备限制,CAF常常被误诊为冠心病[3]。随着影像诊断技术的快速发展,多排CT血管造影(Multi-detector coronary CT angiography,MDCTA)尤其是64排CT(64-MDCTA)的分辨率大大提升,可提供更为全面的心脏及冠状动脉成像[4]。本研究通过回顾性分析12例CAF患者的影像学资料,探讨64-MDCTA在CAF诊断中的价值,以期为临床提供依据。
1 资料与方法
1.1 一般资料选取2012年1月至2017年7月本院收治的12例CAF患者临床资料进行回顾性分析。12例患者中男性8例,女性4例;年龄38~81岁,平均年龄(55.7±9.6)岁。所有入组患者均经手术或冠状动脉血管造影(coronary angiography,CAG)证实为CAF。
1.2 64-MDCTA检查方法采用西门子DfefinitionAS 64排螺旋CT机对患者进行心电门控螺旋扫描,扫描参数:管电流500mA~600mA,管电压120kV~140kV,采用心电门控,球管转速0.35s/r,视野250mm,扫描时间6~7s,准直器宽度64×0.625mm。以5~6mL/s速率静脉注射非离子型对比碘海醇注射液(通用电气药业有限公司),先行小剂量屏气同层动态增强扫描,依据升主动脉根部层面时间-密度曲线判断最佳扫描延迟时间,之后继续注射对比剂并启动冠状动脉增强扫描。采用单扇区或双扇区采集重组数据,应用标准算法进行图像重组。
1.3 图像重组及后处理技术心电门控螺旋扫描结束后,按心动周期的35%~95%相位对原始数据进行横断位重组,并采用AW4.3图像后处理工作站处理重组后的数据,后处理内容包括:容积再现(volume rending,VR)、多平面重组(multi-planar reconstruction,MPR)及最大密度投影(maximum intensity projection,MIP)。所有图像处理、分析均由相同2名高年资影像科医师进行,64-MDCTA诊断结果与手术或CAG对比。
1.4 统计学处理运用SPSS 20.0分析数据,计数资料进行χ2检验,P<0.05为差异显著。
2 结 果
2.1 64-MDCTA与CAG的诊断结果比较12例CAF患者共有22支瘘血管,其中单一瘘道者占41.7%(5/12),多发瘘道者占58.3%(7/12);合并瘘动脉瘤形成者占25.0%(3/12);其中5支起源于第1对角支(first diagonal branch,D1),3支起源于第2对角支(second diagonal branch,D2),2支起源于右侧冠状动脉(right coronary artery,RCA),5支起源于右侧圆锥支(right conus branch,RCB),2支起源于左前降支(left anterior descending artery,LAD),1支起源于左旋支(left circumflex,LCX),3支起源于左边缘支(left marginal branch,LMB),1支起源于左锁骨下动脉(left subclavian artery,LSCA);其中17支流出于肺动脉(pulmonary artery,PA),3支流出于左室(left ventricle,LV),1支流出于左房(left atrium,LA),1支流出于右室(right ventricle,RV)。64-MDCTA比CAG多检测出1支起源于LSCA的瘘血管(后经手术证实),64-MDCTA与CAG诊断其余21例瘘血管的结果完全一致,见表1。值在64-MDCTA各项后处理技术中,VR诊断CAF瘘血管入口的未确诊率为9.1%(2/22),MPR为18.2%(4/22),MIP为54.5%(12/22);VR和MPR未确诊率显著低于MIP(χ2=10.476、6.286,P=0.001、0.012),VR和MPR未确诊率比较无统计学差异(χ2=0.772,P=0.380),见表2。
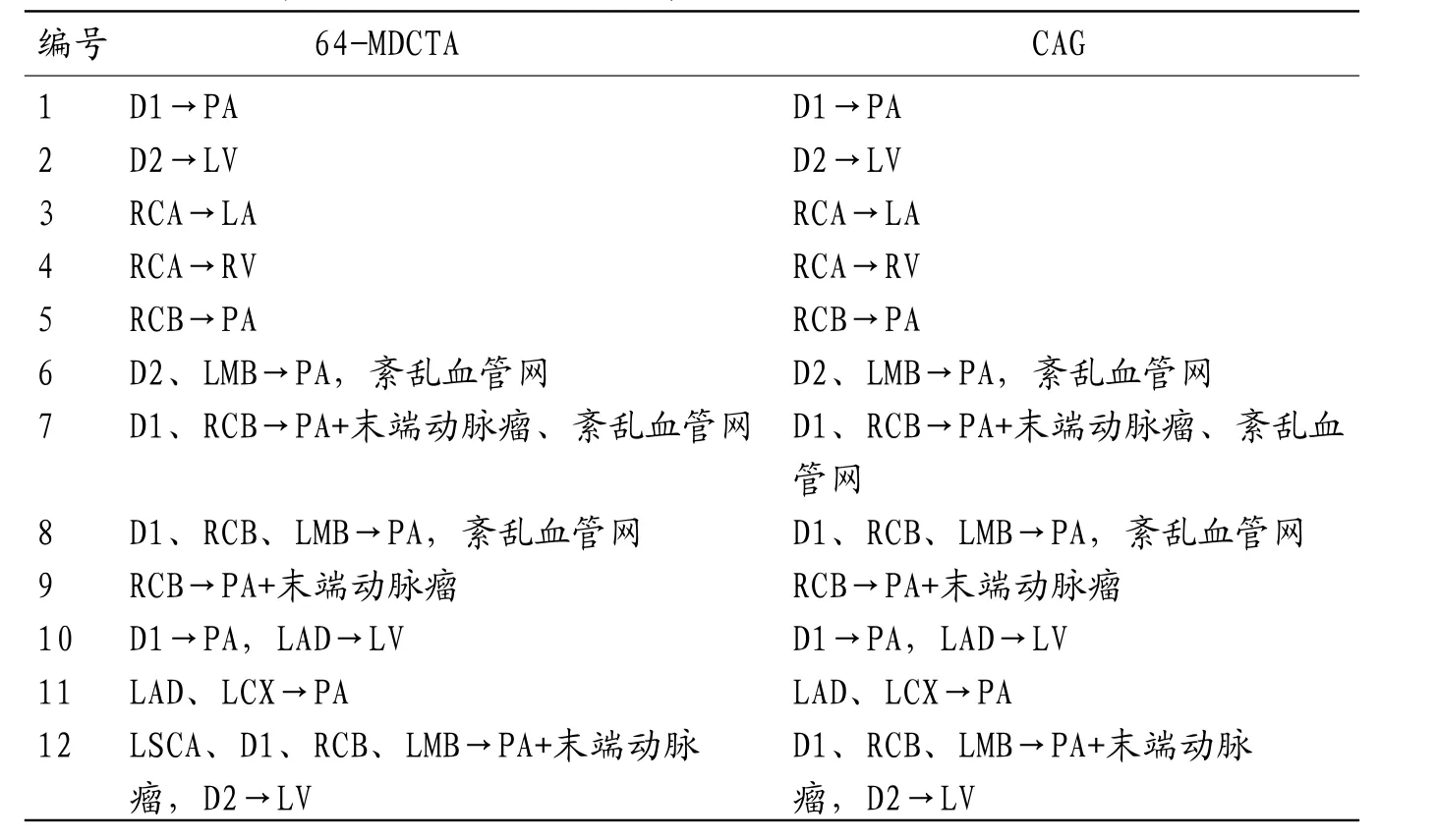
表1 64-MDCTA、CAG诊断结果对比(入口→出口)
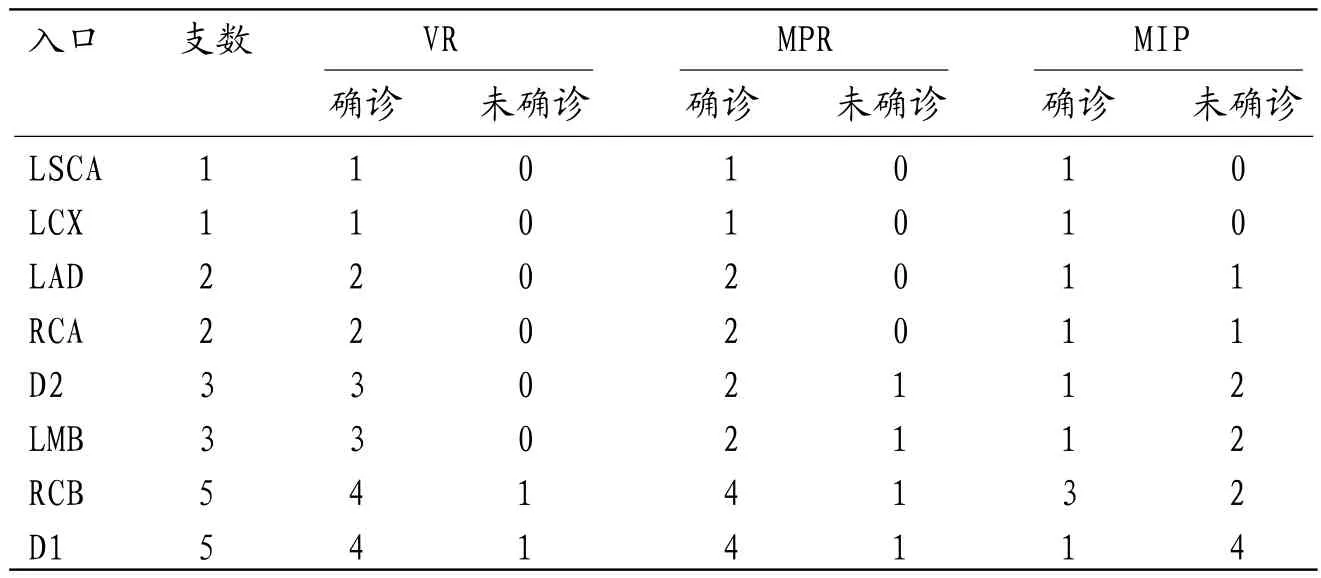
表2 VR、MPR 、MIP 诊断CAF瘘血管入口的价值对比(支)
2.2 64-MDCTA后处理技术诊断CAF瘘血管入口的价
2.3 64-MDCTA后处理技术诊断CAF瘘血管出口的价值在64-MDCTA各项后处理技术中,VR诊断CAF瘘血管出口的未确诊率为13.6%(3/22),MPR为18.2%(4/22),MIP为59.1%(13/22);VR和MPR未确诊率显著低于MIP(χ2=9.821、7.765,P=0.002、0.005),VR和MPR未确诊率比较无统计学差异(χ2=0.170,P=0.680),见表3。
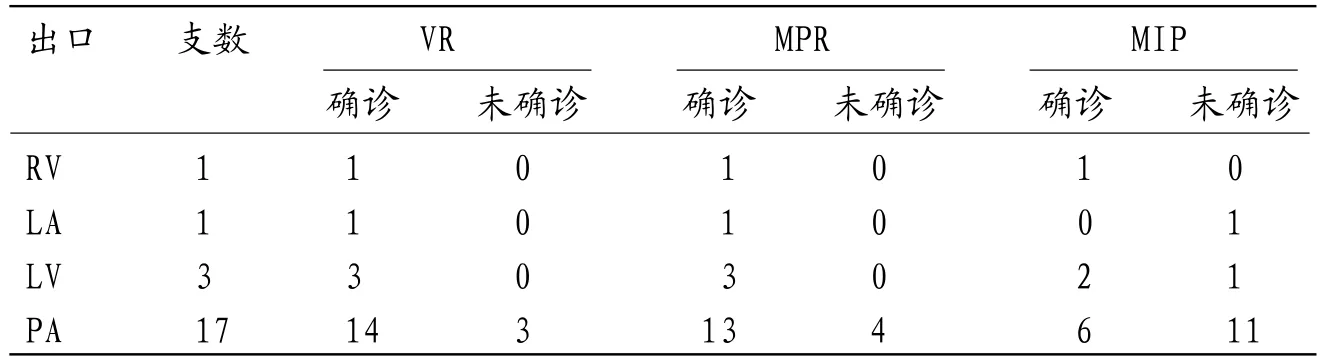
表3 VR、MPR 、MIP诊断CAF瘘血管出口的价值对比(支)
2.4 部分典型病例分析见图1-8。
3 讨 论
临床常用的CAF诊断技术较多,包括CAG、超声技术、磁共振血管成像(magnetic resonance angiography,MRA)及64-MDCT等。CAG是诊断CAF的金标准,但由于其属于二维显像,无法准确显示异常血管复杂的三维立体构造,且具有侵入性[5]。超声技术具有无创诊断的优点,并可准确显示血管内异常,但却无法提供瘘血管的起源、走向及与心脏结构关系等解剖学信息[6]。心脏MRA可显示心腔与瘘血管之间的解剖学信息,提供瘘血管走向、管径、扭曲程度等资料,但心脏MRA空间分辨力有限,对于瘘血管远端出口的显示往往不准确[7]。64-MDCT扫描速度快,时间及空间分辨力强[8],可显示第5级血管,有利于明确瘘血管的形成及其与心腔、冠状动脉的解剖学关系,在CAF诊断中具有良好的应用前景。
CAF缺乏特异性临床表现,部分患者因左向右分流程度加大,窃血征象明显,心肌缺血日益加重,从而出现胸闷、胸痛或呼吸困难等非特异性症状。本组12例患者中,共11例患者因胸闷、胸痛等症状就诊,其余1人为体检发现。本组研究中,12例CAF患者共诊断出22支瘘血管,其中单一瘘道者占41.7%(5/12),多发瘘道者占58.3%(7/12),合并瘘动脉瘤形成者占25.0%(3/12),与刘勇等[9]报道结果相似。本组病例中,77.3%(17/22)的瘘血管流入PA,13.6%(3/22)的瘘血管流入LV,4.5%(1/22)的瘘血管流入LA,4.5%(1/22)的瘘血管流入RV,验证了压力较低的PA是大多数瘘血管流入点的这一观点[10]。本组研究中,64-MDCT检测出1支CAG无法显示的瘘血管,走向为LSCA→PA。分析CAG未确诊的原因,可能为:(1)瘘血管起源于LSCA,超出了正常CAG的造影范围;(2)瘘血管形成了复杂血管网,而CAG仅能准确显示冠状动脉及较大分支,对复杂血管网的显示效果欠佳,从而导致瘘口显示不确定。因此,对于疑似CAF,尤其是多发瘘道形成复杂血管网者,扫描范围应适当扩大,以避免瘘血管的漏查。
本研究发现,在64-MDCTA各项后处理技术中,VR和MPR诊断瘘血管入口和出口的未确诊率均显著低于MIP(P<0.05),而VR和MPR的未确诊率比较无统计学差异(P>0.05)。VR操作可通过容积数据分析,准确显示瘘血管的出入口、走行及其心脏、冠状动脉、周围大血管的关系,但却无法充分显示瘘血管、冠状动脉及心脏的内部构造,当瘘血管出口位于较深处时VR诊断困难[11]。MPR操作可获得原始横断面图像的任意角度重组,准确显示瘘血管的空间位置及其与周围构造的相关性,有利于明确瘘血管的出口及入口,但其所需图像众多,且空间立体感差[12]。在瘘血管入、出口诊断方面,MIP的价值明显差于VR和MPR,但MIP可显示组织之间密度差异,从而明确血管狭窄程度、血管闭塞程度及血管壁钙化情况[13]。因此,临床应联合应用VR、MPR及MIP等后处理技术,才能取长补短,最大程度的避免CAF的漏诊和误诊。
综上所述,64-MDCTA在CAF诊断方面具有良好的价值,值得临床推广应用。
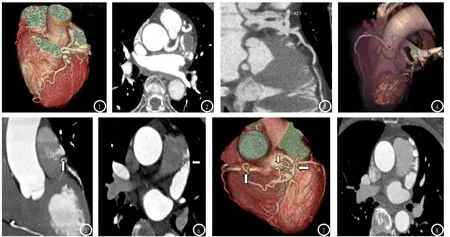
图1-3 左前降支-冠状静脉瘘:VR示左前降支近端分出一支粗大、迂曲的血管与冠状静脉窦相连,冠状静脉窦及右心房室提前显影。图4-6 右副冠状动脉-肺动脉瘘:VR示右副冠状动脉形成,其中一分支迂曲左行注入肺动脉,MIP见造影剂向肺动脉腔内射入,形成“射血征”(白箭)。图7-8 VR图见右冠状动脉圆锥支、左冠窦及左前降支(均为白箭)发出多支较粗大血管,迂曲走行并聚合于肺动脉根部附近,并在靠近前降支端见大动脉瘤。

