H9N2亚型禽流感病毒厦门分离株全基因组的分子生物学特性
蔡振鸿,陈 琼,赵 冉,孔繁德,程小文
(1. 厦门市思明区市政管理中心,福建厦门 361005;2. 厦门市动物疫病预防控制中心,福建厦门 361009;3. 厦门出入境检验检疫局,福建厦门 361026;4. 厦门市动物卫生监督所,福建厦门 361000)
H9N2亚型禽流感病毒属于低致病性甲型流感病毒,于20世纪90年代初传入我国,已在家禽中建立了稳定的传播种系,主要引起感染家禽低死亡率、轻度呼吸道症状及产蛋率减少等症状,并不造成家禽大面积死亡。近年来流行病学调查发现,H9N2亚型禽流感病毒分布广泛,已成为我国家禽感染的主要亚型之一。不仅如此,H9N2亚型禽流感病毒流行株已突破宿主种间屏障,可感染哺乳动物,甚至人。早在1998—1999年,我国香港、广州等地就有4人感染H9N2亚型禽流感病毒的报道。H9N2亚型禽流感病毒在流感病毒的进化、跨宿主感染、致病性及耐药性方面起着至关重要的作用,可为高致病性流感病毒提供内部基因。1997年香港感染人的H5N1,2013年内陆地区感染人的H7N9、2014年感染人的H10N8等亚型流感病毒,均有部分内部基因来源于H9N2亚型禽流感病毒[1-3]。
尽管目前并没有H9N2亚型禽流感病毒人传染人的报道,但此病毒的分布和宿主范围较广,病毒流行率高、变异和进化速度快,加之我国家禽饲养方式复杂,家禽与人群接触密切,发生病毒交叉感染的概率非常高,存在演变进化成导致大流行的新型流感病毒潜能。因此,本研究在对厦门市H9N2亚型禽流感病毒流行病学调查的基础上,选取2株2015年禽源分离株进行全基因测序,分析其遗传进化特点、关键基因位点变异情况,旨在进一步了解当地H9N2亚型禽流感病毒流行株毒力特点,为今后科学防控禽流感提供依据。
1 材料与方法
1.1 试剂和鸡胚
核酸提取试剂盒(磁珠法):购自ABI公司;HA、H5、H7、H9荧光RT-PCR试剂盒:购自深圳市匹基生物工程有限公司;One Step RT-PCR Kit:购自宝生物(大连)工程公司;SPF鸡胚:购自北京梅里亚维通实验动物技术有限公司;特异性引物:宝生物(大连)工程公司合成。
1.2 病毒分离鉴定
采集新鲜的咽喉及泄殖腔棉拭子,用磁珠法提取病毒基因组RNA;采用荧光RT-PCR进行HA、H5、H7、H9等亚型的筛查,将H9阳性样品用滤膜法过滤除菌后,接种10~11日龄鸡胚尿囊腔,72 h后收获鸡胚尿囊液;用荧光RT-PCR法再次进行H9亚型验证,将确定为H9阳性的毒株保存备用。
1.3 病毒全基因扩增及测序
应用One Step RT-PCR Kit试剂盒的反应体系,对病毒全基因序列的不同片段分别进行扩增,利用琼脂糖凝胶电泳确定扩增产物条带大小。阳性扩增产物送上海生工生物工程技术服务有限公司测序。
1.4 基因组序列同源性及关键氨基酸位点分析
用Lasergene Seqman软件,对测序结果进行序列拼接,借助Lasergene Meg Align软件进行同源性及关键位点分析,并与H9N2亚型禽流感代表毒 株(A/chichen/Beijing/1994、A/duck/Hongkong/Y280/1997、A/duck/Hongkong/Y439/1997、A/quail/Hongkong/G1/1997、A/chicken/Shandong/6/1996、A/chicken/Shanghai/F/1998)进行比对分析。
1.5 绘制系统发育树
借助MEGA 5.2分析软件,确定毒株8个基因片段的遗传分类情况。
2 结果
2.1 分离毒株鉴定
分离出2株H9N2亚型禽流感病毒:A/chicken/Xiamen/09/2015来源于2015年9月厦门市活禽交易市场,A/chicken/Xiamen/10/2015来源于2015年10月厦门市某养殖场,宿主均为鸡。基因测序HA为H9,NA为N2,确定2株分离株均为H9N2亚型禽流感病毒,全基因序列在GenBank的登录号为MG204043-MG204058。
2.2 HA关键氨基酸位点分析
2株分离株HA开放阅读框序列大小均为1 683 bp。分离株和H9N2亚型禽流感病毒代表株的HA蛋白裂解位点和受体结合位点变化见表1,HA潜在糖基化位点变化见表2,抗原位点与疫苗株之间的变化见表3。HA裂解位点为PSRSSRGL,均无多个连续的碱性氨基酸插入,符合低致病性禽流感特征;裂解位点的第2位氨基酸由非极性氨基酸A突变成极性氨基酸S。分离株受体结合位点为109、161、163、191、198、202、203,氨基酸序列为YWTNTLY,第198位氨基酸突变为T,与A/duck/Hongkong/Y280/1997一致。受体结合位点右侧缘146~150位氨基酸序列为GTSTA,第149位氨基酸突变为T;左侧缘232~237位氨基酸序列为NGLMGR,第235位氨基酸突变为M。第234位氨基酸(相当于H3 第226位氨基酸)由Q突变为L,具有和人流感受体唾液酸-α2,6-半乳糖(SAα2,6Gal)受体结合的特性。2株分离株均有7个潜在糖基化位点,位于29、141、298、305、313、492、551,依次为 NST、NVS、NTT、NVS、NCS、NGT、NGS,与疫苗株F/98比较增加313位点,与BJ/94比较缺失218位点,增加313位点。分离株与目前疫苗株的抗原位点比较发现,7个抗原位点中3个发生突变,位于第216、267、316位点(表3)。

表1 HA 裂解位点和受体结合位点的比较分析
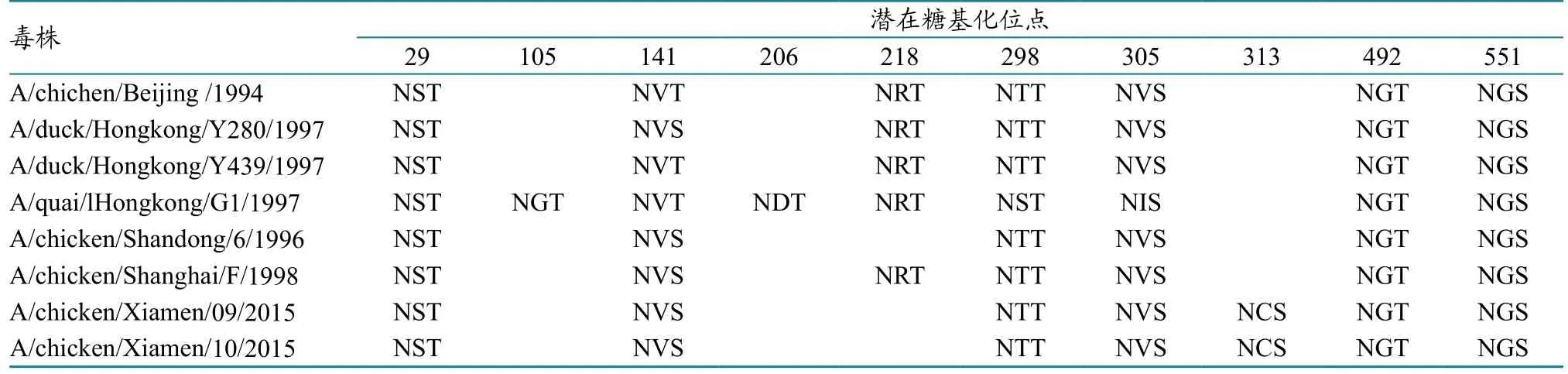
表2 HA潜在糖基化位点的比较分析
2.3 NA关键氨基酸位点分析
2株分离株NA序列为1 401 bp,编码467个氨基酸,颈部均缺失9个碱基,分别编码 63、64、65位氨基酸T、E、I(表4)。2株分离株糖基化位点存在2个位点的差异,分离株A/chicken/Xiamen/09/2015有6个糖基化位点;分离株A/chicken/Xiamen/10/2015有8个糖基化位点,后者比前者多出70和264两个糖基化位点,与BJ/94比较均缺失61和402位点、增加368位点(表5)。HB 位 点 366~373序 列 为 IKNGSRSG,399~404序列DSDDWS,与几株经典株比较,在第368、369、402位点均发生突变,而368、402两个糖基化位点的变化刚好在结合位点上,推测与毒力相关。
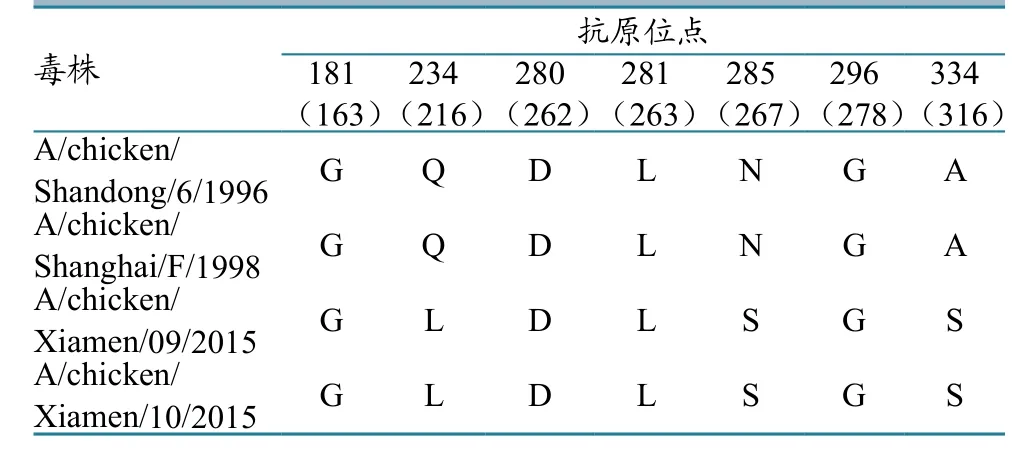
表3 HA抗原位点的分析

表4 NA的HB位点及颈部缺失情况比较分析

表5 NA潜在糖基化位点的比较分析
2.4 聚合酶复合体关键氨基酸位点分析
2.4.1 分离株PB2 序列大小为2 280 bp,编码760个氨基酸。2株分离株PB2中,与毒力相关的627、701、475、253、591、714位点氨基酸无差异,依次为E、D、L、D、Q、S。这些位点与疫苗株SH/F98相同,与BJ/94比较,在591位点发生由D到Q的突变。
2.4.2 分离株PB1 序列大小为2 274 bp,编码757个氨基酸,没有碱基缺失。与毒力相关的第13、113、198、317、678位点依次为P、I、K、M、I。这些位点与疫苗株SH/F98相同,与BJ/94比较,在113位点发生由V到I的突变,317位点发生由V到M的突变。
2.4.3 分离株PA 序列大小为2 151 bp,编码717个 氨 基 酸。A/chicken/Xiamen/09/2015的 第20、55、100、225、268、85、186、336 位点依次为A、D、V、S、L、T、G、L。这些关键位点与SH/F98株相同;A/chicken/Xiamen/10/2015第20、55、100、225、268、85、186、336位点依次为A、D、A、S、L、T、G、L,第100位点发生V到A的突变。
2.5 NP关键氨基酸位点分析
分离株的NP序列大小为1 497 bp,编码498个氨基酸,无插入或缺失变异,仅发生个别点突变。2株分离株与毒力相关的第184、319位点分别为N、N。这些位点与疫苗株和4株标准株比较,未发生突变。
2.6 基质蛋白M关键氨基酸位点分析
分离株M序列大小为982 bp,编码区由M1、M2组成,M1编码252个氨基酸(碱基序列1~759),M2编码97个氨基酸(碱基序列1~26和715~982)。2株分离株M2中与耐药性相关的第27、30、31、37、41、43依次为V、A、N、H、W、L,第31位由S突变为N;与宿主特异性相关的第11、14、16、20、57位氨基酸依次为T、G、E、S、Y,与标准株BJ/94比较第16位氨基酸G均突变为E。分离株M1中与毒力相关第30位和第215位氨基酸分别为30D和215A。
2.7 非结构蛋白NS关键氨基酸位点分析
分离株NS序列为838 bp,其中NS1编码217个氨基酸(碱基序列1~654),NS2编码121个氨基酸(碱基序列1~27和500~838)。NS1蛋白具有两个比较重要的功能区,其中的一个功能区位于分子的羧基端,与香港和国外的绝大部分H9N2亚型禽流感病毒分离株(230个氨基酸)比较,分离株羧基端缺失13个氨基酸,羧基端基序为LSTK,明显不同于高致病性基序ESEV/EPEV和低致病性人源基序RSKV。2株分离株与毒力相关的第39、42、70、71、86、92、149位点依次为D、S、E、E、A、D、A,两株间无差异,与BJ/94及疫苗株比较,未见突变,分离株80~84处氨基酸未见缺失,184~188序列为GFEWN,符合当前国内鸡源H9N2亚型禽流感病毒毒株的典型特征。值得注意的是标准株G1在第92位为E,第185位为L,这两个关键位点与其他标准株、疫苗株及分离株不同。
2.8 遗传演化分析

图1 两株H9N2亚型禽流感病毒厦门分离株各基因系统进化树
2株H9N2亚型禽流感病毒厦门分离株各基因系统进化树见图1。HA基因属于Y280 亚群,NA、NP、NS、PA、PB1基因属于F/98亚群,M、PB2基因属于G1亚群,2株分离株来自3个不同亚群(表6)。A/chicken/Xiamen/09/2015与疫苗株SD/96和F/98的遗传距离为13.1%和11.7%,A/chicken/Xiamen/10/2015与疫苗株SD/96和F/98的遗传距离为13%和11.7%。2株分离株之间的同 源 性为HA 99.4%、NA 98.5%、M 98.7%、 NP 95.7%、NS 98.6%、PA 99.1%、PB1 97.5%、PB2 99.4%。分离株与GenBank上序列比对发现,不仅与近几年的H9N2亚型禽流感病毒分离株高度同源,部分内部基因还与高致病性H7N9亚型流感病毒高度同源。其中A/chicken/Xiamen/09/2015的M基因与A/chicken/Jiangxi/18449/2014(H7N9)同源性高达99.7%;分离株A/chicken/Xiamen/10/2015 NP基因与 A/chicken/Anhui/ 1-YK_RG202/2013(H7N9)同源性高达99%,M基因与A/chicken/Taizhou/TZJF02/2015(H7N9)同源性高达99.8%。

表6 分离株的基因分型
3 讨论与结论
2株H9N2亚型禽流感病毒厦门分离株HA受体结合位点左侧缘均发生Q234 L的突变,使其具有与哺乳动物唾液酸α2-6受体结合的能力,具有向人类感染的嗜性;受体结合位点第198位、右侧缘第149位、左侧缘第235位均发生T、T、M的突变,未见相关报道,生物学特性有待进一步研究;裂解位点为PSRSSRGL,符合近几年主要流行的H9低致病性禽流感毒株特征;分离株218处糖基化位点缺失,同时出现234L、235M突变,值得关注;与目前疫苗株相比,7个抗原位点中已有3个发生突变(位于第216、267、316位),可能会导致目前使用的H9N2亚型禽流感病毒疫苗免疫失败。
NA潜在糖基化位点比较发现,NA第69、86、146、200、234位 相 对 保 守,61、70、155、264、306、368易 发 生 突 变。 分 离 株 A/chicken/Xiamen/10/2015比 分 离 株A/chicken/Xiamen/09/2015多2个糖基化位点,分别位于第70、264位。2株分离株与表5中另外6株标准株比较,糖基化位点均多出368位点,在402位点均存在缺失,唾液酸结合位点HB的第368、369、402位点突变为N、G、D,而368、402两个糖基化位点的变化刚好在结合位点上,推测与这种突变与病毒毒力相关,有待进一步证实。
2株分离株PB2序列相对保守,毒力相关位点未见突变,仍为低致病性禽源病毒特征。PB1蛋白L13P、S678N位点突变能够促进聚合酶亚单位与NP蛋白在新宿主环境中的相互作用,通过对聚合酶活性的调控来影响流感病毒对哺乳类动物的致病性[4]。R198K、M317I位点的变异可以提高对小鼠的致病力[5]。两株分离株均存在L13P、R198K的突变,推测可能对哺乳动物具有感染力。PA蛋白的V100A突变被认为具有人流感病毒及高致病力特征[6]。A/chicken/Xiamen/10/2015株发生V100A突变,可能存在毒力增强的趋势。
两株分离株M1具有30D、215A位点,这两个位点可增加其对小鼠的致病力[7]。M2的V27A、A30T和S31N位点的变异,可导致流感病毒对金刚烷胺类药物产生耐药性[12-13]。两株分离株M2第31位氨基酸S均突变为N,提示分离株已对金刚烷胺产生耐药性。与宿主特异性相关的第11、14、16、20、57位氨基酸与疫苗株和标准株比较,在第16位发生G到E的突变。可见两株分离株的毒力、耐药性和宿主特异性开始发生变化。
NS1蛋白PL基序ESEV/EPEV可作为区别高致病性和低致病性流感病毒的标志之一[11]。NS1氨基酸突变、特殊片段缺失会引起病毒毒力增强,如H5N1亚型禽流感病毒NS1蛋白的P42S突变,可增加病毒对小鼠的致病力。D92E、A149V突变可提高病毒对干扰素的抗性,表现高致病性特征[8]。263~277位的缺失提高了病毒对鸡的致病力[9]。D92E以及80~84 位氨基酸残基的缺失,能增强病毒毒力或提高对细胞因子的抗性,是对哺乳动物高致病性的一个明显特征[10]。本试验的2株分离株与目前国内绝大多数分离株一样,仅有217个氨基酸,C末端缺失高致病性PL基序(ESEV/EPEV)。分离株上述几个关键位点均未发生高致病性突变,第39、70、71和86位氨基酸序列表现为低致病性分子特征。
2株分离株除PB2和NS两个片段序列高度保守,仍表现为低致病性特征外,其余6个片段中与毒力、宿主特异性、耐药性相关的位点均存在不同程度的突变,可见从厦门市分离的这2株毒株,已经出现毒力增强、耐药及感染哺乳动物倾向的进化。遗传进化分析发现,2株分离株均为三重重组体,内部基因M与NP与2013—2015年安徽、江西、江苏(泰州)鸡群中分离的H7N9亚型禽流感病毒高度同源,提示H9亚型与H7亚型流感病毒间存在基因重组风险,H9N2亚型禽流感病毒的流行将对公共卫生产生潜在的安全隐患。
综上所述,加大H9N2等弱毒株与高致病性禽流感病毒毒力相关亚型流感病毒的监测和研究,对禽流感防控十分必要,同时具有重要的公共卫生意义。

