风险管理在药品审评核查机构的应用
施绿燕 张华 金德庄
摘 要 目的:探讨如何在药品审评核查机构开展风险管理,以积极地面对风险,确保实现预期的目标,更有效地管理变更,利用资源,实现良好的内部控制并不断改进。方法:参考英国MHRA风险管理框架,结合上海药品审评核查中心开展风险管理的经验,探讨在药品审评核查机构开展风险管理的策略。结果与结论:深入开展政府风险管理已成为当前的国际趋势,在当前深化机构和行政体制改革,以及深化药品审评审批制度改革的大背景下,药品审评核查机构需要根据自身特点,建立风险管理系统,不断完善内部运行的风险控制机制,同时需要注重切实增强全体工作人员的风险管理意识,提高机构在深化改革的大浪潮中应对风险和把握机遇的能力。
关键词 风险管理 药品审评核查机构 应用
中图分类号:R951 文献标志码:C 文章编号:1006-1533(2018)13-0052-04
Application of risk management in drug evaluation and inspection institution
SHI Lyuyan*, ZHANG Hua, JIN Dezhuang**
(Shanghai Center for Drug Evaluation and Inspection, Shanghai 201203, China)
ABSTRACT Objective: To discuss the strategy for risk management in drug evaluation and inspection institutions so as actively confront risks, ensure that the desired goals can be achieved, the changes can be managed and resources can be used more effectively, and finally to achieve good internal controls and make the improvement to be continued. Methods: The strategy for risk management in drug evaluation and inspection institutions was explored by referring to risk management framework and guideline of MHRA and combining with the experience of our center. Results & Conclusion: Implementation of risk management in governmental institutions has become an international trend, which corresponds to the domestic environment of deepening reform of institutional and administrative system and the review and approval system of drug. Drug evaluation and inspection institutions should establish internal control system based on their business objective and continuously improve their internal operation risk control mechanism, and meanwhile they should pay attention to effectively strengthen the awareness of risk management of all staff and improve the ability of institutions to cope with risks and seize opportunities in the process of deepening reforms.
KEY WORDS risk management; drugs evaluation and inspection institution; application
對于药品监管人员来说,风险管理的概念并不陌生。《药品生产质量管理规范》(2010年修订)中明确要求“应当根据科学知识及经验对质量风险进行评估,以保证产品质量”。事实上,风险管理早就历经多年发展,2005年人用药品注册技术要求国际协调会议(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,以下简称“ICH”)发布的ICH Q9质量风险管理(草案)中就提到“风险管理原则被有效地应用于多个商业和政府领域中,包括财务、保险、职业安全、公共健康、药物警戒以及这些行业的主管部门”,而按照《ISO31000-2018风险管理原则与实施指南》的界定,风险管理是指导和控制组织与风险相关问题的协调活动,可用于任何公共、私有或公有企业、协会、团体或个体的生命周期及广泛的活动,包括战略和决策、运营、过程、职能、项目、产品、服务和资产。
在当前深化机构和行政体制改革的大背景下,完善以风险管理为核心的公共事务活动,有利于实现公共部门职能转变,保证政府机构恰当地应对风险、提高效率和效果、增强行动的合理性和有效地配置资源,推动治理体系和治理能力现代化[1]。
1 英国MHRA风险管理框架简介
1.1 概述
1997年,英国财政部发布《绿皮书:中央政府的评价与评估》,要求政府机构在今后评估不同的项目与计划方案时,将风险与不确定性纳入考虑。2002年11月,英国内阁办公室战略中心发布《风险:提升政府管理风险与不确定性的能力》报告,提供了政府部门应如何看待风险,以及如何更好地做好风险管理的实务步骤指南,并制定了两年的风险管理计划,要求各政府部门落实执行。2003年,英国政府建立了相关的风险管理标准(BS25999)成为英国突发事件风险管理中的通用标准,并在此基础上建立国家风险评估制度,定期发布国家风险登记册[2]。
作为英国药品监督管理部门,英国药品和健康产品管理局(Medicines and Healthcare Products Regulatory Agency, MHRA)的3个主要职能为药品评估和批准,药物警戒和风险管理,以及药品相关法律法规的制定。因此,MHRA的利益相关方涉及医药行业、研究机构、患者、公众、相关行业、卫生部、其他政府部门、欧盟、世界其他组织,以及为MHRA工作的人员等。鉴于业务和利益相关方的多样性和复杂性,MHRA制定了相应的风險管理框架和指南,发展了一套内容相对健全、行之有效的制度。目前,MHRA是世界上公认的最成熟的国家药品监管机构之一,能够对外部各种变化作出积极应对,例如在全球药品监管机构中,MHRA最早颁布了药品GxP数据完整性定义和行业指南。
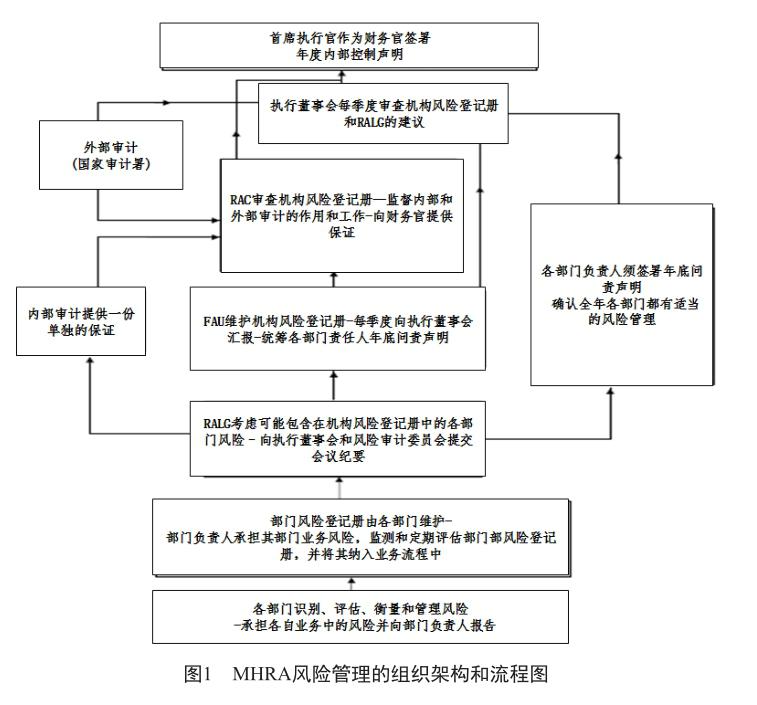
1.2 风险管理组织架构和流程
确定风险管理的组织架构是开展政府风险管理的重要基础。MHRA设立了专门的风险管理统筹规划组织机构,在推动机构风险管理中发挥了重要作用。
MHRA机构风险管理的最高负责人为其首席执行官/财务官,其职责是负责维护一个健全的内部控制系统,以支持机构政策、宗旨和目标的实现。需要注意的是,内部控制制度旨在帮助“风险管理和控制”达到一个合理的水平,而非完全消除风险。MHRA整体机构风险由执行理事会负责管理,各部门负责人负责管理部门业务相关的风险(图1)。
1.2.1 风险与审计委员会(The Risk and Audit Committee, RAC)
1)职责 该委员会隶属于MHRA执行理事会,通过审查机构风险管理相关保证措施的详尽程度、可靠性和完整性,为财务官在风险、控制和监管方面的职责提供相关支持。
RAC应向财务官提供包括:风险、控制和监管的战略过程和内部控制声明;MHRA财务政策、帐目和年度报告,包括在提交审计之前审查账目的程序、查明的错误程度和管理层代表给外部审计官的代表信;内外部审计的计划和结果;管理层对审计确定的问题回应的充分性;与本机构风险管理有关的保证水平;反欺诈政策、举报程序和特别调查安排以及对RAC本身的定期审查的结果等。
RAC每一财政年度至少召开4次会议,所有会议将由RAC主席主持,在其缺席时由委员会选出的副主席主持;秘书处将由会财务官的工作人员组成。开会的法定人数是2名,其中一人必须是主席或副主席,财务官、财务总监、内审负责人、外部审计官的一名代表和一名来自英国卫生部的代表应参加会议。
2) 成员 成员由财务官任命,由机构理事会的3名非执行理事组成,其中一人将当选为主席。执行理事会成员不具备成为风险和审计委员会成员的资格,如有必要可参加委员会会议。主席应确定一个适当的行动方针,从拒绝某一特定业务到终止委员会成员资格。如果主席有利益冲突,副主席应牵头决定适当的行动方针;如果没有足够适当的非执行理事会成员加入委员会,委员会可由财务官授权指派机构以外的人员作为委员会成员,但任期不超过一年。
成员应具备适当的风险、治理和内部控制技能,包括相关财务经验,以便能够参与该机构的财务管理和报告工作;成员应有任职条件,明确规定他们需要什么能力,如何评估他们的业绩和任用期限;成员应主动声明任何潜在的利益冲突,无论是议程上的业务或个人情况的变化引起的利益冲突。
1.1.1 风险与审计联络组(Risk and Audit Liaison Group, RALG)
1)职责 为风险管理和审计问题提供论坛,由该机构所有部门的高级代表参与讨论和监督。职责包括监督风险管理战略,在适当情况下向执行董事会提出建议;通过部门代表定期审核部门风险登记册,部门风险登记册至少每季度由部门管理层更新,包括识别新出现和新类型的风险;讨论特定的部门风险是否适用于整个机构;监督机构风险登记册;通过机构内风险交流,培养风险意识文化;由部门代表提出对国家审计署的审计和内部审计的整改措施,并按计划实施。RALG一般每季度举行一次会议,且每季度向执行董事会和RAC汇报,但若出现重大问题,应尽早进行沟通。
2)成员 RALG由来自机构每个部门的一名高级代表组成,由财务司副司长担任主席。主要成员缺席时则由候补委员出席。部门代表是各部门协调部门内风险及审计事宜的中心联络人。
1.2.2 财务决算组(Financial Accounts Units, FAU)
职责:作为RALG的秘书处,负责提供风险管理支持。从各部门主管处获得风险登记册的最新信息,并根据各部门(通过RALG)、执行董事会和RAC汇报沟通的信息更新风险登记册。
风险登记册需要每季度提供给执行理事会进行审查,并需要在RAC定期会议上汇报。
1.3 MHRA识别的风险
MHRA针对其业务目标,识别的风险包括以下方面:
1)战略与政策方面的风险 即从整体业务战略中产生的风险,包括改变政策,战略制定不正确,战略方向、愿景、价值观未能实现,错过了从创新中获得的机会,不能对变革作出积极反应,声誉受损、地位受到威胁等。
2)人员方面的风险 包括效率低下,技能不足,士气低落、员工失去动力、高人员流动率,缺乏机构形象,缺乏领导/领导混乱,未经授权泄露敏感信息等。
3)合作伙伴和资源方面的风险 包括缺乏资源,未能防范不良行为、浪费,依赖他人或其他组织交付成果,财务记录不可靠,资产受損失或资产使用不当等。
4)流程方面的风险 包括部门无法正常运转或无法提供服务,项目失败,不遵守法律法规,发生重大事故,业务流程不充分等。
5)信息方面的风险 包括关键信息系统发生故障,IT系统不符合组织的需要,信息管理不足够和网络整体瘫痪等。
6)外部风险 包括向公众提供的服务不足,公众对MHRA的信心受损,自然灾害,环境约束等。
2 上海药品审评核查中心风险管理框架简介
2.1 概述
上海药品审评核查中心参考了英国MHRA风险管理框架,以及ICH Q9质量风险管理的指南,结合上海药品审评核查中心机构设置和相关业务的实际情况,建立了风险管理框架。
2.2 组织架构和流程
上海药品审评核查中心从两个层面进行风险管理,即中心层面和部门层面,中心层面的风险是指有多个部门共同存在的风险,有必要在中心层面制定控制措施,由中心风险管理评估组进行管理,而各部门负责人对部门层面的风险管理负责,分别形成中心层面和部门层面的风险登记表。风险登记表主要包括风险类型、风险描述、风险发生可能性和影响、综合风险水平评估、已有控制措施、新增控制措施及责任人、控制措施经验证是否有效等内容。与MHRA不同的是,上海药品审评核查中心为财务管理设有专门的风险管理程序,故目前在中心的风险管理框架中没有包括财务风险管理。
上海药品审评核查中心风险管理评估组的组长由中心分管质量的副主任担任,成员为来自各部门的资深代表。风险管理评估组每半年召开风险管理评估组会议,审核更新中心层面的风险登记表。
上海药品审评核查中心风险管理包括风险评估、风险控制、风险审核、风险交流等环节,这些环节形成一个持续的循环。
2.2.1 风险评估
分为3个步骤,即风险识别、风险分析和风险评价。
1)风险识别 识别的对象为质量方针、质量目标、业务条线和业务流程等,主要采用头脑风暴的方法。
2)风险分析 从风险潜在影响的严重程度和风险发生的可能性两方面进行风险分析。一般从是否是组织的优先目标,是否会导致法律惩罚、导致财政损失,损害与公众、员工、供应商等人或其他组织的关系,参与系统运行的人数,可能受到影响的人员、工作人员和公众的数量以及可能造成财政损失的程度等对风险的潜在影响的严重程度进行分析,从工作人员的配备、变化和波动程度,暴露在超出组织控制之外的外部因素的程度及对其他团体或组织的依赖程度等方面对风险发生的可能性进行分析。
3)风险评价 将风险分析的结果与既定的风险标准进行比较,以判断综合风险水平。综合风险水平分为极高、高、中、低四级。
2.2.2 风险控制
风险控制是为了降低风险至可接受水平或接受风险所做的决策,在进行风险控制时,应考虑投入与风险的重要性相适应。
风险控制的主要措施类型包括:①转移,例如通过保险将风险转移给其他组织;②接受,当管理某些风险的能力有局限,或采取行动的成本可能超过获益,则可以考虑接受此类风险,但需要继续审核剩余风险;③消减,多数风险控制措施属于这一类别,这是通过采取消除风险或降低风险的措施,将风险控制在一个可接受的水平。对待风险的行为也被称为“内部控制”,即通过预防性控制、指导性控制或纠正措施等防止不良事件发生;④终止,某些风险只能通过终止活动来治疗或控制,但在政府部门中,这可能会受到严重限制,因为有许多活动,没有其他方法可以实现公共利益所需要的产出或结果;如果风险是由于组织之外的因素引起的,那么风险应对可能仅限于应急响应计划。
2.2.3 风险审核
风险需要定期审核,根据审核结果对风险登记表进行更新。
2.2.4 风险交流
风险交流是指交换或分享风险管理信息,可在风险管理的任何阶段进行,是增强全体工作人员的风险管理意识的重要措施。风险交流内容可以包括风险的性质、影响的严重程度、发生的可能性、控制措施、审核结果等。
2.3 识别的风险
上海药品审评核查中心识别的风险主要包括以下四个方面:
1)廉政建设 作为政府机构,廉政建设永远在路上,廉政建设需要时时警醒时时抓。
2)人员技能 2015年8月,国务院“关于改革药品医疗器械审评审批制度的意见” (国发〔2015〕44号)提出:“要推进职业化的药品医疗器械检查员队伍建设。”2016年12月29日,在国家食药监总局举行的新聘任国家级药品检查员颁证及宣誓仪式上,毕井泉局长指出:“食药监总局将探索建立以职业化检查员为主体、兼职检查员为补充、专兼结合、一专多能的检查员队伍。”
如何适应新形势下药品监管事业发展的需要,提高药品GMP检查员的检查能力,是摆在所有药品审评核查机构面前的难题。
3)变更管理 在深化机构和行政体制改革,以及药品审评审批制度改革的大形势下,如何积极应对政策改革是药品审评核查机构面对的一大风险。
4)绩效管理 实施绩效管理,能够保证组织恰当地应对风险、提高效率和效果、增强行动的合理性和有效地配置资源[3]。但是如何在药品审评核查机构切实有效开展绩效管理,需要认真研究、不断完善。
上海药品审评核查中心针对所有识别的风险制定了控制措施。
通过风险管理体系的构建与实施,风险管理在上海药品审评核查中心内部控制中得到持续应用,使得人员对于本岗位和本专业工作过程中可能发生的风险有了一个系统、全面、感性的认识,奠定了审评核查工作安全稳定运作的基础,实现了至下而上的纵向应对化解风险的能力,为中心持续有效和谐发展提供了有力的保障,且提升了中心积极面对内外变化的能力和管理工作水平,为实现中心3年规划起到了重要作用。
3 结语
风险管理有利于加强内部建设,也有助于真正做好应对政策改革及各类突发事件的相关准备工作,但风险管理是一项长期、系统的工作,需要不断地改进完善。药品审评核查机构需要根据自身特点,建立风险管理系统,做到有计划、有步骤、有针对性的开展风险管理工作,有效指导实际工作,并不断完善内部运行的风险控制机制,认真研究、分析和评估短、中、长期的风险,继续探索和确定有针对性、科学实用的风险管理流程及方式方法。同时需要注重切实增强全体工作人员的风险管理意识,逐步把风险管理纳入到所有业务和内部控制领域中,提高机构在深化改革的大浪潮中应对风险和把握机遇的能力。
参考文献
[1] 刘乾坤, 张径舟, 姜湘涛. 政府机构风险管理研究[J]. 中国管理信息化, 2014, 17(9): 78-82.
[2] 游志斌, 杨永斌. 国外政府风险管理制度的顶层设计与启示[J]. 行政管理改革, 2012(5): 76-79.
[3] 尹建丽, 于得水. 基于公共部门职能的风险管理绩效评价机制[J]. 合作经济与科技, 2015(5x): 70-72.

