多重PCR检测婴幼儿配方奶粉中3种食源性致病菌
姜 华,焦 阳,李远宏,张金鹏
(徐州医科大学公共卫生学院,江苏徐州 221004)
婴幼儿配方奶粉(Powdered Infant Formula,PIF)是指以牛乳(或羊乳)及其加工制品为主要原料,根据配方加入适量的营养素强化剂和其它辅料加工而成的供婴幼儿食用的粉状食品[1]。由于新生儿及婴幼儿免疫系统发育不完善,食用具有质量安全隐患的PIF将可能导致严重的不良后果甚至中毒,严重时往往会导致死亡[2-3]。
食源性致病微生物是影响PIF安全性问题的一个极其重要的因素。联合国粮农组织和世界卫生组织(FAO/WHO)专家委员会已将克罗诺杆菌(Cronobacterspp.)、伤寒沙门氏菌(Salmonellaenterica)、金黄色葡萄球菌(Staphylococcusaureus)、单增李斯特菌(Listeriamonocytogenes)、肺炎克雷伯杆菌(Klebsiellapneumoniae)、蜡样芽孢杆菌(Bacilluscereus)和鲍曼不动杆菌(Acinetobacterspp.)等20种细菌列为PIF中可能导致婴幼儿致病的细菌[4]。我国食品安全国家标准GB 10765-2010《食品安全国家标准婴儿配方食品》明确规定克罗诺杆菌(原阪崎肠杆菌)、沙门氏菌和金黄色葡萄球菌是婴儿配方食品中必检的3种食源性致病微生物,并且公布了其相应的微生物限量指标[5]。因此,建立一种能够同时检出婴幼儿配方奶粉中克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的检测方法具有重要的公共卫生学意义。
传统检测技术已无法满足政府监管部门和企业快速检测多种致病微生物的需要,而多重PCR技术具有高通量、检测速度较快、灵敏度较高、成本较低等优点,在食源性致病微生物快速检测领域具有广泛的应用前景[6]。然而基于PCR(Polymerase Chain Reaction)技术而建立的各种检测方法往往会产生假阳性结果,其中引物特异性差是产生假阳性结果的重要原因之一[7]。本研究利用通过筛选克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的特异性引物,建立了一种能够准确、快速的实现对PIF中上述3种主要食源性致病菌进行同时检测的多重PCR方法,以期为预防和控制这些食源性致病菌在PIF中的流行,保障PIF安全提供技术支持。
1 材料与方法
1.1 材料与仪器
婴幼儿配方奶粉 荷兰菲仕兰坎皮纳乳品有限公司;标准菌株 共12株,其中4株由南京农业大学酶工程实验室馈赠,6株购自中国工业微生物菌种保藏中心,2株由徐州医科大学环境与健康实验室保存(详细信息见表1);LB培养基(胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠5 g/L) 实验室自配;DL2000 DNA Marker 大连Takara公司;LAmp DNA Polymerase 南京诺唯赞生物科技有限公司;GelRed Nucleic Acid Gel Stain 美国Biotium公司;引物、TE缓冲液、PCR产物回收试剂盒 生工生物工程(上海)股份有限公司。
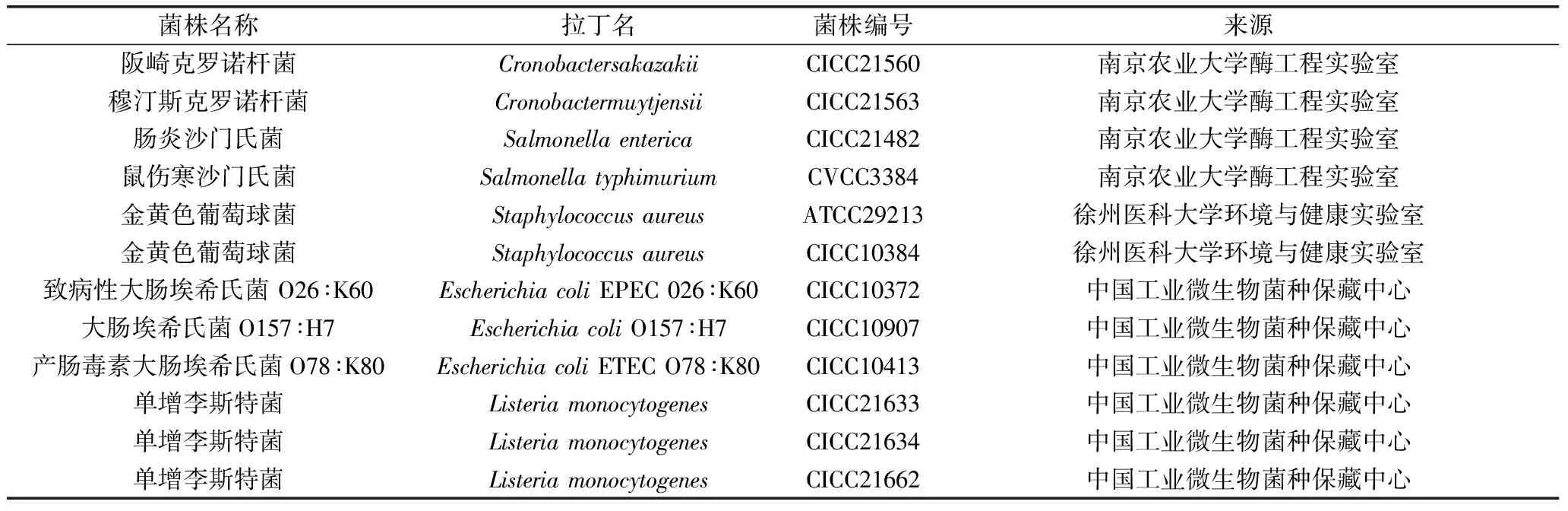
表1 实验菌株Table 1 Strains used in this study
DNP9162型电热恒温培养箱 上海精宏实验设备有限公司;SW-CJ-2FD型超净工作台苏州安泰空气技术有限公司;Veriti 96 PCR仪 美国ABI公司;5418型小型高速离心机 德国Eppendorf公司;Gel Doc XR凝胶成像仪 美国BIO-RAD公司。
1.2 实验方法
1.2.1 基因组DNA提取 采用水煮法[8]提取细菌总DNA,具体操作方法如下:将菌株接种于LB培养基中37 ℃过夜培养。取过夜培养液1 mL于12000 r/min条件下离心5 min,弃上清液,再用1 mL生理盐水洗涤沉淀一次,于12000 r/min条件下离心5 min。弃上清液,加入200 μL含1% Triton X-100(V/V)的10 mmol/L,pH7.6的TE缓冲液重悬沉淀,煮沸10 min后立即放入-20 ℃冰箱冷冻30 min,室温融化后于12000 r/min离心5 min,取上清液用于PCR扩增。
1.2.2 引物合成 通过查阅文献资料,选取9对引物,引物由上海生工生物工程有限公司合成。引物的序列及PCR产物片段长度见表2。
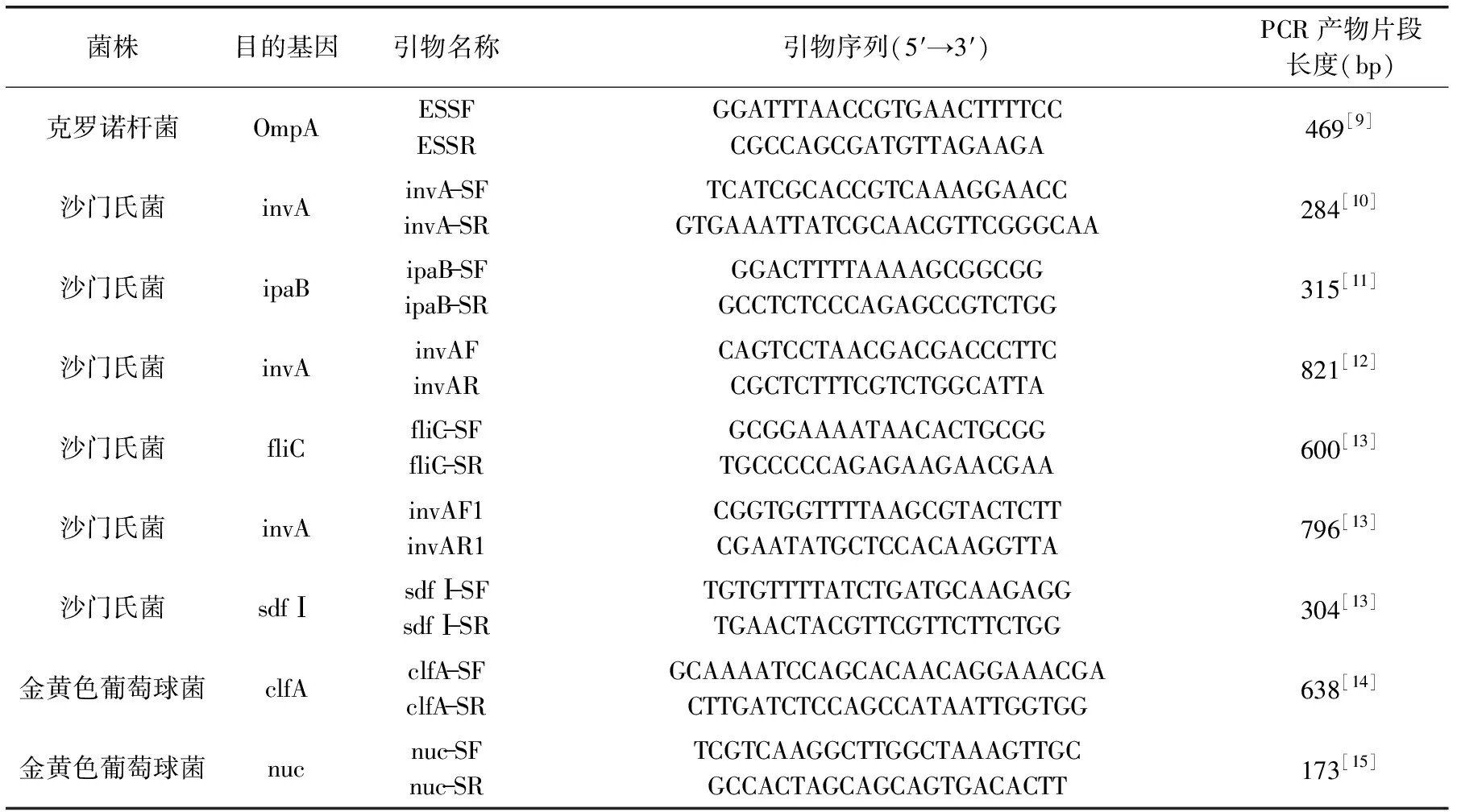
表2 本研究中使用的引物Table 2 Primer sequences used for PCR amplification in this study
1.2.3 单重PCR验证引物特异性 以表3中标准菌株的基因组DNA为模板,分别对上述9对引物进行引物的特异性验证。PCR反应体系:10×LAmp buffer 5 μL,Mg2+浓度1.5 mmol/L,引物各0.2 μmol/L,基因组DNA模板1 μL,5 U/μL LAmp DNA Polymerase 0.5 μL,加双蒸水补足至50 μL。PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸7 min。空白对照为经灭菌处理的双蒸水替代基因组DNA。PCR反应结束后取7 μL反应产物于2%琼脂糖凝胶电泳分析各引物的特异性。
1.2.4 多重PCR条件的确定 以标准菌株阪崎克罗诺杆菌CICC21560、肠炎沙门氏菌CICC21482、金黄色葡萄球菌ATCC29213基因组DNA为模板构建多重PCR反应体系。多重PCR反应基本体系:10×LAmp buffer 5 μL,Mg2+浓度1.5 mmol/L,特异性引物对(OmpA、invAF1和clfA)的上下游引物各0.2 μmol/L,基因组DNA模板各1 μL,5 U/μL LAmp DNA Polymerase 0.5 μL,加双蒸水补足至50 μL。PCR反应基本条件:95 ℃预变性3 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸7 min。在此条件的基础上分别对多重PCR反应的退火温度(51~61 ℃)、Mg2+浓度(0.25~3.00 μmol/L)和引物浓度(100~800 nmol/L)等多重PCR扩增条件进行优化。PCR反应结束后取7 μL PCR反应产物于2%琼脂糖凝胶电泳分析。
1.2.5 多重PCR反应的特异性 以9株标准菌株的基因组DNA为模板,以优化后的多重PCR反应体系及条件进行多重PCR,琼脂糖凝胶电泳观察分析是否有特异性扩增产物以及产物的大小。PCR产物经DNA产物回收试剂盒纯化回收后送至生工生物工程(上海)股份公司测序以验证扩增结果的准确性。
1.2.6 多重PCR反应灵敏度 将菌体浓度均为108CFU/mL(平板计数法测定)的阪崎克罗诺杆菌CICC21560、肠炎沙门氏菌CICC21482、金黄色葡萄球菌ATCC29213的菌悬液混合后进行10倍系列梯度稀释,以煮沸法提取DNA,然后按照优化后多重PCR反应体系进行PCR扩增以确定其灵敏度。
1.2.7 人工污染PIF样品检出限的确定 取25 g经国家标准检测[16-18]的不含克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的PIF,溶于225 mL无菌生理盐水中,分别加入上述3种目标菌使其终浓度达到108CFU/mL,再进行10倍系列梯度稀释至浓度为101CFU/mL。按照煮沸法提取DNA并进行多重PCR检测以确定人工污染PIF样品中多重PCR反应的灵敏度。
1.3 数据处理
PCR扩增产物凝胶电泳图谱均由Bio-Rad公司的Gel Doc XR凝胶成像系统产生,后由Photoshop 7.0进行处理。
2 结果与分析
2.1 引物特异性
以表3中的标准菌株的基因组DNA为模板进行单重PCR扩增以验证引物的特异性,结果如表3所示。由表3可知OmpA、invAF1、clfA和nuc4对引物特异性较好,但由于nuc基因的扩增产物只有173 bp,而易受PCR反应的非特异性扩增条带干扰,不利于获得明确的检测结果。因此,本研究最终选取OmpA、invAF1和clfA 3对引物为多重PCR引物组合。

表3 引物特异性测试Table 3 Specificity of primers used in this study
2.2 多重PCR反应条件确定
2.2.1 退火温度的优化 当退火温度设置为51、53、55、57、59和61 ℃时,多重PCR反应均能扩增出3条特异性目标条带,其中退火温度为55 ℃时特异性目标条带最为清晰(图1)。因此,将多重PCR反应的最佳退火温度确定为55 ℃。
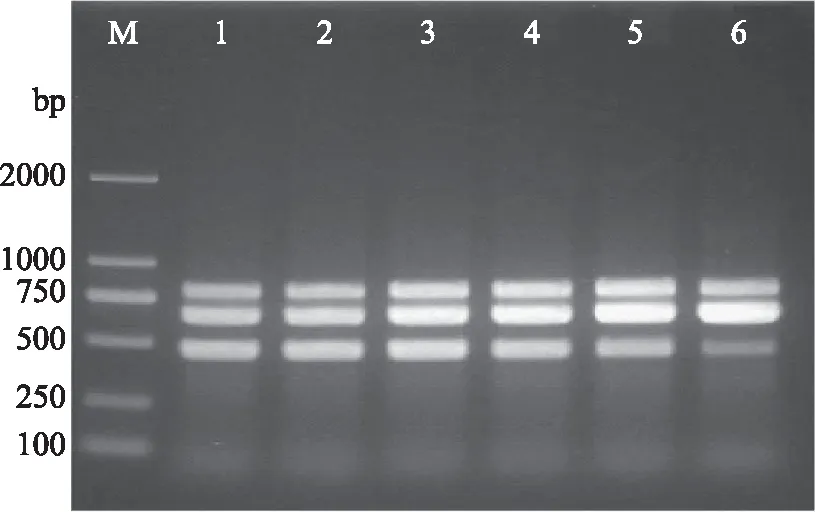
图1 多重PCR反应退火温度的优化Fig.1 Optimization of annealing temperature of multiplex PCR system注:M:DL2000 DNA ladder marker;1~6:51、53、55、57、59、61 ℃。
2.2.2 镁离子浓度的优化 在最佳退火温度(55 ℃)条件下,将多重PCR基本反应体系中Mg2+浓度设置为0.25、0.50、1.00、1.50、2.00、2.50 和3.00 mmol/L时进行多重PCR扩增,并进行琼脂糖凝胶电泳分析。由电泳图谱可知,当Mg2+浓度大于等于1.0 mmol/L时,均可检出多重PCR反应体系中扩增出的特异性目标条带,尤其是当Mg2+浓度为2.00 mmol/L时特异性目标条带最为清晰(图2)。因此,确定多重PCR反应体系的最佳Mg2+浓度为2.00 mmol/L。
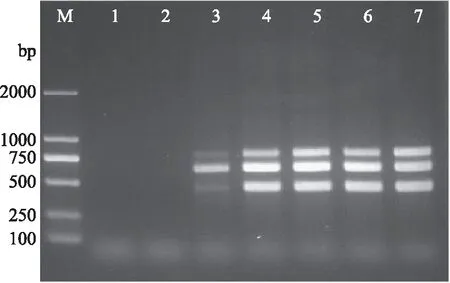
图2 多重PCR反应体系镁离子浓度优化Fig.2 Optimization of Mg2+ concentration of multiplex PCR system注:M:DL2000 DNA ladder marker;1~7:0.25、0.50、1.00、1.50、2.00、2.50、3.00 mmol/L。
2.2.3 引物浓度的优化 在最佳退火温度(55 ℃)和最佳Mg2+浓度(2.00 mmol/L)条件下,将多重PCR基本反应体系中引物浓度分别设置为100、200、300、400、500、600、700和800 nmol/L条件下进行多重PCR扩增,结果表明当各引物浓度大于400 nmol/L后,特异性目标条带均可同时检出且目标条带清晰(图3)。因此,将多重PCR反应的最佳引物浓度确定为400 nmol/L。

图3 多重PCR反应体系引物浓度的优化Fig.3 Optimization of primers concentration of multiplex PCR system注:M:DL2000 DNA ladder marker;1~8:100、200、300、400、500、600、700、800 nmol/L。
2.3 多重PCR反应特异性
为了测试多重PCR反应的特异性,将供试标准菌株的基因组DNA在最优条件下进行扩增,结果如图4所示。阳性对照菌株肠炎沙门氏菌CICC21482、金黄色葡萄球菌ATCC29213、阪崎克罗诺杆菌CICC21560、鼠伤寒沙门氏菌CVCC3384、金黄色葡萄球菌ATCC10384和穆汀斯克罗诺杆菌CICC21563均能扩增出相应特异性基因片段,且无非特异性扩增;而阴性对照菌株致病性大肠埃希氏菌O26∶K60 CICC 10372、大肠埃希氏菌O157∶H7 CICC 10907、产肠毒素大肠埃希氏菌O78∶K80CICC 10413、单增李斯特菌CICC21633、CICC21634和CICC21662以及空白对照均无非特异性扩增(图4),表明本研究建立的多重PCR检测体系具有较好特异性。此外,将PCR产物测序后获得的基因序列在Genbank数据库中进行Blast比对分析,结果表明PCR产物均为对应菌株的目的基因序列,从而进一步证实了扩增结果的准确性。

图4 多重PCR反应特异性测试Fig.4 Specific test of multiplex PCR system注:M:DL2000 DNA ladder marker;1:阴性对照;2:肠炎沙门氏菌CICC21482+金黄色葡萄球菌ATCC29213+阪崎克罗诺杆菌CICC21560;3:肠炎沙门氏菌CICC21482;4:金黄色葡萄球菌ATCC29213;5:阪崎克罗诺杆菌CICC21560;6:鼠伤寒沙门氏菌CVCC3384;7:金黄色葡萄球菌ATCC10384;8:穆汀斯克罗诺杆菌CICC21563;9:致病性大肠埃希氏菌O26∶K60 CICC 10372;10:大肠埃希氏菌O157∶H7 CICC 10907;11:产肠毒素大肠埃希氏菌O78∶K80CICC 10413;12:单增李斯特菌CICC21633;13:单增李斯特菌CICC21634;14:单增李斯特菌CICC21662。
2.4 多重PCR反应灵敏度
利用本研究建立的多重PCR检测体系进行灵敏度实验,结果如图5所示。阪崎克罗诺杆菌CICC21560、肠炎沙门氏菌CICC21482、金黄色葡萄球菌ATCC29213在107~102CFU/mL浓度下均可同时扩增出清晰的条带,而浓度为101CFU/mL时则无清晰的目标条带,因而确定多重PCR反应的检出限为102CFU/mL。

图5 多重PCR反应灵敏度测试Fig.5 Sensitivity test of multiplex PCR system注:M:DL2000 DNA ladder marker;1:空白对照;2~8:107、106、105、104、103、102、101 CFU/mL;图6同。
2.5 人工污染奶粉检出限
利用本研究建立的多重PCR检测体系检测人工污染奶粉中的阪崎克罗诺杆菌CICC21560、肠炎沙门氏菌CICC21482、金黄色葡萄球菌ATCC29213,结果如图6所示。3种目标菌在奶粉中的检出限为103CFU/g。
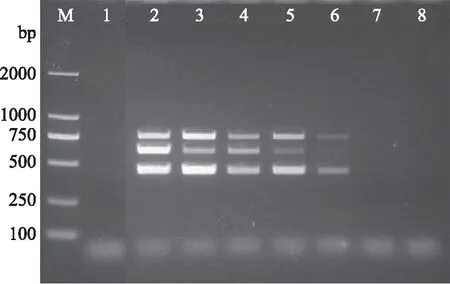
图6 人工污染PIF中主要食源性致病菌的检出限Fig.6 Detection limits of the multiplex PCR for pathogenic bacteria in PIF
3 结论与讨论
本研究建立了一种能够同时检测PIF中克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的多重PCR检测方法,该方法具有检测速度快、特异性好的优点。优化后多重PCR检测体系的最佳退火温度为55 ℃,最佳Mg2+浓度为2.00 mmol/L,最佳引物浓度为400 nmol/L。在优化条件下,多重PCR反应体系可同时检测3种致病菌的灵敏度为102CFU/mL,在人工污染PIF中同时检测3种致病菌的检出限为103CFU/g。食品安全国家标准GB 10765-2010《食品安全国家标准婴儿配方食品》中要求不得检测克罗诺杆菌和沙门氏菌,金黄色葡萄球菌的微生物限量为10 CFU/g[5]。相比较而言,本研究建立的多重PCR检测体系尚无法达到其要求,但可通过增菌培养来提高待检食品中目标菌含量的方法来实现对克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的检测。
近年来,PIF中存在的克罗诺杆菌、伤寒沙门氏菌和金黄色葡萄球菌污染引起了人们的广泛关注[19-21],但是针对克罗诺杆菌、沙门氏菌和金黄色葡萄球菌3种致病菌的多重PCR检测方法尚鲜见报导。此外,本研究采用水煮法提取细菌基因组DNA,具有简便、快速、并可显著降低检测成本等优点。本研究初步建立了快速检测婴幼儿奶粉中克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的多重PCR体系,实现了对3种食源性致病菌DNA的同步快速扩增,为PIF中克罗诺杆菌、沙门氏菌和金黄色葡萄球菌的检测提供了快速、灵敏、特异的检测方法,具有重要的公共卫生学意义。

