新生儿狼疮综合征诊疗研究进展
刘 蕾 华益民 周开宇
新生儿狼疮综合征(NLS)是一种获得性自身免疫性疾病,是以母体抗干燥综合征 A(SSA,亦称Ro)和(或)抗干燥综合征 B(SSB,亦称 La)抗体阳性为血清标志,及患儿暂时性皮肤狼疮和(或)暂时性/永久性先天性心脏传导阻滞 (CHB)为主要表现的少见综合征[1]。其中,CHB主要发生在宫内、出生时及新生儿期,可见NLS的病理生理过程不仅限于“新生儿”期,而涉及整个围生期。
20世纪70年代,有学者发现母体抗Ro、La抗体与CHB的发生有关[2];同时,母体抗体也会使患儿在生后发生皮肤、血液及肝胆系统的异常[3],遂将抗体介导的这一系列病变命名为NLS。CHB是NLS患儿/患胎最严重的表现,病死率15%~30%[4],其中63%~70%需植入心脏起搏器[5, 6]。
抗Ro和(或)抗La抗体阳性的女性初次妊娠时2% 的胎儿会发生CHB;在有NLS胎儿妊娠史母亲的后续妊娠胎次中,胎儿CHB的发生率上升至12%~20%[1]。
目前尚无关于抗体介导的CHB的流行病学调查。据美国和欧洲报道,CHB的发病率约为1/20 000[7]。CHB主要与胎儿心脏解剖结构异常以及母体自身免疫性疾病有关。解剖结构异常包括房室瓣缺损、左房异构和大动脉异常等,共占CHB的14%~42%[8];母体自身免疫性疾病则包括系统性红斑狼疮、原发性干燥综合征、未分类自身免疫性疾病等[9];此外,母亲孕期使用药物、病毒感染和心肌缺血等也可导致CHB,但较为少见[4]。与母体自身免疫性疾病相关的CHB发生完全性房室传导阻滞(CAVB)的风险较高[7]。
1 发病机制
关于抗Ro、La抗体与NLS发生相关的认识已经有40余年了,但目前仍不清楚各类抗体在致病过程中的具体机制。目前学术界比较认可的猜想:①孕期母体抗体通过胎盘与胎儿心脏的凋亡细胞结合,诱导一系列炎症反应发生[10-12];②抗体与心肌细胞表面的钙离子通道结合,致钙离子平衡紊乱[13, 14];③部分基因位点的变异与某些基因的多态性也可能与胎儿发生CHB的易感性相关[14, 15]。
有研究报道,经胎盘传递的抗 U1RNP抗体也与NLS的发生有关,但患儿只有皮肤表现和Ⅰ°房室传导阻滞(AVB)[2]。
2 临床表型
2.1 一过性改变 皮损常在紫外线暴露后出现或加重,好发于颜面部[16, 17];血液系统的异常包括中性粒细胞减少、血小板减少,少部分患儿可发生再生障碍性贫血或溶血性贫血;肝胆系统的损害可表现为肝衰竭,胆汁淤积,转氨酶升高,肝、脾肿大,黄疸较少发生[1, 2];生后超声随访可发现无特异性的神经系统损伤,相关报道较少[18];如累及肾脏,可出现蛋白尿、血肌酐升高[19];诱发巨噬细胞活化综合征[20]。
患儿在生后6~8月内,随着体内母体抗体消失,以上各系统的表现大多可自行缓解[2]。
2.2 可能的不可逆性心脏病变 NLS患儿心脏受累时最常见的表现为CHB[21]。在抗体介导的CHB中80%以上的患儿/患胎为Ⅲ°AVB,3%的为Ⅰ°AVB,Ⅲ°AVB是造成NLS患儿死亡和致残的主要原因[7]。
NLS病变累及心脏的疾病谱日益增多,包括心内膜弹力纤维增生症(EFE)、心肌炎、扩张型心肌病(DCM)、瓣膜病、心包积液和心律失常[4, 7, 9, 22]。心律失常除最多见的Ⅲ°AVB外,还包括Ⅰ°或Ⅱ°AVB、暂时性或永久性窦性心律失常、Q-T间期延长、室性和交界性心动过速、房扑、不规则心律等[22]。这些表现均可与CHB同时出现,也可单独出现。CHB以外的表现与母体抗Ro和(或)抗La抗体阳性之间的流行病学关系尚不清楚[7]。
NLS并没有明确的诊断标准[1]。当患儿/患胎满足以上1种或多种临床表现,同时母亲血清中抗Ro、La或RNP抗体阳性,且无其他可用于解释患儿病情的疾病时,临床医生可将患儿/患胎作为NLS患者管理[23]。
3 患儿管理
3.1 诊断及评估工具 胎儿期由于胎儿到母亲皮肤的距离、子宫的绝缘性、胎儿的体积太小,均可致心电图获得的电压太低;胎儿的运动、母亲的心率及母亲肌肉的收缩可能干扰胎儿心电图的结果;所以心电图很难应用于孕期对胎儿心律的监测[24]。
胎儿心磁图(fMCG)是一种新型、无创的检查手段。fMCG可从胎儿心脏电流产生的磁场中提取出胎儿的心电信号,可用于检测胎儿心律失常、胎儿心率及提取信号振幅变化。fMCG的PQ部分包括了心电图的PR间期,且不受心房去极化时间的影响,可用于诊断Ⅰ°AVB。有研究显示,PQ部分在母体抗体阳性胎儿组较健康胎儿组明显延长,当PQ间期>2个标准差时,胎儿可以诊断为Ⅰ°AVB。但PQ间期易受胎儿心率及孕周的影响。由于fMCG的使用场所需要对磁场屏蔽,且价格昂贵,使其临床应用受到一定限制[15, 25, 26]。
超声心动图是目前临床用于诊断与鉴别胎儿心律失常的首选方法,同时可发现心脏解剖结构的异常。传统的M型超声可用于诊断CAVB,而非完全性AVB则需通过多普勒超声测量房室收缩时间间期(AVCTI,即AV间期)来判断房室传导是否发生异常。多普勒超声中二尖瓣与主动脉或上腔静脉与肺动脉瓣间的频谱信号可用来反映AV间期,其中二尖瓣与主动脉多普勒最为方便,且结果与fMCG及生后心电图随访结果无明显差异[27]。需注意的是,AV间期的精确性受到心肌细胞内在特性、心室负荷条件、胎心率和脉冲频率的影响[24]。
有研究显示,在鉴别胎儿心房二联律和Ⅱ°AVB时,fMCG优于超声[28];在诊断Ⅰ°AVB时,M型超声心动图的敏感度(44%)和特异度(88%)低于fMCG(敏感度66.7%,特异度96.2%)[15];临床医生通过使用fMCG及超声可发现大部分胎儿心律及心脏结构的异常,并可对患胎心功能行整体评估。
3.2 产前治疗 82%的CHB是在孕30周之前发现的,主要在孕20~24周;建议对抗体阳性的母亲从孕16周起,至少每周行1次超声随访以早期发现异常;若期间无异常,在孕26~34周可调整为2周随访1次[29,30]。在随访中除关注胎儿的心率、心律及心功能外,还应注意是否有心脏受累的其他表现,如EFE、瓣膜病变和心包积液等[7]。
母亲常规行超声随访的前提是已确诊自身免疫性疾病或已证实血清中抗Ro或La抗体阳性。但超过50%的NLS患儿/患胎的母亲是在发现胎儿有CHB后,才证实血清抗体阳性[7, 8]。建议孕妇在孕早期均行血清抗体筛查,以便对抗体阳性者在早期行规范化管理。
3.2.1 Ⅰ°AVB 当胎儿的AV间期>130 ms时,可诊断为Ⅰ°AVB。但美国1项研究认为[31],当AV间期>150 ms时才将患胎作为Ⅰ°AVB管理。
有学者提出,可将AV间期延长作为胎儿心脏早期受损及预测CHB进展的指标,目前AV间期延长的临床意义尚存在争议。Jaeggi等[32]通过分析165例患胎超声情况,发现通过测量AV 间期来预测CHB的进展并无显著意义;并提出,对AV间期明显延长的患胎应密切随访,而不是立即予药物治疗,当患儿出现进展性的AVB或其他的心脏病变时(如EFE、心包积液等),才考虑开始治疗。约1/3的胎儿会出现AV间期延长(>135 ms),但在后续随访中,AV间期在135~150 ms的胎儿心律可自行转为正常[33-35]。目前对仅存在AV间期延长的患胎的管理重点,可能在于密切随访,而非药物治疗,在后续随访中需将随访间期调整为3~5 d 1次,如图1。
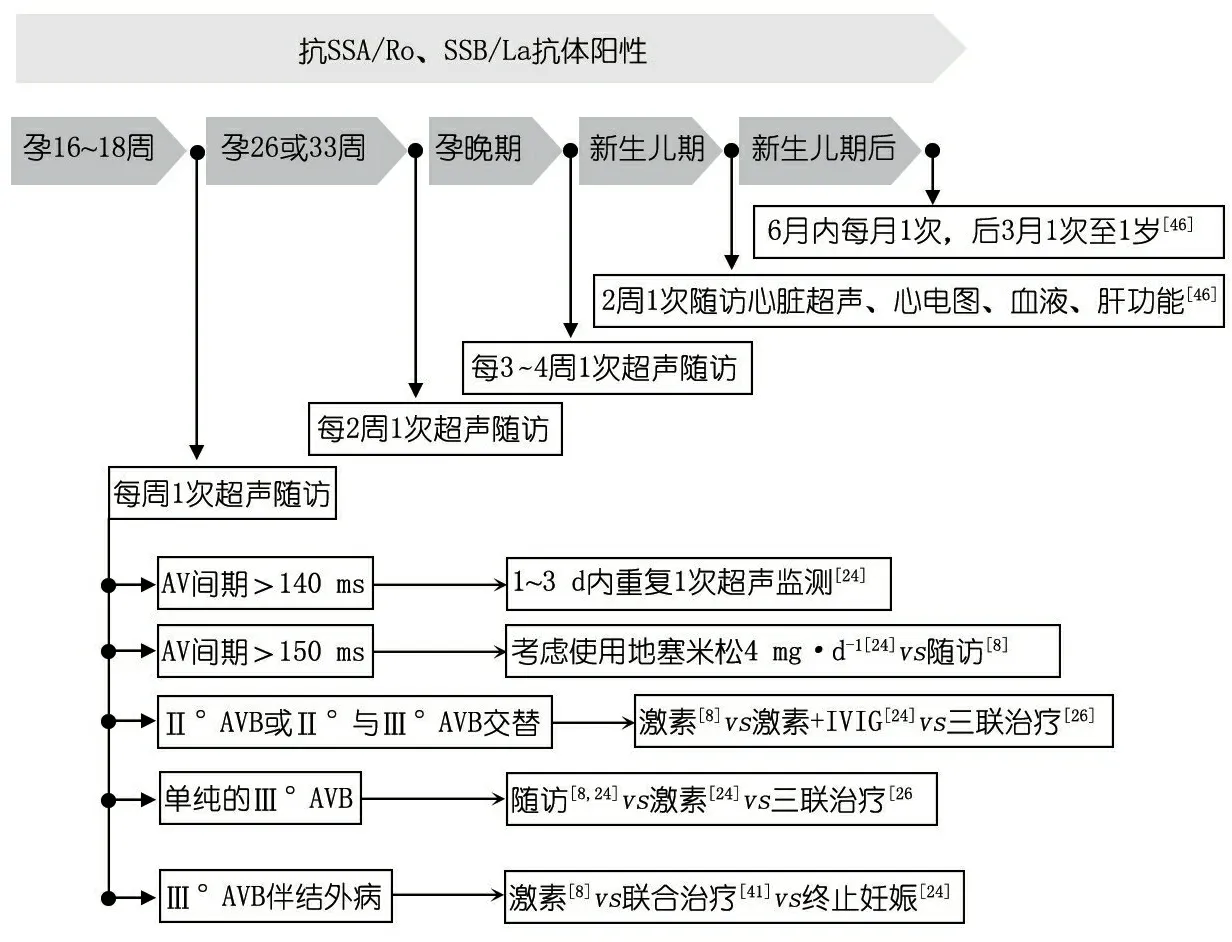
图1 新生儿狼疮综合征患儿随访建议示意图
3.2.2 Ⅱ°AVB 分别来自美国、欧洲、法国[36-38]的3项多中心研究发现,地塞米松对阻止Ⅱ°AVB进展为Ⅲ°AVB并无积极意义。IVIG 4 mg·kg-1对阻止Ⅱ°AVB进展为Ⅲ°AVB也无积极意义[39]。
有学者对超声随访发现为Ⅱ°AVB的患胎予地塞米松或倍他米松、IVIG(1 g·kg-1,每2周1次)和血浆置换(每周1次)联合治疗,其中IVIG在患儿生后立即使用1次,以后每15 d 1次,直至血清中抗体为阴性;并提出开始治疗时间和剂量对治疗效果非常重要[40]。4篇关于联合治疗的研究中[41-44],6例Ⅱ°AVB患胎中有5例经治疗后逆转为正常窦性心律或Ⅰ°AVB,只有1例进展为Ⅲ°AVB,但均无结外病变发生。学者认为,联合治疗可阻止Ⅱ°AVB的进一步进展,并能改善患胎的整体情况[41, 42, 44]。由于病例数有限,联合治疗的具体疗效还需大样本临床研究予以证明。
3.2.3 Ⅲ°AVB 有学者提出地塞米松可改善Ⅲ°AVB患胎的总体情况[34];也有研究显示,地塞米松并不能减少Ⅲ°AVB患胎心脏结外病变的发生率,不能减少患儿生后起搏器的植入率,不能提高患儿的总体生存率[36, 45]。地塞米松可能造成母亲及胎儿两方面的不良影响,目前临床工作者在使用地塞米松时需反复斟酌[46, 47]。当患胎出现以下病变时仍考虑予地塞米松治疗,如DCM、致命性的CHB和心力衰竭等[15]。
联合治疗对Ⅲ°AVB患胎的疗效还需进一步研究[40, 41, 43]。目前的研究结果中来看,联合治疗可增加Ⅲ°AVB患胎的心室率,降低患胎发生结外病变的风险,延缓患儿心脏起搏器植入的时间[48]。
当胎儿发生Ⅲ°AVB时,其心室率维持在30~100·min-1。当心室率<55 ·min-1时预示患胎预后不良。β-受体激动剂可增加患儿/患胎的心室率,能否增加患儿/患胎的生存率还有待证实。有研究表明,β-受体激动剂联合其他治疗时对胎儿是有积极意义的[5]。当患胎心室率<55 ·min-1时,建议使用地塞米松联合β-受体激动剂[9]。经皮宫内植入心脏起搏器可为胎儿心脏搏动提供支持,目前尚无宫内起搏器植入成功的案例[49]。
NLS患胎发生心脏结外病变与预后不良相关,这些病变包胎儿水肿、EFE和DCM,NLS患胎出现1种及以上的上述病变时病死率可达50%[36, 45, 50]。对Ⅲ°AVB患胎的管理可能主要在于降低患胎心脏结外病变的发生率及对已经发生结外病变的患胎予对症治疗,包括使用地塞米松、IVIG、血浆置换等以减轻炎症反应。
3.2.4 预防性治疗 已有研究证实地塞米松及IVIG 400 mg·kg-1均不能有效降低NLS患儿复发的危险[51, 52]。
有学者[39,53 54]发现,在孕期服用羟氯喹(HCQ)的CHB的复发率为7.5%,对照组为16.7%,提示HCQ对预防NLS复发有积极意义。Leroux等[55]发现,患有系统性红斑狼疮的母亲在孕期使用HCQ可降低胎儿早产及发生宫内生长受限的风险。建议对有NLS胎儿妊娠史的母亲在后续妊娠胎次中从孕6~10周开始口服HCQ[23, 54]。
3.3 产后管理 对生后皮损持续不缓解或加重的患儿,避免日晒,也可局部用低效可的松;对有严重的血液系统和肝功能异常的患儿可予泼尼松治疗[56]。虽然NLS患儿皮肤等损害可自愈,但罹患NLS的个体在儿童期或成年后发生自身免疫性疾病的概率会增加[15]。
对孕期诊断为CHB的患儿,生后需密切随访;并酌情考虑予药物治疗或适时植入起搏器。起搏器植入指征主要有:新生儿心率<55 ·min-1或者儿童、青少年和成人心率<50·min-1,心脏停搏>3 s,宽大畸形的QRS波(>120 ms),长Q-T综合征[49]。
有文献[8]表明,在胎儿期发生暂时性Ⅰ°AVB的患儿,少数在生后、儿童期甚至成年以后仍可发生CAVB。所以,对胎儿期发现过任何异常的新生儿,生后都应请儿童心脏病专家会诊;且在生后2周随访;满月后每月随访1次至生后6个月;此后每3个月行1次随访,至少至1 岁[56];甚至推荐终身随访。
4 总结
由于NLS在人群中发病率较低,使NLS的研究受到一定限制。近年的研究均表明,NLS的发生及发展贯穿整个围生期,所以对概念中时间的定义需进一步扩展,以便对有限的病例行统一的管理及研究。
目前对心脏NLS的管理重点主要在于早期发现、及时干预,阻止不可逆病变的发生。具体的管理标准尚待统一,在心脏NLS患儿/患胎的随访及治疗方面仍需进一步研究。

