动态增强MRI在直肠癌患者术前中的应用
1.河南省信阳市中心医院肿瘤外科(河南 信阳 464000)
2.河南省信阳市中心医院影像科(河南 信阳 464000)
霍 亮1 杜 勇2
直肠癌系临床常见消化系统恶性肿瘤,随着人们饮食结构及生活习惯的改变,其发病率、死亡率有上升趋势[1]。现有治疗以手术切除为主,可减少局部复发及死亡率。多数直肠癌患者初期症状不典型,临床就诊时已处于中晚期延误治疗,因而尽早发现,及时诊断,准确分期是合理选择直肠癌治疗方案的关键[2]。随着磁共振成像技术(MRI)的发展,其具磁共振分辨率极高、无电离辐射损及多方位成像优势,但常规MRI平扫无法提供肿瘤病理分级及血管生成方面信息。动态增强MRI(DCE-MRI)可通过定量分析血流动力学信息直接反映病变组织在血管生成相关信息,对治疗方案的选择及预后评估至关重要[3-4]。本研究将DCE-MRI用于直肠癌患者术前诊断,探究直肠癌患者的DCE-MRI表现及不同参数特点,现报道如下。
1 资料与方法
1.1 一般资料收集2015年12月~2017年12月于信阳市中心医院肿瘤外科经手术病理证实符合直肠癌诊断标准[5]的240例患者MRI常规及DCE-MRI扫描图像进行回顾性分析。240例直肠癌患者入组前均未接受过药物化疗或放射性治疗,且采用相同序列行盆腔3.0 T MRI检查及肿瘤DCE-MRI扫描。其中男154例,女86例,年龄38~75岁,平均(60.17±10.25)岁。
1.2 方法检查当日患者禁食,清洁灌肠,未注入对比剂,嘱患者保持膀胱适度充盈,设备选择德国SIEMENS Skyra 3.0T磁共振扫描仪及18通道相控阵线圈取仰卧位,头先进,先行常规盆腔MRI平扫,序列:矢状面T2WI脂肪抑制序列,横断面T1WI、T2WI、DWI及冠状面T2WI。DCE-MRI取横断面扫描,扫描层面与T2WI抑制,参数:TR 3.33ms,TE 1.23ms,TE 1.23 ms,可变翻转角9°,FOV 36 cm,矩阵125×192,层厚3mm,30层;并行采集技术CAIPIRINHA及加速因子R=2。扫描时间5s/期,共扫描75期,首次扫描第1期后使用美国spectris solaris EP注射器经肘静脉注入对比剂钆双胺注射液(Gd-DTPA),注射速率3mL/s,剂量0.2mmol/kg,总剂量15~20mmol。对比剂注射后即刻以同样注射速率注射20mL生理盐水冲洗管道。
1.3 图像分析与数据处理使用MMWP version VE40工作站Tissue 4D模块处理数据,由2名工作经验丰富的医师阅片,观察病灶形态、部位、浸润深度、强化方式及周边侵犯等特征,在病变明显强化的部位放置感兴趣区域(ROI),测量灌注参数容量转移常数(Ktrans)、速率常数(Kep)、EES容积比(Ve)及其伪彩图,测量3次,取平均值,并获得时间-信号强度曲线。
1.4 术后病理分期
1.4.1 病理分化程度:参照《病理学》[6]将直肠癌分为高分化、中分化及低分化共3级。
1.4.2 Dukes分期:参照《外科学》[7]将直肠癌分为Dukes A期、B期、C期、D期共4期。
1.4.3 TNM分期:参照《外科学》[7]将直肠癌分为T0期、T1期、T2期、T3期、T4期共5期。
1.5 统计学分析应用SPSS19.0软件处理数据,计量资料以(±s)表示,组间比较行t检验,多组间比较行方差F检验。P<0.05为差异有统计学意义。
2 结 果
2.1 术后病理组织学分类、Dukes分期及TNM分期240例患者高分化56例,中分化137例,低分化47例;Dukes A期48例,B期120例,C期47例,D期25例;T1期32例,T2期33例,T3期111例,T4期64例;淋巴结转移73例,无淋巴结转移167例。
2.2 DCE-MRI表现240例直肠癌患者均为单发病灶,其中207例患者肿瘤向直肠肠壁或壁外结节突出形成肿块,且边缘不规则,导致肠壁狭窄,部分肿块突破肠壁向外生产,侵犯直肠系膜、筋膜及邻近子宫、附件、膀胱、前列腺等器官;33例表现为直肠肠壁局部不规则增厚,多数信号较均匀。患者肿瘤病灶呈T1WI等信号,与正常肠壁信号一致,仅少数略低于肠壁信号;T2WI与正常肠壁信号相比呈等高信号,略高于管壁(或肠壁)混杂信号,信号不均匀;DWI信号明显高于正常肠壁信号。DCE-MRI扫描可见均匀明显强化病灶,Ktrans、Kep、Ve值均高于周围正常肠壁组织;少数肿瘤环状强化,病变边界清晰,呈结节样突出,表现为早期明显强化,发展至中晚期强化程度逐渐降低。无淋巴结转移患者病灶多表现为均匀强化,淋巴结转移患者多表现为病灶周边强化,中央无强化(强化不均匀)。
表1 直肠癌分化程度与DCE-MRI参数比较(±s)
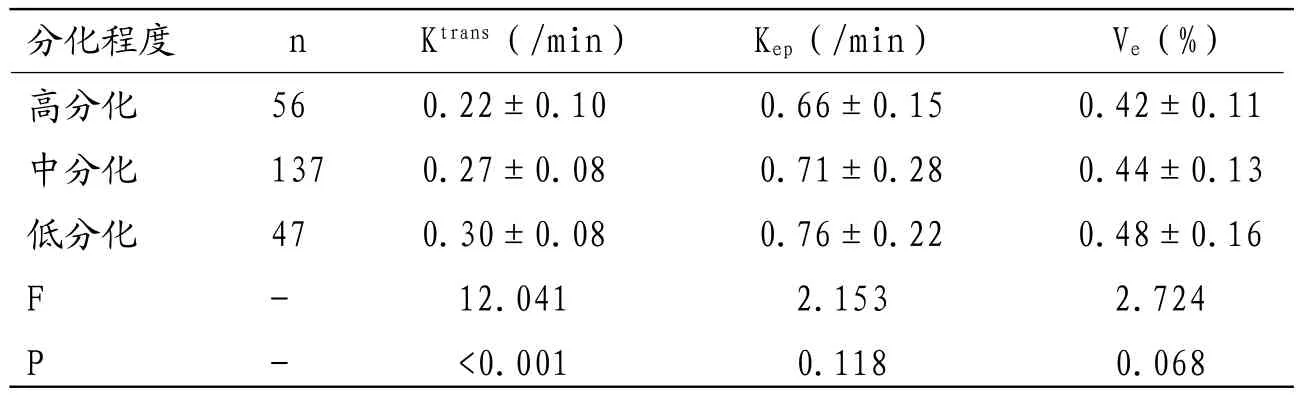
表1 直肠癌分化程度与DCE-MRI参数比较(±s)
分化程度 n Ktrans(/min) Kep(/min) Ve(%)高分化 56 0.22±0.10 0.66±0.15 0.42±0.11中分化 137 0.27±0.08 0.71±0.28 0.44±0.13低分化 47 0.30±0.08 0.76±0.22 0.48±0.16 F - 12.041 2.153 2.724 P - <0.001 0.118 0.068
表2 直肠癌Dukes分期与DCE-MRI参数比较(±s)
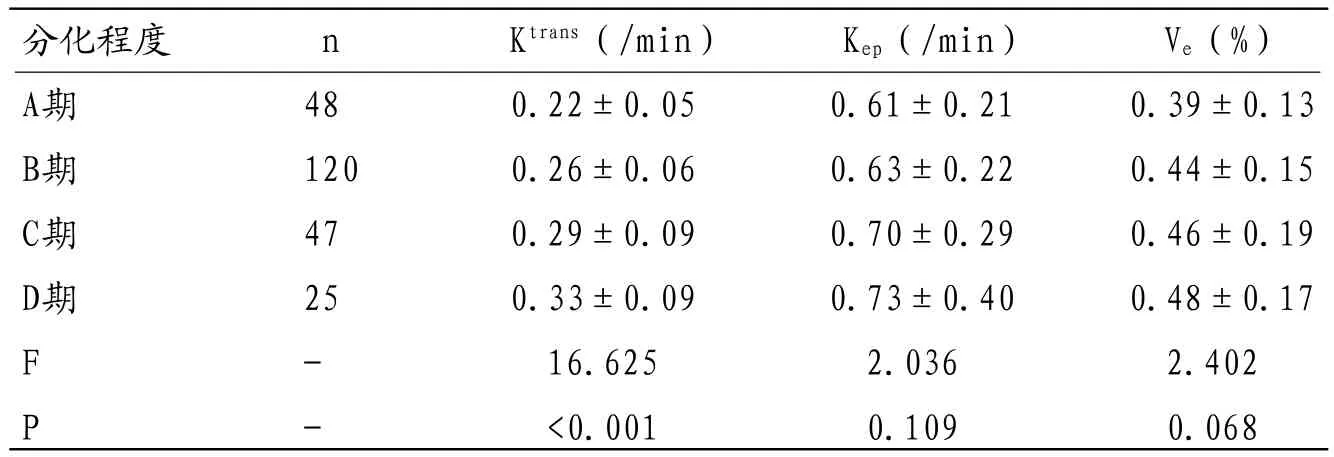
表2 直肠癌Dukes分期与DCE-MRI参数比较(±s)
分化程度 n Ktrans(/min) Kep(/min) Ve(%)A期 48 0.22±0.05 0.61±0.21 0.39±0.13 B期 120 0.26±0.06 0.63±0.22 0.44±0.15 C期 47 0.29±0.09 0.70±0.29 0.46±0.19 D期 25 0.33±0.09 0.73±0.40 0.48±0.17 F - 16.625 2.036 2.402 P - <0.001 0.109 0.068
表3 直肠癌TNM分期与DCE-MRI参数比较(±s)

表3 直肠癌TNM分期与DCE-MRI参数比较(±s)
分化程度 n Ktrans(/min) Kep(/min) Ve(%)T1期 32 0.20±0.06 0.63±0.22 0.38±0.12 T2期 33 0.25±0.07 0.66±0.24 0.47±0.17 T3期 111 0.27±0.10 0.67±0.23 0.45±0.14 T4期 64 0.31±0.10 0.80±0.33 0.44±0.13 F - 8.237 2.585 2.602 P - <0.001 0.054 0.053
表4 直肠癌淋巴结转移与DCE-MRI参数比较(±s)
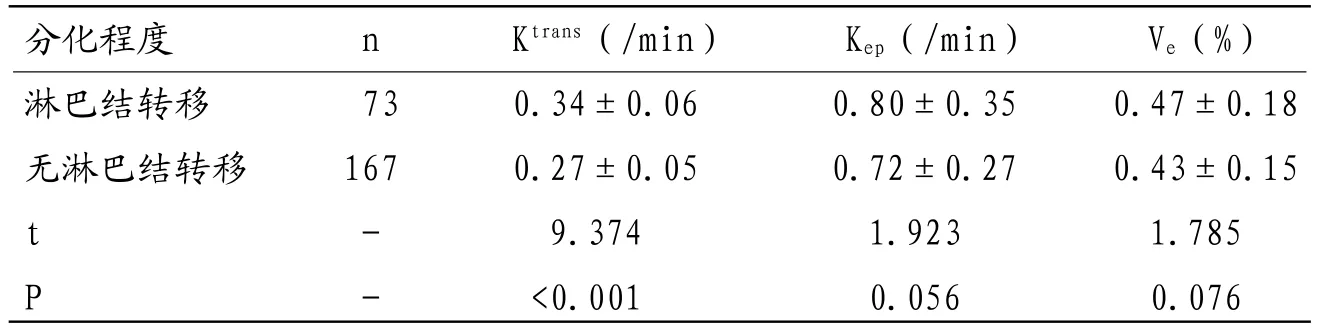
表4 直肠癌淋巴结转移与DCE-MRI参数比较(±s)
分化程度 n Ktrans(/min) Kep(/min) Ve(%)淋巴结转移 73 0.34±0.06 0.80±0.35 0.47±0.18无淋巴结转移 167 0.27±0.05 0.72±0.27 0.43±0.15 t - 9.374 1.923 1.785 P - <0.001 0.056 0.076

图1 DCE-MRI的Ktrans伪影图。图2 DCE-MRI的Kep伪影图。图3 DCE-MRI的Ve伪影图。图4 DCE-MRI的时间-信号强度曲线(流出型曲线)。
2.3 直肠癌分化程度与DCEMRI参数比较随肿瘤分化程度降低,Ktrans值显著升高,差异有统计学意义(P<0.05);不同分化程度患者Kep、Ve值间比较,差异无统计学意义(P>0.05)。见表1。
2.4 直肠癌Dukes分期与DCEMRI参数比较随肿瘤Dukes分期增加,Ktrans值显著升高,差异有统计学意义(P<0.05);不同Dukes分期患者Kep、Ve值间比较,差异无统计学意义(P>0.05)。见表2。
2.5 直肠癌TNM分期与DCEMRI参数比较随肿瘤TNM分期增加,Ktrans值显著升高,差异有统计学意义(P<0.05);不同TNM分期患者Kep、Ve值间比较,差异无统计学意义(P>0.05)。见表3。
2.6 直肠癌淋巴结转移与DCE-MRI参数比较淋巴结转移患者Ktrans值显著升高,差异有统计学意义(P<0.05);有无淋巴结转移患者Kep、Ve值间比较,差异无统计学意义(P>0.05)。见表4。
3 讨 论
直肠癌系国内常见恶性肿瘤,发病率与死亡率增年增长,且发病年龄逐渐趋向年轻化[8]。MRI可从不同方位对盆腔及直肠进行大范围检查,图像清晰,同时具有无创、可重复实施等方面优势,因而已作为临床诊断直肠癌的重要影像学方法。DCE-MRI是在患者静脉血管内注入对比剂,对比剂随血流到达肿瘤组织,从血管内扩散至EES进行交换,然后返回血管随血流排出,通过反复扫描记录病灶信号高低,从而反映病灶微血管分布情况,是一种结合了形态学与血流动力学改变的影像学技术,可更加精确地定量评估肿瘤恶性程度[9-10]。
正常情况下直肠壁DCE-MRI影像学表现为粘膜层连续较高信号影,粘膜下层由于被FS序列抑制而变现为较低信号,肌层增强高信号,肠管周围直肠被FS序列抑制呈较低信号。DCE-MRI影像肿瘤信号与正常肌层信号明显,若DCE-MRI序列为肌层连续,则肿瘤局限于肌层内;当直肠癌病灶侵犯至肠周脂肪时,DCE-MRI序列为肌层不连续,边缘毛糙;当肿瘤侵犯至肠壁外缘时,可出现与原发病灶相似的早期强化条索状影像。同时宋媛等[11-12]研究还显示DCE-MRI在判断肿瘤侵犯肠壁深度上具有重要价值。
Ktrans指对比剂从血管分布到EES的速率,是反映血管通透性的常用常数。Kep指对比剂注入后,扩散至EES的对比剂回流至微血管的速率,反映肿瘤生成情况。Ve指单位容积组织内EES容积,可间接反映血管壁通透能力。沈浮[13]等研究显示,Ktrans与肿瘤病理分期及分化程度具有明显关系。本研究中,Ktrans随病理分化程度降低、Dukes分期增加、TNM分期增加及淋巴结转移而显著升高,提示肿瘤恶性程度越高的直肠癌患者血管越不成熟,血管完整性收到不同程度破坏,通透性增加,易导致血管对比剂外漏,从而使Ktrans升高。这与都雪朝等[14-15]将DCE-MRI中Ktrans用于评估肿瘤预后的研究结果基本一致。而本研究中Kep、Ve在病理分化程度、Dukes分期、TNM分期及淋巴结转移的差异无统计学意义,分析其原因笔者认为可能与肿瘤血供复杂,分布不均,周围水肿明显,EES环境复杂多样等因素相关。因而关于Kep、Ve与肿瘤恶性程度的相关性研究还有待进一步深入探究。
综上所述,DCE-MRI检查可从血流动力学角度反映病灶病态与功能,其参数Ktrans值与病理分化程度、Dukes分期、TNM分期及淋巴结转移具一定相关性,可在常规MRI检查上提供血管微循环信息,用于术前评估直肠癌恶性程度。

