DTI在帕金森患者诊断中的应用
1.郑州市第九人民医院神经内科(河南 郑州 450000)
2.南阳市中心医院神经内科(河南 南阳 473000)
刘莉莉1 陈艳芳2
帕金森病(PD)系中老年常见神经系统变性疾病,以静止性震颤、运动迟缓、肌张力增加及姿势反射障碍为主要临床表现,发病率随年龄增长而显著升高,且病情进行性加重,严重威胁患者生活质量[1-2]。其病因尚不明确,多认为与遗传、环境及年龄老化等因素相关,发病机制主要与黑质多巴胺能神经元变性丢失相关[3]。目前主要依靠患者病史及临床症状诊断PD,依靠帕金森氏病综合评分量表(UPDRS)评分及Hoehn-Yahr分期评估疾病严重程度,但尚缺乏客观依据,诊断准确率仅为82%,易出现误诊漏诊,症状出现时,患者多伴有60%以上的黑质纹状体神经元变性改变[4]。而常规核磁共振成像(MRI)平扫+增强扫描联合CT检查仅能提示脑萎缩征象,灵敏度及特性性较低[5]。因此,寻找一种安全有效的影像学方式监测PD的病理改变具有重要临床价值。弥散张量成像(DTI)是在MRI技术上发展的特殊形式,利用组织中水分子扩散运动特性变化成像,可用于评价组织结构完整性及连续性,追踪蛋白质纤维束走形。本研究收集我院62例PD患者的DTI影像表现,探究DTI在PD患者诊断中的应用价值,报道如下。
1 资料与方法
1.1 一般资料收集2013年1月~2017年12月我院就诊的62例PD患者的临床资料为PD组进行回顾性分析。入组患者均符合《中国帕金森病的诊断标准(2016版)》[6]诊断标准,存在运动减少等典型临床症状表现,已接受多巴胺药物治疗,且排除脑外伤等神经系统疾病及感染史,合并其他系统性或全身性疾病史患者。其中男43例,女19例,年龄58~82岁,平均(67.17±6.25)岁;病程2~21年。平均(12.36±5.14)年;UPDRS评分(49.81±12.41)分;Hoehn-Yahr分期2~4期。另选取同期我院体检正常的62例健康志愿者为对照组,其中男40例,女22例,年龄60~85岁,平均(67.49±6.81)岁。两组性别、年龄比较无显著差异(P>0.05)。研究者知情,并自愿签署同意书。
1.2 检查方法使用Siemens Prisma 3.0T MRI扫描仪,行常规MRI检查,平扫序列包括T1WI(TR/TE=250ms/2.5ms),T2WI(TR/TE=4000ms/90ms),层厚5mm,层距1.5mm。DTI采用平面回波成像序列(EPI),行轴位扫描(TR/TE=4000ms/99ms),FOV 256mm×256mm,层数70层,层厚2mm,间距0mm,B=0、1000s/mm,在64个方向施加梯度脉冲,激励次数NEX=1。
1.3 图像处理将扫描得到的DTI图像传入ADE 4.4工作站进行后处理,重建FA图及ADC图,每个灰质层均取最大最清晰层面选定ROI,并测量黑质、红核、苍白球、壳核、尾状核、丘脑、额叶白质各兴趣区的各向异性分数(FA值)及表观扩散系数(ADC值),各测量3次,取平均值。
1.4 统计学分析应用SPSS19.0软件处理数据,各兴趣区FA值、ADC值以(±s)表示,行独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 感兴趣区在相位图上的信号表现相位图显示PD患者左右半球黑质、红核、苍白球及壳核后外侧为均匀低信号表达,双侧形态堆成,边界清楚,提示该部位铁含量较多,为铁沉积区域。且受检者不同,相位图椎体外系核团信号亦有不同,见图1-4。
2.2 各兴趣区FA值比较PD组黑质、壳核的FA值显著低于对照组,差异有统计学意义(P<0.05);而PD组红核、苍白球、尾状核、丘脑、额叶白质兴趣区的FA值与对照组比较,差异无统计学意义(P<0.05)。见表1。
2.3 各兴趣区ADC值比较PD组黑质、红核、苍白球、壳核、尾状核、丘脑、额叶白质各兴趣区ADC值与对照组比较,差异均无统计学意义(P<0.05)。见表2,图5-6。
3 讨 论
多项研究证实PD的主要病理改变为黑质-纹状体环路退变,黑质致密部多巴胺可导致神经元变性死亡,抑制纹状体等核团多巴胺递质,从而使患者出现静止性震颤、运动迟缓、肌张力增加、痴呆等临床症状,严重时甚至可影响不同脑网络间的连接性[7-8]。且PD患者亚临床阶段时间较长,患者脑内多巴胺及乙酰胆碱动态平衡已经遭到破坏,黑质纹状体病理改变已经发生,但由于多巴胺受体敏感性及神经元兴奋性较强,导致纹状体代偿,患者早期临床症状不典型,极易误诊。Langley等[9]文献报道,当患者黑质多巴胺能神经元缺失高于50%以上后,患者才会出现明显临床症状。因此,寻找一种有效的早期监测PD病理改变的方法,对延缓疾病进展,并给予早期干预治疗至关重要。
DTI是近年来在MR扩散加权成像上发展的一项新技术,可利用人体生理及病理组织中水分子扩散运动探测组织的微观结构,较好的反映组织结构完整性及连续性。其原理在于,脑组织中,自由水弥散受到多种局部因素(如细胞膜及大分子物质等)影响,水分子在有髓神经纤维中沿轴突方向的弥散速度快于垂直方向速度,即弥散的各向异性作用,具有明显的方向依赖性。微环境不同,弥散作用也不尽相同,如脑组织中纤维束弥散具有较高的各向异性。DTI检查可通过FA值及ADC值定量表示水分子弥散的速度及方向,从而反映脑组织微观结构的变化。FA值范围在0~1之间,反映水分子扩散各向异性的程度,一般脑白质FA值较高,呈高信号表现,各项异性程度较高;而脑脊液FA值较低,呈低信号表现,各项异性程度较低。苏军红等[10]动物研究发现,大鼠黑质FA值显著降低,而纹状体、大脑皮质FA值并未有显著变化,病检结果显示大鼠黑质内多巴胺能神经元丢失程度与FA值降低线性正相关,说明DTI可较好地监测黑质内多巴胺能神经元变化。而PD患者症状结构基础正在于黑质多巴胺能神经细胞变性或丢失。本研究发现,PD患者黑质的FA值显著低于对照组,与国内外既往研究基本一致[11-13],提示PD患者黑质-纹状体通路伴有选择性微观结构及功能改变。分析其原因,笔者认为可能与铁异常沉积与多巴胺能神经元内,损伤其功能相关;同时多巴胺能神经细胞变性、丢失及纤维损伤、胶质细胞增生,导致病变处白质纤维束结构及排列紊乱,使局部组织各向异性降低,影像学表现为FA值降低。本研究中,PD组壳核FA值亦显著低于对照组,提示壳核部位也存在明显结构改变,可能与黑质神经元投射纤维相关。李梦婷等[14]研究采用SPPET扫描发现,PD患者壳核神经细胞严重缺失。ADC值是反映水分子在各因素影响下向各个方向扩散的平均值。本研究中PD组黑质、红核、苍白球、壳核、尾状核、丘脑、额叶白质各兴趣区ADC值与对照组比较,差异均无统计学意义,与杨涛等[15]研究基本一致,提示在组织微观结构改变方面的反映,FA值敏感度明显高于ADC值,这可能与ADC值影响因素众多相关,其具体生物学意义还有待近一半探究阐明。
表1 两组各兴趣区FA值比较(±s)
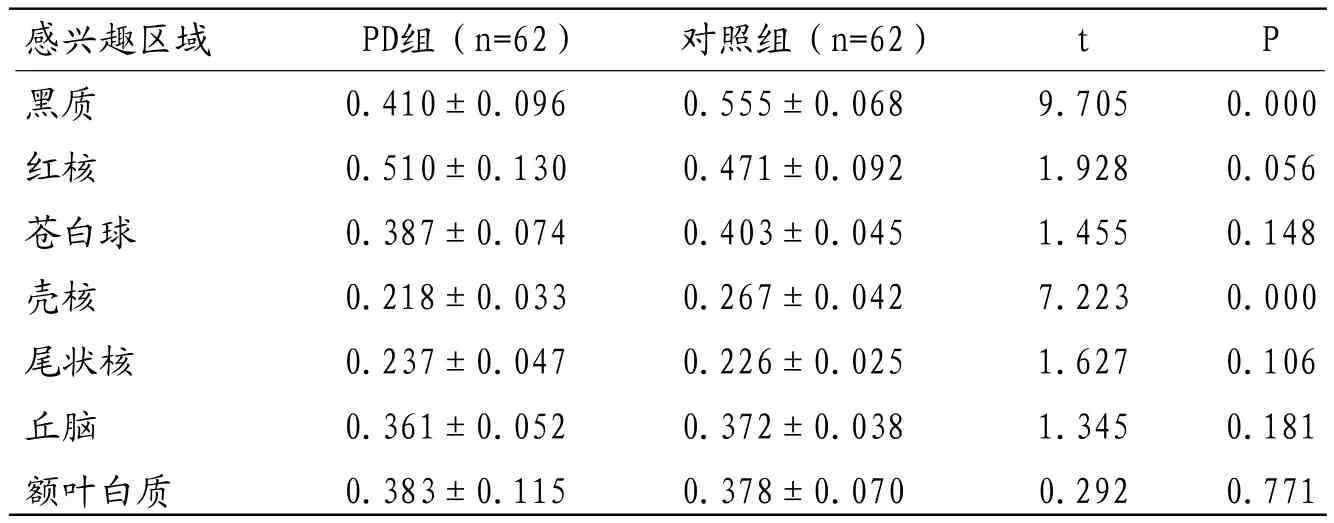
表1 两组各兴趣区FA值比较(±s)
感兴趣区域 PD组(n=62) 对照组(n=62) t P黑质 0.410±0.096 0.555±0.068 9.705 0.000红核 0.510±0.130 0.471±0.092 1.928 0.056苍白球 0.387±0.074 0.403±0.045 1.455 0.148壳核 0.218±0.033 0.267±0.042 7.223 0.000尾状核 0.237±0.047 0.226±0.025 1.627 0.106丘脑 0.361±0.052 0.372±0.038 1.345 0.181额叶白质 0.383±0.115 0.378±0.070 0.292 0.771
表2 两组各兴趣区ADC值比较(±s)

表2 两组各兴趣区ADC值比较(±s)
感兴趣区域 PD组(n=62) 对照组(n=62) t P黑质 8.501±0.650 8.461±0.238 0.455 0.650红核 7.051±0.799 6.853±0.427 1.721 0.088苍白球 8.342±0.398 8.225±0.336 1.767 0.079壳核 7.528±0.374 7.459±0.310 1.118 0.266尾状核 7.593±0.574 7.719±0.292 1.541 0.126丘脑 7.553±0.384 7.459±0.283 1.552 0.123额叶白质 8.512±0.521 8.369±0.352 1.791 0.076

图1-4 PD组相位校正图。图5 T1WI轴位图像。图6 T2WI轴位图像。
综上所述,DTI是一项安全、简便、敏感、无创、无辐射、且可重复使用的检查方法。可有效反映脑组织围观结构变化,为PD的早期诊断与预后评估提供客观参考依据。

