重型颅脑损伤患者血清高迁移率族蛋白B1、白细胞介素-1和白细胞介素-6、S100B的水平变化及临床意义
莫海军 丁燕晶 李金庭 陈远浩 叶嘉辉 李笑盈
广东省东莞市厚街医院重症医学科,广东东莞 523900
重型颅脑损伤患者病死率及致残率较高[1],且缺乏及时客观的评估病情及预后的手段[2]。因此,临床上急需能够迅速预测疾病死亡风险和进程的实验室指标。多种研究表明炎症反应是脑缺血缺氧的重要发病机制之一[3],HMGB1、IL-1、IL-6、S100B均为重要的炎症标志物,本研究通过检测重型颅脑损伤患者不同时期HMGB1、IL-1、IL-6、S100B 水平,探讨 HMGB1、IL-1、IL-6、S100B在重型颅脑损伤患者发生脑损害过程中的作用以寻求其临床价值。
1 资料与方法
1.1 一般资料
选取2016年11月~2017年9月于我院就诊的80例重型颅脑损伤患者为观察组,男38例,女42例;年龄25~71岁,平均(36.0±10.3)岁;选择标准:(1)有明确的头部外伤史,且无其他部位严重的合并伤;(2)受伤后24h入院;(3)未合并其他脑部损伤。选取同期于我院体检的80例健康者为对照组。对照组男41例,女39例;年龄26~74岁,平均(36.0±10.6)岁;两组患者在性别、年龄比较,差异无统计学意义(P>0.05)。所有研究对象均告知研究目的、方法后,自愿加入本研究并签署知情同意书。未签署知情同意书,不愿配合完成实验者不在本研究之内。
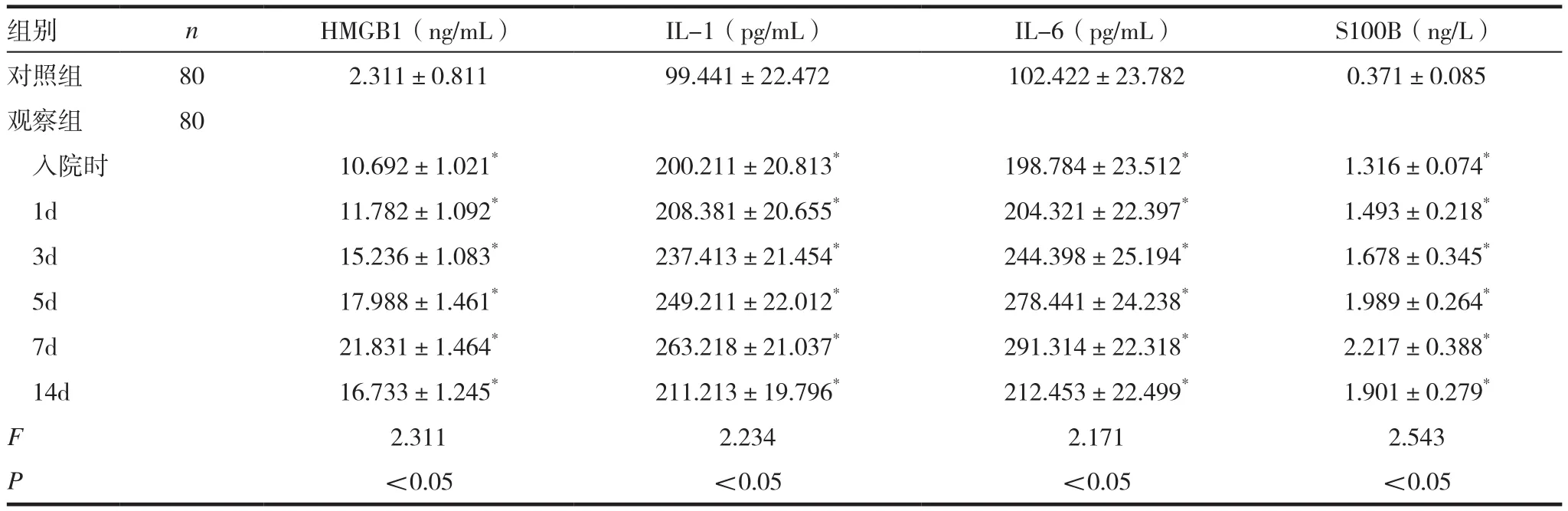
表1 两组患者血清HMGB1、IL-1、IL-6、S100B蛋白水平比较(x ± s)
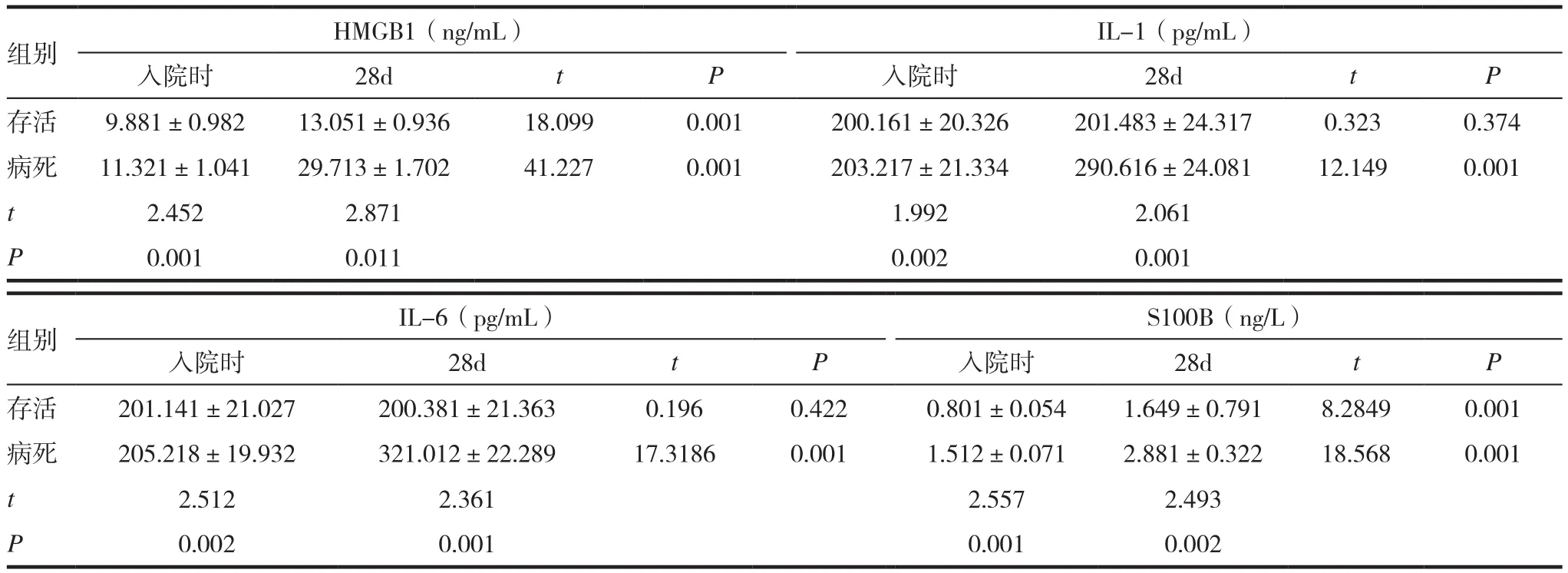
表2 观察组死亡患者与存活患者血清HMGB1、IL-1、IL-6、S100B蛋白水平比较(x ± s)
1.2 方法
观察组80例重型颅脑损伤患者分别于入院后 24h 内及病程内(1d、3d、5d、7d、14d)抽取空腹静脉血约4mL,对照组于体检后抽取空腹静脉血约4mL。采集的静脉血离心20min,收集血清,冻存于-70℃冰箱备检。采用上海森雄科技实业公司提供的仪器与试剂,进行IL-1、IL-6的测定。使用芬兰丹尼WK-Ⅱ型酶标仪,并由瑞典CanAg公司提供的S100B-ELISA试剂盒与血浆HMGB1试剂盒,进行HMGB1与S100B的测定。所有操作均按严格的操作及试剂盒使用说明进行。
1.3 统计学方法
采用SPSS19.0软件对数据进行分析。计量资料以(x±s)表示,采用t检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血清HMGB1、IL-1、IL-6、S100B蛋白水平比较
观 察 组 各 时 期 血 清 HMGB1、IL-1、IL-6、S100B蛋白水平均明显高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 观察组死亡患者与存活患者血清HMGB1、IL-1、IL-6、S100B蛋白水平比较
观察组共80例患者,28d后死亡病例数为20例,病死率为25%。病死患者血清HMGB1、IL-1、IL-6、S100B蛋白水平均高于存活患者,差异有统计学意义(P<0.05)。见表2。
3 讨论
重型颅脑损伤是重症医学科常见的一种危重症,患者病死率及致残率较高,均在50%以上[4]。脑细胞的损伤、死亡与炎症有着密切的关系,多种研究表明炎症反应介导了脑缺血再灌注损伤的过程,炎症反应是脑缺血缺氧的重要发病机制之一[5]。因此通过检测炎症因子水平变化,可以了解它在重型颅脑损伤患者中的作用机制,评估重型颅脑损伤患者脑损害的程度[6]。HMGB1是促炎介质,当细胞缺血坏死时,HMGB1就由细胞核内释放至胞外,发挥其致炎作用[7]。研究发现,HMGB1在心、脑、肺、肝、肾、肠道和骨骼肌组织的缺血再灌注过程中均有强阳性表达,而且以HMGB1为靶点的治疗措施可明显减轻实质脏器和肌肉组织的再灌注损伤[8-10]。IL-1和IL-6是致炎的决定因子,缺氧缺血的环境诱导IL-1、IL-6的释放,加剧了炎症反应[11]。IL-1与IL-6相互作用,进一步诱导肿瘤坏死因子的产生,使得促炎基因和诱导性酶的产生,使炎性损伤加重,缺血性脑损伤在IL-1和IL-6作用下使得病情加重[12-13]。S100B蛋白主要存在胶质细胞中,一旦神经功能受到损伤,S100B蛋白能够通过血脑屏障进入血液,而神经未受损的患者则不易被测出[14]。相关资料显示,S100B蛋白血清水平的测定可以反映脑损伤的程度[15]。
本研究中各时间段观察组HMGB1、IL-1、IL-6、S100B蛋白均高于对照组,且观察组从入院起HMGB1、IL-1、IL-6、S100B蛋白不断升高,至7d升至高峰后逐渐下降,差异有统计学意义(P<0.05)。28d死亡病例数20例,病死率25%,死亡患者HMGB1、IL-1、IL-6、S100B 一直呈上升趋势且均高于存活患者,差异有统计学意义(P<0.05)。综上可知重型颅脑损伤患者HMGB1、IL-1、IL-6、S100B蛋白较健康者显著升高,且死亡患者HMGB1、IL-1、IL-6、S100B蛋白升高更显著,可知HMGB1、IL-1、IL-6、S100B蛋白对于重型颅脑损伤患者的预后有一定参考价值。

