小鼠腘窝淋巴结模型评价3种中药注射液的潜在免疫毒性
林 琳,范潇予,李恩灿,凌亚豪,臧清策,林 生,贺玖明,靳洪涛,3,*
(1.中国医学科学院北京协和医学院药物研究所新药安全评价研究中心,北京 100050;2.中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室,北京 100050;3.北京协和建昊医药技术开发有限责任公司,北京 100176)
近几十年来,临床上关于中药注射液(traditional Chinese medicine injections,TCMIs)不良反应报道日益增加[1],其中,发生率最高的是免疫介导的药物不良反应,如急性过敏反应、过敏性休克[2]。 既往研究[3]发现,5-羟甲基糠醛(5-hydroxymethyl furfural,5-HMF)及其二聚体[5,5’-oxydimethylenebis(2-furfural),OMBF]可能与含糖中药注射液引发的免疫刺激(如超敏反应和自身免疫反应)有一定的相关性。已有研究[4-6]表明生脉、脉络宁和丹香冠心3种注射剂在临床中均能够引起包括过敏反应在内的不良反应。我们在前期市售中药注射液5-HMF及其二聚体的筛查中发现生脉、脉络宁和丹香冠心注射剂均含有较高含量的5-HMF及OMBF[7-8]。因此,探究此3种注射液潜在的免疫毒性以及5-HMF单体和二聚体可能发挥的作用十分必要。由于5-HMF及其二聚体均为小分子化合物,传统致敏试验动物模型可能存在假阴性结果,因此本研究选择小鼠直接腘窝淋巴结(direct popliteal lymph node assay,D-PLNA)和报告抗原腘窝淋巴结(reporter antigen popliteal lymph node assay,RA-PLNA)模型对上述3种注射液进行了免疫毒性评价,进而初步探究免疫毒性作用机制。
1 材料与方法
1.1 实验动物
雄性SPF级BALB/c小鼠,6~8周龄,体质量18~22 g,共128只,购自北京维通利华实验动物有限公司,许可证号:SCXK(京)2016-0006。饲养环境保持室温20~26 ℃,相对湿度40%~70%,保持12 h昼夜节律,动物自由进食水,试验过程中动物使用和相关处置符合动物福利伦理要求。
1.2 供试品与试剂
丹香冠心注射液(批号51150106)、脉络宁注射液(批号20140928)、生脉注射液(批号13120711),均由中国医学科学院药物研究所分析代谢中心贺玖明老师提供。阳性对照药物苯妥英钠(批号57-41-0),购自美国Sigma-Aldrich公司。报告抗原TNP-Ficoll(批号044807)和TNP-OVA(批号047104),规格均为每瓶10 mg,均购自美国BioSearch公司。小鼠IgE预包被ELISA试剂盒(批号E2820-1607-1)和小鼠MCP-1预包被ELISA试剂盒(批号E2739-1601-1),均购自达科为生物技术有限公司。
1.3 实验方法
1.3.1 分组设计 小鼠按体质量随机分为16组,其中D-PLNA模型为5组,即生理盐水对照组,脉络宁、生脉、丹香冠心注射液各1组,阳性药物苯妥英钠对照组;RA-PLNA模型为11组,即上述5组分别联合报告抗原三硝基苯基聚蔗糖(2,4,6-trinitrophenyl-Ficoll,TNP-Ficoll)和三硝基苯基卵蛋白(TNP-ovalbumin,TNP-OVA)作用组,另设生理盐水对照组,每组8只。报告抗原的剂量为每只10 µg,给药体积均为50 µL,阳性药物给药剂量为每只2 mg。上述3种中药注射液中5-HMF和OMBF的给药浓度和剂量见表1。1.3.2 给药及样本收集 D-PLNA模型中,BALB/c小鼠后足趾部70%酒精消毒,用1 mL注射器针头于左侧足趾部皮下注射3种中药注射液及阴、阳性受试物,右侧为对照侧。给药后第7天,取出淋巴结,备用。RA-PLNA模型中,将3种中药注射液、阳性药物和生理盐水分别与10g TNP-OVA或TNP-Ficoll粉末混合后,注射于小鼠足趾部,给药方式相同,取出淋巴结后备用。将各组淋巴结置于200目不锈钢筛网上,用玻璃研磨器轻轻研碎,同时以1% FBS-1640冲洗淋巴细胞液于培养皿中,吹匀并收集细胞悬液,4 ℃ 、1 5 00 r/min离心后,重悬并进行细胞计数。按下面公式计算细胞指数(cellularity index,CI)。
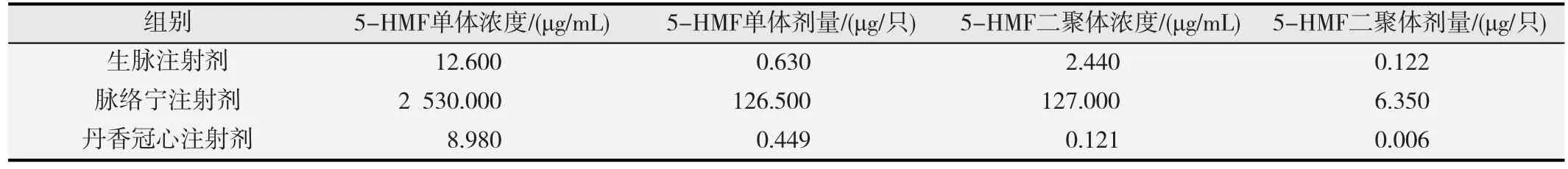
表1 3种中药注射液中5-HMF和OMBF给药浓度及剂量
CI=处理侧淋巴结细胞数/未处理侧淋巴结细胞数
1.3.3 ELISA法测定免疫相关因子浓度 将淋巴结细胞悬液培养于96孔板,加入刺激剂脂多糖(lipopolysaccharide,LPS),浓度为4 µg/mL,均为每孔100 µL,培养箱孵育16~18 h,收集细胞上清液。参照ELISA试剂盒说明书分别测定上清液中免疫球蛋白IgE、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的浓度。
1.4 统计及分析
采用SPSS 20.0软件进行统计分析。结果均以-x±s 表示,进行单因素方差分析,组间差异比较采用LSD法。此外,CI≥2且与阴性对照组比较有显著差异,认为模型的细胞指数反应呈阳性。
2 结果
2.1 细胞浓度
在D-PLNA模型中(表2),注射液丹香冠心和苯妥英钠阳性对照组的处理侧与对照侧以及生理盐水对照组比较,淋巴结细胞浓度均显著升高,CI 也显著升高(P<0.05),但丹香冠心组CI小于2,提示丹香冠心组DPLNA反应为阴性。加入报告抗原TNP-OVA后,与对照侧相比,各中药注射液组细胞浓度有上升的趋势,但均无统计学意义(P>0.05);加入报告抗原TNPFicoll后,与对照侧相比,脉络宁、生脉、丹香冠心注射液以及阳性对照组细胞浓度均显著升高(P<0.05),脉络宁、丹香冠心注射液较生理盐水对照组亦显著升高(P<0.05),且各组CI 均大于2(表3),提示RA-PLNA反应为阳性。
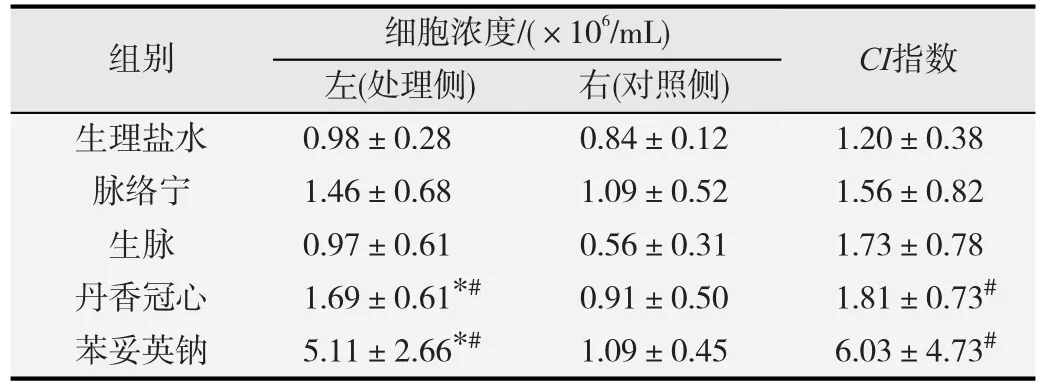
表2 D-PLNA模型中3种中药注射液对淋巴结细胞浓度的影响(-x±s,n=8)
2.2 相关免疫因子的浓度变化
2.2.1 中药注射液对IgE的影响 免疫球蛋白IgE是介导I型超敏反应的重要细胞因子。在D-PLNA模型中,3种中药注射液对IgE无促进作用(表4)。与对照侧相比,加入TNP-OVA后,脉络宁、丹香冠心注射液与阳性药物对照组IgE水平显著升高(P<0.05),加入TNPFicoll后,脉络宁注射液和阳性药物对照组均促进IgE的分泌,差异均有统计学意义(P<0.05),见表5。

表3 RA-PLNA模型中3种中药注射液对淋巴结细胞浓度的影响(-x±s,n=8)
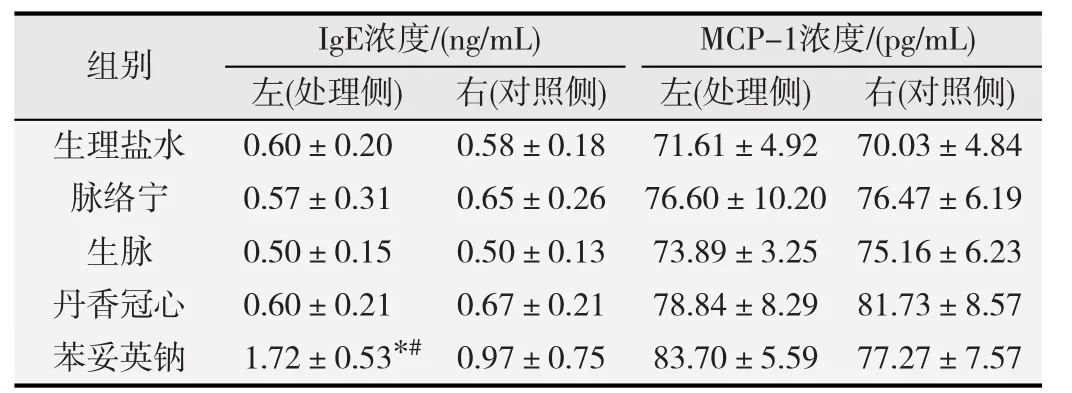
表4 D-PLNA模型中,3种中药注射液对IgE和MCP-1浓度的影响(-x±s,n=8)
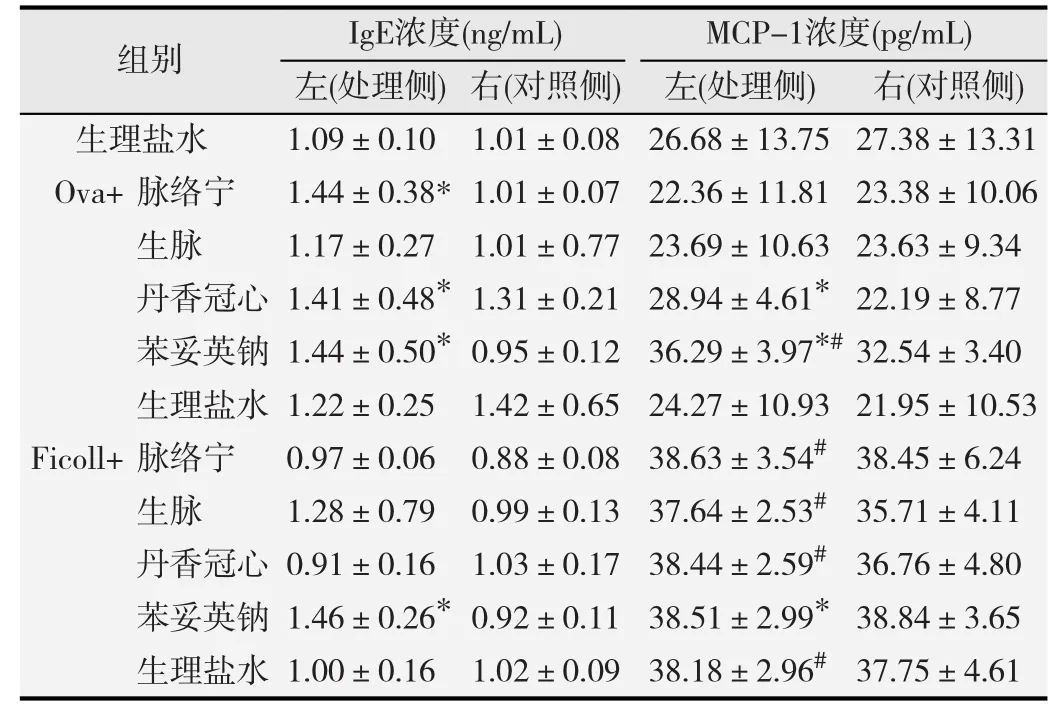
表5 RA-PLNA模型中,3种中药注射液对IgE和MCP-1浓度的影响(-x±s,n=8)
2.2.2 中药注射液对MCP-1的影响 结果显示,在D-PLNA模型中,与对照侧相比,各组均无显著差异(表4)。加入报告抗原后,丹香冠心注射液与报告抗原TNP-OVA共同作用时,与生理盐水阴性对照组相比显著促进MCP-1的分泌(P<0.05),而与TNP-Ficoll联合给药后,与未处理侧相比,MCP-1浓度显著升高(P<0.05);而脉络宁与生脉注射液与TNP-Ficoll作用时,和生理盐水组相比,MCP-1浓度均显著升高(P<0.05),见表5。
3 讨论
在直接腘窝淋巴结实验(D-PLNA)中,只有丹香冠心注射液细胞浓度显著增加。由于中药注射液成分复杂,5-HMF单体和二聚体为小分子化合物,需要与蛋白结合后才能诱发免疫失调,所以我们需要利用RAPLNA模型进一步观察其对淋巴细胞的影响,对中药注射液的致敏性进行更完整深入的评价,以充分提示临床用药风险[9]。
在报告抗原腘窝淋巴结实验(RA-PLNA)中,本实验选取TNP-OVA和TNP-Ficoll两种报告抗原。TNPOVA是一种T细胞依赖性抗原,当给予极低剂量时,自身不会诱发免疫反应,需要辅助性共刺激信号存在时才能诱导免疫应答产生抗体。而TNP-Ficoll是一种非T细胞依赖性抗原,只有存在新的抗原表位并被T细胞识别后,才能产生IgE抗体,并诱导免疫应答[10-11]。MCP-1是促炎细胞因子,由单核细胞、巨噬细胞、成纤维细胞和角化细胞分泌,可以激活巨噬细胞,刺激嗜碱性粒细胞释放组胺[12]。实验结果显示,脉络宁注射液加入0.2 μg/μL TNP-OVA后,IgE分泌显著增加,而加入0.2 μg/μL TNP-Ficoll后,细胞浓度及MCP-1浓度与对照侧相比显著升高,提示脉络宁注射液中可能存在小分子物质,可以作为一种新的抗原与报告抗原结合后被T细胞识别诱导免疫反应。生脉注射液仅与0.2 μg/μL TNP-Ficoll共同作用时,细胞计数指标呈阳性,且MCP-1浓度较对照侧显著升高,提示我们生脉注射液中也可能存在作为新的抗原分子的物质。丹香冠心注射液与0.2 μg/μL TNP-OVA共同作用时,显著促进IgE和MCP-1的分泌,而加入相同剂量TNP-Ficoll后,细胞浓度和MCP-1浓度与对照侧相比显著升高,同时在D-PLNA中,细胞数显著增加,提示丹香冠心注射液成分复杂,可能直接诱导Ⅰ型超敏反应,也可能作为半抗原的小分子物质与报告抗原结合诱发超敏反应。
总之,在D-PLNA模型中反应为阴性的指标,在注射剂与报告抗原共同作用后,出现了阳性结果,由于D-PLNA容易出现假阴性,对于半抗原引起的免疫失调不敏感的特点,我们可以得出结论,RA-PLNA对于5-HMF单体和二聚体的致敏性更为敏感,而通过加入不同的报告抗原能够进一步确证受试物在体内仅仅是炎症刺激物还是形成了新的抗原或表位[13],为进一步的机制研究提供思路和方向。但由于中药注射液成分复杂,可能同时存在包括5-HMF单体以及二聚体等多种小分子物质,对其单独成分的进一步免疫评价也十分必要。
与此同时,中国药典对中药注射液中5-HMF及其二聚体的含量限度并没有明确的规定,我们先前的研究证明5-HMF可以作为一种辅助刺激因子诱导Ⅰ型免疫反应,OMBF可提供辅助刺激信号和作为新的抗原表位被识别,从而诱导Ⅰ型和Ⅱ型混合型免疫反应,也能促进非同源的T、B细胞间相互作用[3]。本实验结果进一步证明了5-HMF及其二聚体OMBF可能在中药注射液中作为小分子半抗原与体内蛋白相结合造成免疫系统的失调。因此,为了进一步提高用药安全,对相关中药注射液中小分子物质5-HMF单体及二聚体的质量控制和深入研究非常必要。

