协同刺激分子B7-H4在小鼠食管癌前病变中的表达
陈欣然,单保恩*
(1.河北医科大学第四医院药学部,河北 石 家庄 050011;2.河北医科大学第四医院科研中心,河北 石 家庄 050011)
食管癌是常见的消化道肿瘤,其全世界发病率和病死率分别居癌症的第8位和第6位[1]。根据组织类型的不同,食管癌分为食管鳞状细胞癌(esophageal squmous cell carcinoma,ESCC)和食管腺癌[2]。中国食管癌发病率居世界第一,其死亡人数占全球该病死亡人数的50%以上,平均死亡率为15.02/10万[3]。另外,中国食管癌发病率具有明显的区域高发性,河北和河南太行山两侧区域是主要的高发区,且95%以上为ESCC[4]。ESCC的特点是早期无明显症状,因此癌症早期确诊比例不足5%,绝大多数患者确诊时已是中晚期。手术和放化疗是ESCC的主要治疗手段,但由于ESCC中晚期肿瘤细胞发生转移,治疗效果和预后较差,5年生存率不足20%[5]。
食管癌前病变是正常食管组织向ESCC转变过程中的一种组织病理异常。根据病变程度的不同,癌前病变可分为低级别上皮内瘤变(low grade intraepithelial neoplasia,LGIN)和高级别上皮内瘤变(high grade intraepithelial neoplasia,HGIN)[6]。食管癌前病变包括了ESCC形成的整个过程,但尚未发生转移。因此如果在食管癌前病变阶段给予恰当的诊断和治疗,治疗效果显著提高。
亚硝胺是一类作用广泛的致癌物,其前体物硝酸盐、亚硝酸盐和二级胺广泛分布于自然环境中。流行病学研究显示,亚硝酸及硝酸盐的高摄入是ESCC的重要病因。世界范围内食管癌高发区饮水中硝酸盐含量显著高于低发区[7]。我国ESCC高发区,特别是涉县、赤城县的饮水中,硝酸盐、亚硝酸盐和二级胺的含量显著高于其他地区,且与当地居民ESCC和食管癌前病变的患病率呈正相关[8]。4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide,4NQO)是一种水溶性喹啉衍生物,化合物中含有硝酸氮,是一种诱癌的亚硝胺前体物[9]。小鼠食管癌前病变的病变进程和病理特征与人无明显差异[10],本研究中,我们利用4NQO饮水法诱导了小鼠ESCC癌前病变模型。我们发现,此模型很好地模拟了人ESCC形成过程,可以通过该模型研究ESCC形成的分子机制。
B7-H4,又称B7s1或B7x[11],是B7家族中成员,于2003年被3个实验室同时发现。B7-H4蛋白在正常组织中表达呈阴性,但在许多恶性肿瘤组织中高表达,如肺癌[12]、 卵巢癌[13]、 前列腺癌[14]、 黑色素瘤[15]、胃癌和乳腺癌[16],且与肿瘤的恶性程度和不良预后呈正相关。B7-H4在细胞膜、细胞质、细胞核和血清中均有分布[17]。细胞膜B7-H4主要在肿瘤的免疫逃逸中发挥作用,细胞质和细胞核B7-H4则主要参与调控肿瘤细胞增殖和细胞周期进程。然而,目前还未见关于B7-H4在食管癌前病变进程中的报道。
鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen,SCCA)是从宫颈鳞癌组织中分离的一组肿瘤相关性糖蛋白。研究发现SCCA-2在食管癌组织有选择性表达,外周血SCCA表达与ESCC的肿瘤分期和病变长度呈正相关,其含量变化反映了ESCC病变的进展情况,可以作为食管肿瘤的辅助诊断和判断疾病发展的一个重要依据[18]。本文通过研究B7-H4在食管癌前病变的小鼠食管组织的表达特点,比较在食管癌前病变进程中B7-H4和SCCA-2的表达差异,分析其临床意义,探讨其作为食管癌前病变生物标志的可能性,为ESCC的早期诊断和治疗提供新思路。
1 材料与方法
1.1 实验材料和实验试剂
4NQO,购于美国Sigma公司;BCA蛋白定量试剂盒,购于上海捷瑞生物科技公司;兔抗人B7-H4单抗,购于美国GeneTex公司;兔抗人β-actin单抗,购于美国Rockland公司;羊抗兔荧光二抗,辣根过氧化物酶羊抗兔二抗,购于美国Sant Cruz公司;Western blot信号增强试剂盒,购于美国Thermo公司;SCCA-2 ELISA试剂盒,购于上海Blue Gene生物科技公司。C57BL/6小鼠,5~6周龄,雌雄各半,购于北京维通利华实验动物有限公司,合格证号:114007000035608。动物饲养于SPF环境,温度18~24 ℃,湿度40%~60%,照明按12 h/12 h明暗交替。所有动物实验操作均符合河北医科大学动物福利指导原则标准。临用前将4NQO粉末溶于灭菌的蒸馏水中并稀释至50 μg/mL。
1.2 模型建立
133只C57BL/6小鼠,适应性饲养1周后,分为空白对照组(n=42)和4NQO诱癌组(n=91)。实验持续28周。空白对照组28周内均给予无菌蒸馏水;4NQO诱癌组在第1~15周给予50 μg/mL的4NQO,第16~28周给予无菌蒸馏水。从第16~28周,每两周处死一批动物,包括6只空白对照组和13只4NQO诱癌组小鼠。诱癌及实验操作流程参见图1。
1.3 标本收集
将小鼠摘眼球取血,室温放置10 min,4 000 r/min离心10 min,分离血清。脱颈椎处死动物,暴露胸腔和腹腔,分离食管组织,用生理盐水清洗残余血液后,纵向剖开,然后从贲门端向舌端卷成多层圆筒形,并用大头针固定。将固定好的食管组织放入4%多聚甲醛中固定72 h,石蜡包埋,之后切成4 μm连续切片,用于HE染色评价。

图1 4NQO诱导小鼠食管癌前病变模型图
1.4 HE染色
取组织标本,经95%乙醇溶液和二甲苯脱水透明后,石蜡包埋。自动切片机切成3 μm厚的切片,经二甲苯脱蜡和梯度乙醇水化后进行HE染色,中性树胶封固,在光学显微镜下观察食管组织的病理变化,中性树胶封固。
1.5 免疫组织化学染色分析B7-H4的表达
将切片置于60 ℃恒温箱干烤过夜,经过乙醇梯度脱水,二甲苯透明和3%的过氧化氢灭活内源性过氧化物酶20 min,高压热修复后,PBS清洗切片,滴加兔抗人B7-H4单克隆抗体(1∶500稀释),4 ℃孵育过夜。PBS清洗后滴加牛血清白蛋白封闭液,37 ℃封闭45 min。PBS清洗后,滴加辣根过氧化物酶羊抗兔二抗,37 ℃孵育60 min。PBS清洗,DAB显色剂显色,中性树胶封固。
免疫组织化学检测结果由两位病理科医师独立双盲评估。光学显微镜下每张切片随机观察5个高倍(×400)视野,每个视野计数100个上皮细胞。在细胞质和(或)细胞膜上有棕黄色颗粒的视为阳性表达细胞。B7-H4表达水平评分标准:①阳性细胞比例得分,阳性细胞≤33%为1分,>33%~66%为2分,>66%为3分;②染色强度得分,无着色或淡黄色为1分,棕黄色为2分,棕褐色为3分。结果判断:两者相乘为最终得分,其中得分≤3分判定为B7-H4低表达组,得分>3分判定为B7-H4高表达组[19]。
1.6 Western blot法检测血清B7-H4蛋白表达
取血清,用BCA试剂盒进行蛋白定量,然后用生理盐水将血清样本稀释至4 μg/μL。稀释后的血清与上样缓冲液按3∶1比例混合,100 ℃煮沸5 min变性。每个样本取50 μL(150 μg)进行Western blot实验至转膜结束[20]。然后按Western blot信号增强剂试剂盒说明书进行操作:将膜用超纯水洗2次,每次5 min。将膜浸入25 mL信号增强剂,摇床振荡15 min。再将膜用超纯水洗2次,每次5 min。脱脂奶粉封闭60 min后,将膜浸入用抗体稀释剂稀释的小鼠抗B7-H4单抗(1∶500),4℃孵育过夜。TBST洗膜3次,加入二抗,37 ℃孵育60 min,TBST洗膜3次,荧光扫描分析。
1.7 ELISA法测定SCCA-2浓度
根据BCA定量的血清蛋白浓度,用生理盐水将血清稀释至5 μg/μL。用纯化的抗体包被微孔板,然后加入50 μL标准品或血清样本,然后依次加入生物素化的抗体、辣根过氧化物酶和标记的亲和素,经过彻底洗涤后用底物TMB显色。用酶标仪在450 nm下测定吸光度,并计算样本血清SCCA-2浓度。
1.8 Western blot法检测食管组织B7-H4蛋白表达
取食管组织,低温匀浆,RIPA裂解液提取总蛋白,12 000 r/min低温离心10 min后,转移上清液至预冷的新离心管中,用BCA试剂盒进行蛋白定量[23]。在蛋白样本中加入上样缓冲液,置于沸水中煮沸5 min。取适量蛋白进行10% SDS-PAGE分离蛋白,并转移至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,然后用5%脱脂奶粉室温条件下封闭60 min,再分别放入β-actin(1∶5 000稀释)和B7-H4(1∶1 000稀释)的单克隆抗体中,4 ℃孵育过夜。TBST洗膜3次后,加入羊抗兔荧光二抗,37 ℃孵育60 min,TBST洗膜3次,荧光扫描分析。
1.9 统计学方法
数据分析均采用Graphpad prism 5.0数据分析系统。定量数据以平均值±标准差表示。用Spearman correlation analysis比较不同参数间的相关性,用Oneway ANOVA,Kruskal-Wallis analysis比较不同指标在两组或多组间的差异。以α=0.05为检验水准。
2 结果
2.1 诱癌过程中食管组织的病理改变
从诱癌16周至28周,每2周解剖食管组织(图2)。所有空白对照组小鼠食管组织表面光滑,食管大小粗细均正常。然而,4NQO诱癌组小鼠食管组织却表现为不同程度的病理改变。从第16周至28周,食管上皮组织依次出现大小不同的白斑、增厚、凸起及大小不等的肿块,且与人食管癌前病变组织相似。
HE染色结果显示(图3),在整个诱癌过程中,食管组织经历了从正常食管、LGIN至HGIN的病理改变过程。正常食管上皮细胞表现为细胞形态规则,细胞核和细胞浆大小正常。LGIN则表现为食管上皮增厚,黏膜层下1/2细胞失去极性,细胞核增大,核深染。HGIN则表现为上皮层进一步增厚,黏膜层超过1/2至全部细胞失去极性,细胞核逐渐增至最大值,核深染。LGIN和HGIN统称为食管癌前病变,经过癌前病变的过程,食管鳞状细胞癌形成。从HE染色结果分析,小鼠食管癌前病变的病理特征与人食管癌前病变特征非常相似[10]。
4NQO诱癌时间与食管病理变化之间的关系如表1所示,在本研究中,我们发现空白对照组小鼠食管组织未出现任何异常病理改变,而4NQO诱癌组小鼠食管组织病理级别随着诱癌时间的延长逐渐提高,差异有统计学意义(r=0.55,P<0.01)。另外,雌性与雄性小鼠食管组织病理改变无显著差异(P>0.05)。
综上所述,4NQO饮水法可成功诱导小鼠食管癌前病变的形成。随着诱癌时间的延长,病变级别逐渐提高。

图2 诱癌过程中食管组织变化
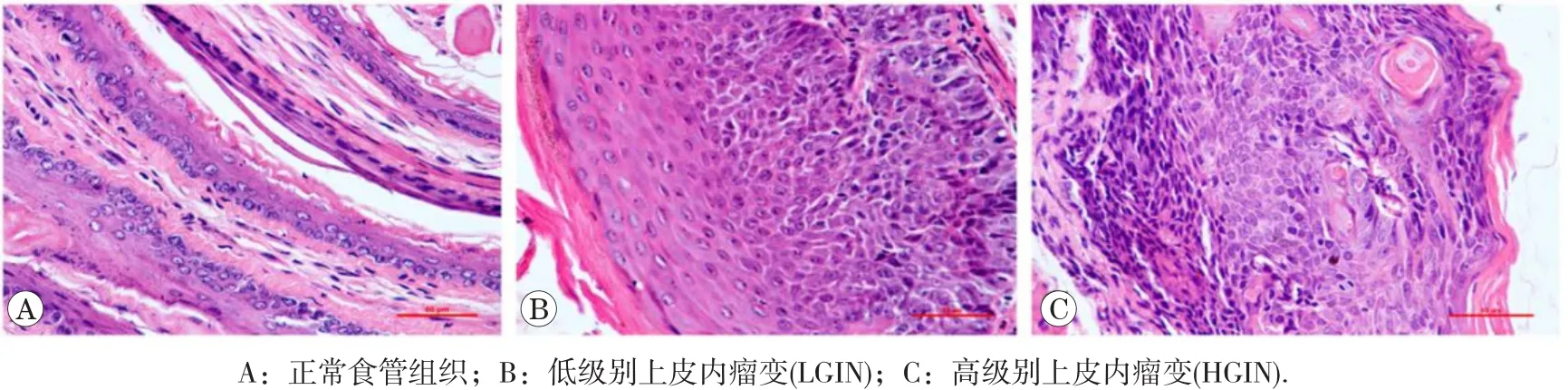
图3 诱癌过程中食管组织HE染色(×400)
2.2 免疫组化分析食管组织B7-H4表达及与病理级别的相关性
结果如图4和表2所示,B7-H4蛋白表达于食管上皮细胞的胞浆和胞膜。根据评分结果(低表达或高表达),22例正常食管组织只有2例B7-H4高表达(9.1%);对于食管癌前病变组织,27例LGIN食管组织有11例B7-H4高表达(40.7%),21例HGIN食管组织有17例B7-H4高表达(81.0%)。Spearman相关性分析表明(如表2所示),B7-H4表达与病理级别呈正相关(r=0.57,P<0.01),而与小鼠性别无相关性(r=-0.03,P=0.79)。
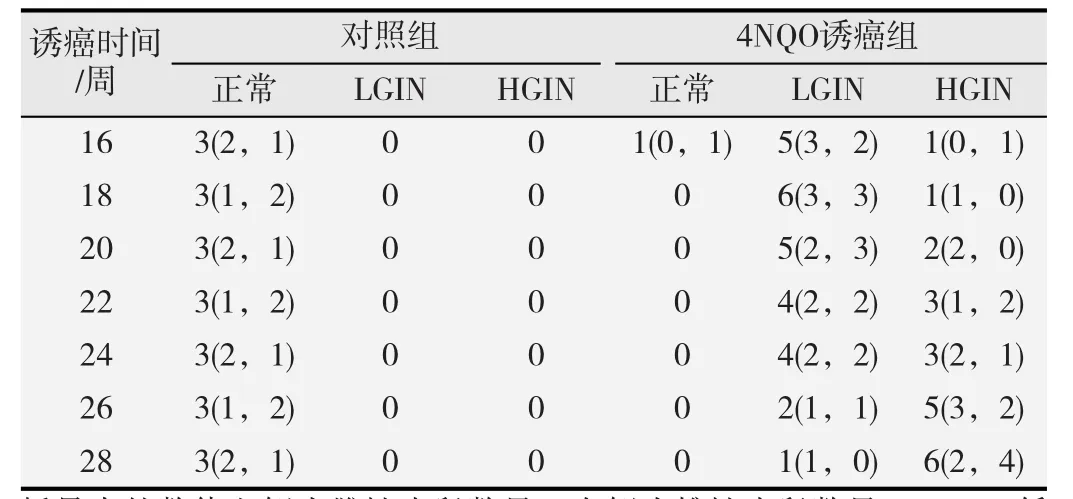
表1 小鼠食管癌前病变进程中食管组织病理改变

表2 小鼠食管癌前病变进程中食管上皮组织B7-H4表达与组织病理级别的相关性
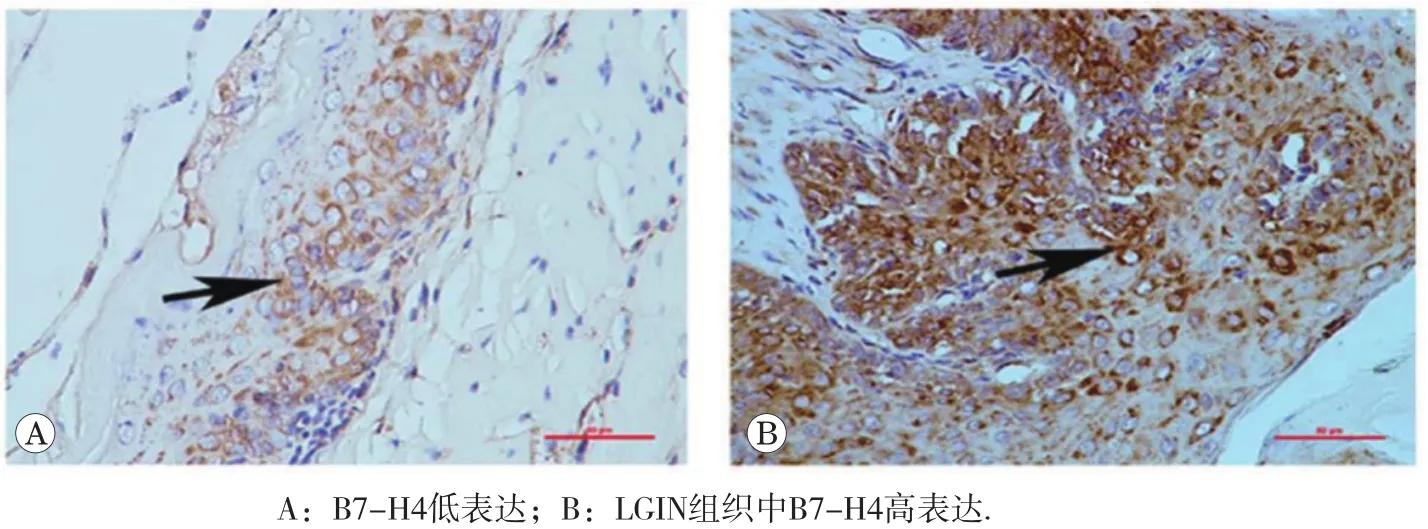
图4 免疫组化检测食管上皮组织B7-H4表达
2.3 B7-H4和SCCA-2蛋白在小鼠血清的表达
ELISA结果如图5所示,正常、LGIN、HGIN 小鼠血清SCCA-2浓度分别为(1.97±0.70)、(1.94±0.57)、(2.73±1.17) ng/mL。食管癌前病变小鼠血清中SCCA-2浓度逐渐提高,与正常小鼠相比,HGIN小鼠SCCA-2浓度显著高于正常对照组(P<0.01)。

图5 食管癌前病变进程中小鼠血清SCCA-2蛋白表达
通过Western blot方法检测血清中B7-H4表达,结果如图6所示。首先进样不同量的血清蛋白(0、50、100、200 μg),扫描其荧光值,考察实验方法的灵敏度和线性。结果显示,本方法在进样量0~200 μg,线性良好,r2=0.998,可以满足实验要求。然后,根据HE检测结果,选取不同食管病理级别的小鼠血清样本进行检测。结果表明,正常、LGIN、HGIN小鼠血清B7-H4相对表达浓度分别为0.31±0.62、0.46±0.61、0.87±0.90。与正常小鼠相比,HGIN小鼠血清B7-H4浓度显著提高(P<0.05)。
上述结果表明,与正常小鼠相比,B7-H4和SCCA-2蛋白在HGIN小鼠血清中表达均显著提高。上述结果提示,B7-H4与SCCA-2两种蛋白均可能成为ESCC及癌前病变的一种新的血清标志物,这对于ESCC的早期诊断具有重要意义。
2.4 Western blot蛋白在小鼠食管组织的表达
结果如图7所示,诱癌第16~28周,对照组小鼠食管组织B7-H4表达无显著改变。因此,将对照组所有小鼠食管组织B7-H4蛋白表达的数据整合。与对照组比较,随着诱癌时间的延长,4NQO诱癌组小鼠食管组织B7-H4蛋白表达逐渐提高,特别是第26周和28周,B7-H4蛋白表达水平显著提高,差异具有统计学意义(P<0.05,P<0.01)。
综上所述,小鼠4NQO诱癌模型中,随着诱癌时间的延长,食管组织依次出现LGIN和HGIN的癌前病变特征,B7-H4表达也逐渐上调。B7-H4在小鼠血清的表达与食管组织的病理级别呈显著正相关。上述结果提示,B7-H4可能参与了食管癌前病变的进程,促进了ESCC的形成,但其作用机制还有待进一步研究。

图6 B7-H4在血清的表达

图7 B7-H4在食管组织的表达
3 讨论
目前,肿瘤动物模型主要包括自发性动物模型,转基因动物模型,诱发性动物模型和移植性动物模型。食管癌前病变模型无自发性和转基因模型的报道,目前主要适用诱发性病变模型。在小鼠诱发性食管癌及癌前病变模型中,常用的诱癌剂主要有4NQO、甲基苄基亚硝胺和对甲基戊基亚硝胺。甲基苄基亚硝胺和对甲基戊基亚硝胺只能用于大鼠实验而不能成功诱导小鼠ESCC及癌前病变,应用受到一定限制[21]。
虽然Tang和Tsang曾报道4NQO可诱导小鼠ESCC形成[22],但对于食管癌前病变尚无详细报道。本研究利用4NQO饮水法成功诱导了食管癌前病变,并详细评价了食管癌前病变进程中的病理变化,以及癌前病变的主要特点。在诱癌过程中,我们发现对照组小鼠食管组织未出现病理变化,而诱癌组第16周食管上皮组织出现白斑,停用诱癌剂后,食管组织病变级别进一步提高。HE染色结果显示,在整个诱癌过程中,食管组织经历了从正常食管组织、LGIN至HGIN的病理改变过程。比较小鼠LGIN和HGIN病理特征,与人食管癌前病变特征基本一致[10]。统计分析表明,4NQO诱癌组小鼠食管组织癌前病变级别与诱癌时间呈显著正相关,也就是说,随着诱癌时间的延长,食管组织病变级别逐渐提高。
ELISA和Western blot结果表明,与正常对照组相比,HGIN小鼠血清B7-H4和SCCA-2表达都显著提高,这提示B7-H4与SCCA-2两种蛋白,可能成为ESCC早期诊断的生物标志物。然而,由于两种蛋白的检测方法不同,不能对两种蛋白的表达进行详细比较。Western blot方法因为灵敏度较低,不是检测血清蛋白的最佳方法。然而,由于没有检测小鼠B7-H4的ELISA试剂盒,也没有用于进行ELISA方法检测的小鼠B7-H4单克隆抗体,本研究只能用Western blot方法替代。在以后的研究中,我们希望能够有机会利用ELISA的方法更精确的检测B7-H4在食管癌前病变小鼠血清的表达变化,为食管癌前病变的血清学诊断提供更准确的依据。
利用Western blot方法检测B7-H4在食管组织的表达,结果表明,正常对照组B7-H4表达较低,且整个诱癌过程中表达无明显变化。与对照组相比,4NQO诱癌组小鼠B7-H4的表达逐渐提高,诱癌第26和第28周,B7-H4的表达水平显著提高,差异具有统计学意义。这个结果与免疫组化的结果相互印证,且B7-H4 的表达与食管组织病理级别和诱癌时间呈显著正相关。这些结果提示,B7-H4蛋白的表达可能参与或促进了食管癌前病变的形成,但其发挥的具体作用及作用机制还不清楚,仍需进一步研究。
在以后的研究中,为了更进一步明确B7-H4在小鼠食管癌前病变中所起的作用,可以通过转基因小鼠进行诱癌实验。具体地说,就是通过比较4NQO饮水法诱导B7-H4敲除和B7-H4野生型小鼠食管癌前病变形成的差异,以及在这个过程中相关分子表达变化,进一步明确B7-H4参与食管癌前病变形成的作用及分子机制,从而探讨B7-H4在食管癌前病变诊断和治疗中的意义。
总之,本研究利用4NQO饮水法成功建立了小鼠食管癌前病变模型,详细研究了食管癌前病变进程的病变特征。在食管癌前病变进程中,B7-H4在食管组织和血清中表达均逐渐提高,提示其可能参与或促进了ESCC的形成,这为ESCC的早期诊断和治疗提供新思路,但作用机制还有待进一步研究。

