水稻地方品种‘月亮谷’纯系对田间稻瘟病菌的选择
夏 欣, 陈 平, 杨 伟, 徐 返, 王云月,李成云, 郑凤萍, 刘永胜, 谢 勇*
(1. 云南农业大学植物保护学院, 昆明 650201; 2. 云南省农业科学院农业环境资源研究所, 昆明 650205;3. 合肥工业大学食品科学与工程学院, 合肥 230009)
元阳县地处滇南低纬高原山区,经纬度在102°27′~103°13′E、22°49′~23°19′N之间,海拔144~2 000 m。北回归线以南,属山地季风气候类型。全县耕地以山地为主,山高谷深,沟壑纵横,海拔高度差异大,立体气候明显。元阳县是一个以水稻OryzasativaL.为主要粮食作物的少数民族聚居地区,梯田稻作系统久负盛名,在20世纪80年代,水稻农家品种(landrace)多达196个,现在仍以种植农家品种为主。2013年被批准列入联合国教科文组织《世界遗产名录》中的文化遗产目录。尽管水稻种植历史悠久,绝大多数种植区都处于稻瘟病易于发生的生态环境下,但至今为止还没有有关稻瘟病Magnaportheoryzae大面积暴发的记载[1]。尤为值得关注的是,一些地方品种种植时间已超百年,在当地稻作系统中一直未被淘汰。其中‘月亮谷’(‘Acuce’)具有优良的农艺性状和丰富的群体间和群体内遗传异质性(inter-and intra-heterogeneity),中抗稻瘟病菌,是在元阳哈尼梯田海拔1 600~1 900 m区域种植的主栽籼稻O.indica品种[2]。
已有的分子证据表明,稻瘟病菌-水稻寄主互作符合经典的基因对基因假说(gene for gene hypothesis),导致同一水稻品种对不同稻瘟病菌菌株表现出明显的抗感差异[3-6]。现代水稻抗病品种抗性的“丧失”是寄主抗性基因与稻瘟菌致病基因互作在群体水平上的表现结果,即寄主品种群体对由稻瘟病菌不同生理小种(race)构成的混合群体产生定向选择(directional selection)作用[7-8]。元阳梯田水稻种植历史悠久,但稻瘟病发生并不严重,其中的科学问题值得深入探索。关于稻瘟菌的培养表型和生物学特性研究,很多学者探讨了病菌的产孢条件、菌落形态及颜色、黑色素合成、产孢量、菌丝生长速率等与致病性之间的关系[9-12]。有研究表明,菌落颜色及黑色素与病原真菌的致病性紧密相关,黑色素是许多病原真菌的毒力因子,在病原真菌的致病过程中起着重要作用[13-15]。本研究采用孢子捕捉法和组织分离法,获得梯田环境中和水稻植株上的稻瘟病菌,从表型上比较两种来源的稻瘟菌之间的差异,初步了解农家品种‘月亮谷’对环境中稻瘟菌群体的选择作用。
1 材料与方法
1.1 水稻品种(系)
1.1.1 田间试验品种
供试水稻品种(系)共5个,包括来源于元阳哈尼梯田地方品种‘月亮谷’的单粒传(single seed descend method, SSD)F8代纯系L1、L2、L3、L4,由农户自留种经8代单粒传获得;‘月亮谷’自然群体G5(来自于农户自留种)。
1.1.2 抗稻瘟病单基因鉴别品系
单基因鉴别品系(NILS)采用国际水稻研究所(IRRI)以‘丽江新团黑谷’(LTH)为轮回亲本培育的水稻近等基因品系:IRBLsh-s、IRBLz-Fu、IRBLb-B、IRBL12-M、IRBLt-k59、IRBLa-A、IRBLi-F5、IRBL3-CP4、IRBL5-M、IRBLks-S、IRBLkm-Ts、IRBL1-CL、IRBLkh-k3、IRBLk-k、IRBLkp-k60、IRBLta-k1、IRBL7-M、IRBL9-W、IRBLz5-CA-1、IRBLzt-T、IRBLta2-Pi、IRBLta2-Re、IRBLta-CP1、IRBL19-A、IRBL20-IR24共25个(种子由IRRI 的Kobayashi博士提供),感病对照品种为‘丽江新团黑谷’。
1.2 田间试验设计
供试的5个水稻品种(系)按元阳哈尼梯田(元阳县新街镇箐口村,23°07′N,102°44′E,海拔1 637.7 m)当地常规育苗方法育苗、移栽。每品种(系)为1个处理,3次重复,每小区30 m2,完全随机区组排列。4周保护行种植‘月亮谷’自然群体。所有施肥、水分管理均为当地传统方法。
1.3 稻瘟菌的分离
1.3.1 供试水稻品种(系)上稻瘟菌的分离
在穗颈瘟发生期(9月),从试验田间分别采集5个水稻品种(系)的感病样本,采用毛细管单孢分离法进行单孢分离,获得来源于水稻寄主的稻瘟病菌株(寄主菌株)[16]。
1.3.2 梯田环境中稻瘟菌的获得
采用便携式孢子捕捉仪(YFBZ3,河南云飞科技发展有限公司),按说明书进行田间孢子捕捉,持续时间为2周。具体方法为:在上述试验田中按5点取样法放置孢子捕捉仪,每次捕捉时间从上午9时开始定时开机5~8 h,然后采用单孢分离法在体视显微镜下分离稻瘟菌,获得来源于梯田环境中的稻瘟病菌株(环境菌株)[17]。
1.4 稻瘟菌的培养与形态观察
米糠培养基:米糠经过粉碎后,称取20 g,加水煮15 min,然后加入琼脂16 g,酵母浸膏2 g,定容到1 L,混匀分装,于121℃高压灭菌40 min。
将分离纯化的菌株接种到米糠培养基上,在L∥D=12 h∥12 h,24~26℃下培养9 d后用直径为9 mm的打孔器分别打取菌饼,菌饼朝下转移到新鲜米糠培养基上,在26℃下培养9 d后,用数码照相机拍照,记录菌落形态特征。刮除培养基上菌落的表面菌丝,观察黑色素颜色并拍照。
1.5 稻瘟菌菌丝生长速率测定
分别将寄主菌株(4、8、40、45、128)和环境菌株(139、141、203、244、287)的稻瘟菌单孢菌株接种于米糠培养基,26℃培养7 d,用打孔器(直径5 mm)分别从菌落的边缘处打取菌饼,将菌饼朝下在无菌条件下转移到米糠培养基中央,置于26℃条件下培养9 d。采用十字交叉法垂直测量菌落直径。每隔3 d测量1次菌落生长直径,根据所测结果计算纯生长量。
纯生长量(mm)=菌落平均直径(mm)-菌饼直径(mm);
日均生长量=纯生长量(mm)/生长天数。
1.6 稻瘟菌产孢量测定
将两种不同来源的各5个稻瘟菌单孢菌株分别在米糠培养基上培养7 d,从菌落边缘同一圆周上用打孔器取菌碟,转移到新的培养基上,设置6次重复,放在28℃培养箱,培养9 d后,将10 mL无菌水倒入平板中,用接种环刮取菌丝和孢子,振荡仪振荡2 min,纱布过滤,定容至10 mL,在10倍显微镜下,用血球计数板计算孢子浓度。孢子浓度=(5个小方格孢子总数/80)×4×106。
1.7 抗稻瘟病单基因鉴别品系的接种与致病型测定
将水稻单基因鉴别系浸种催芽后播种于塑料盆中(60 cm×40 cm×25 cm),栽培土壤为灭菌稻田土,每70 L中加入2 L火山石混匀。每品种播15粒,设3次重复。在温室内育苗,2 叶期开始每周追施尿素0.5 g/盒,共2~3次。分别从寄主菌株和环境菌株群体中各随机挑选5个菌株作为接种菌株,于水稻秧苗3.5叶期进行喷雾接种,秧苗接种后置恒温保湿培养箱内于25℃、相对湿度≥95%,黑暗条件下保湿培养24 h,随后移出置温室内培养,每天用清水喷雾以保持温室的湿度。接种7 d后参照Gallet等[18]的方法进行病害调查。
病害调查标准为[18]:1级,没有病斑;2级,有少量针尖点状褐色病斑;3级,有大量针尖点状褐色病斑,或较大褐色病斑;4级,在褐色病斑中间有灰白色坏死组织;5级,灰色坏死组织扩大,病斑呈典型梭形病斑;6级,灰白色病斑或很大的梭形病斑,周围没有或有少量褐色包围。
抗感分级标准:1~3级为抗病反应(R),4~6级为感病反应(S)。根据抗感反应表型分别统计接种菌株对某个鉴别品系的毒力频率(virulence frequency,VF)和测试菌株对所有鉴别品系的联合致病性(pathogenicity association,PA)[19]。
毒力频率=(有毒力菌株数量/菌株总数量)×100%;
联合致病性=(接种菌株群内对某品种的致病菌株数量/该群内总菌株数量)×100%。
1.8 数据整理与统计分析
采用Excel软件整理原始数据,显著性检验和分析由SPSS(Version 18.0)软件的Wilcoxon成对测验法(Wilcoxon Matched Pairs Test)完成。
2 结果与分析
2.1 两种不同来源的稻瘟菌株菌落形态及黑色素产生情况
环境菌株(4、128、40、45、8)和寄主菌株(203、139、287、141、244)的菌落正面都近似圆形,菌落颜色从中心向周围逐渐变浅,气生菌丝逐渐变稀疏,其中部分菌株出现同心轮纹。环境菌株在米糠培养基表面生长时菌落疏松,呈绒毛状,放射散生在培养基表面,菌落颜色从中心到边缘依次呈白色、灰白色,菌落背面颜色较浅,产生少量黑色素;寄主菌株在米糠培养基上的菌落较致密,呈地毯状,匍匐蔓延在培养基表面,菌落颜色从中心到边缘依次呈现灰白色、褐色,背面颜色较深,产生黑色素较多。与环境菌株4、128、40、45、8相比,寄主菌株203、139、287、141、 244菌落颜色普遍较深,说明黑色素合成较多(图1)。

图1 不同来源的稻瘟病菌菌落形态及产生黑色素情况Fig.1 Observation of colony morphology and melanin formation of Magnaporthe oryzae isolates
2.2 稻瘟菌株菌落生长速率比较
稻瘟菌株分别在培养3、6、9 d时,菌落直径总体差异不大,到后期生长曲线总体趋于平缓。环境菌株生长速率波动不明显,而寄主菌株生长速率波动相对较大,其中菌株287生长速率最快,平均生长直径均大于其他菌株,寄主菌株139生长最慢(图2)。总体上,环境菌株菌丝生长速率与寄主菌株菌丝生长速率之间没有显著差异。
2.3 两种不同来源的稻瘟菌产孢量比较
在参测的10个菌株中,寄主菌株244产孢量最大,显著高于其他菌株,寄主菌株287产孢量最低,显著低于环境菌株40、45、128和寄主菌株139、203、141和244,另一个菌株203产孢量也较低。比较梯田环境菌株,除菌株45产孢量与菌株4、8差异显著外,与其他梯田环境菌株差异不显著。而对于寄主菌株139、141,产孢量显著低于菌株244,但显著高于287、203。以上结果表明,梯田环境菌株总体产孢量与寄主菌株产孢量之间没有显著差异,但个别菌株之间产孢量差异较大。

图2 不同来源的稻瘟菌菌株菌丝生长速率Fig.2 Mycelial growth rate of Magnaporthe oryzae strains obtained from different sources

图3 环境稻瘟菌菌株与寄主菌株产孢量的比较Fig.3 The spore quantity produced by Magnaporthe oryzae isolates obtained from different sources
2.4 两种不同来源的稻瘟菌致病性分析
从环境菌株和寄主菌株中各随机挑选5个菌株,用25个近等基因系(NILs)测定其致病性。结果表明,总体上近等基因系鉴别品种对来源于环境中的稻瘟菌菌株的抗性高于水稻寄主上的稻瘟菌菌株,平均毒力频率为24.8%,而来源于水稻寄主上的菌株毒力达到38.4%,联合致病性也显示出来源于水稻寄主上的菌株比来源于环境的菌株致病性更高。初步结果表明,寄主水稻上的菌株其致病性强于梯田环境菌株(表1)。
根据基因对基因理论,只有抗病基因与相应的无毒基因才能产生非亲和性互作(incompatible interaction)。从本试验结果可以看出,在元阳梯田种植携带质量抗性基因Pik-h、Piz-t、Pib、Pit、Pi1、Piz-5(Pi2)、Pi11、Pi12、Pik-m、Pi20、Pita-2的品种其稻瘟病发生的风险将显著降低,若仅携带Pik、Pik-p、Pi7和Pi19则病害发生的风险较高。
2.5 稻瘟菌菌株致病性与生物学特性之间的关系
为了解培养性状与菌株致病性间的关系,分析了不同菌株的联合致病性与菌落颜色、黑色素深浅、菌株生长速率、产孢量之间的关系。结果(表2)表明,菌株的致病性与生长速率和产孢量之间无明显相关关系。而与黑色素的产生有一定关系,即黑色素产生越多,颜色越深,致病性越强。如来源于水稻寄主的菌株203、141、287和244的联合致病性均高于24.0%。而产生黑色素较少的菌株,联合致病性相对较低。
表1稻瘟菌菌株在鉴别近等基因系上人工接种的致病表型鉴定结果
Table1PathogenicityassayofMagnaportheoryzaeisolatesonNILSbyusingartificialinoculation

近等基因系NILs抗病基因R gene环境菌株 Aerial isolate481284045毒力频率/%VF寄主菌株 Host isolate139141244287203毒力频率/%VFIRBLA-APiaSSRSR60SSRSS80IRBLI-F5PiiSSSSR80SSRSS80IRBLKS-SPik-sSSRSR60SSRSS80KRBLK KAPikSSSSR80SSSSS100KRBLKP-K60Pik-pSSSSS100SSSSS100KRBLKH-K3Pik-hRRRRR0RRRRR0IRBLZ FUPizRRRRR0RSRSS60IRBLZ5-CAPiz-5(Pi2)RRRRR0RSSSS80IRBLZT-TPiz-tRRRRR0RRRRR0IRBLTA-K1PitaSRRRR20RRRRS20IRBLB-BPibRRRRR0RRRRR0IRBLT-K59PitRRRRR0RRRRR0IRBLSH-SPishRRRRR0RSRRS40IRBL1-CLPi1RRRRR0RRRRR0IRBL3-CP4Pi3SSRSR60RRSRS40IRBL5-MPi5RRRRR0RSRRS40IRBL7-MPi7SSRRS60SSSSS100
续表1Table1(Continued)

近等基因系NILs抗病基因R gene环境菌株 Aerial isolate481284045毒力频率/%VF寄主菌株 Host isolate139141244287203毒力频率/%VFIRBL9-WPi9RRRRR0RSRRS40IRBL12-MPi12RRRRR0RRRRR0IRBL19-APi19SSSSS100SSSSS100IRBLKM-TSPik-mRRRRR0RRRRR0IRBL20-IR24Pi20RRRRR0RRRRR0IRBLTA2-PIPita-2RRRRR0RRRRR0IRBL11-ZHPi11RRRRR0RRRRR0IRBLZ5-CAPiz-5(Pi2)RRRRR0RRRRR0LTH-SSSSS100SSSSS100联合致病性/%Pathogenicity association36321628122848243656平均 Average24.838.4
表2菌株致病性与菌株培养性状及表型的比较1)
Table2ComparisonbetweenpathogenicityandphenotypictraitsofMagnaportheoryzaeisolates
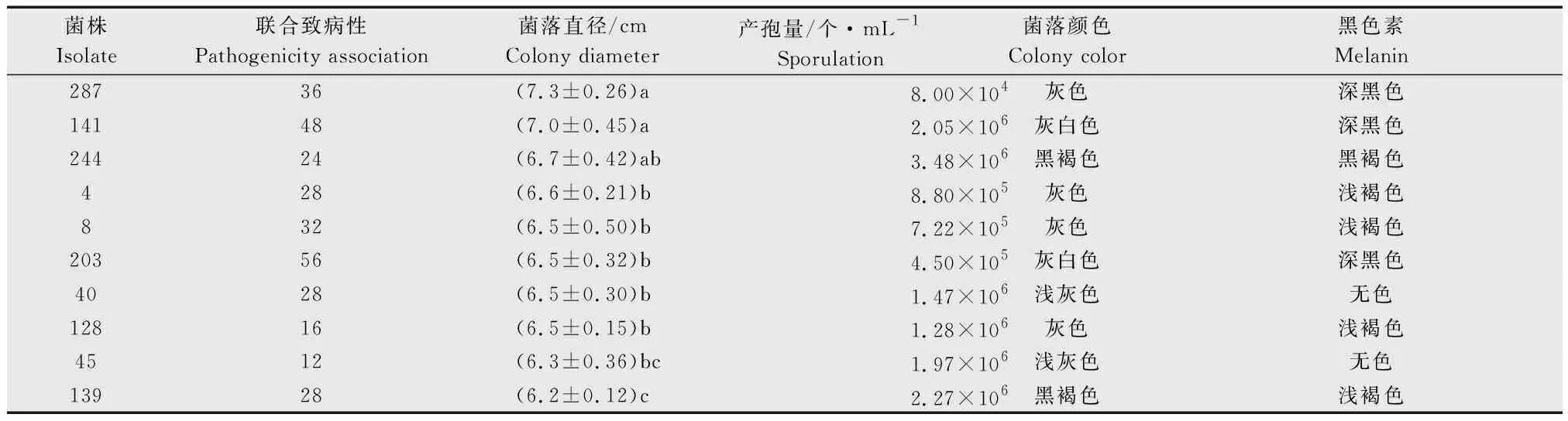
菌株Isolate联合致病性Pathogenicity association菌落直径/cmColony diameter产孢量/个·mL-1Sporulation菌落颜色Colony color黑色素Melanin28736(7.3±0.26)a8.00×104灰色深黑色14148(7.0±0.45)a2.05×106灰白色深黑色24424(6.7±0.42)ab3.48×106黑褐色黑褐色428(6.6±0.21)b8.80×105灰色浅褐色832(6.5±0.50)b7.22×105灰色浅褐色20356(6.5±0.32)b4.50×105灰白色深黑色4028(6.5±0.30)b1.47×106浅灰色无色12816(6.5±0.15)b1.28×106灰色浅褐色4512(6.3±0.36)bc1.97×106浅灰色无色13928(6.2±0.12)c2.27×106黑褐色浅褐色
1) 图中英文字母a、b、c表示在P<0.05水平上差异显著。
The letters a, b and c indicate significant difference at 0.05 level.
3 讨论
寄主-病原菌之间的协同进化(co-evolution)是两者遗传变异的驱动因素之一。在长期的水稻栽培过程中,稻瘟菌与水稻寄主在同一生态条件和环境因子的作用下,稻瘟菌的优势生理小种或遗传宗群(lineage)也会发生相应变化[19]。原因是不同水稻品种可能携带不同的抗病基因,对稻瘟菌群体产生不同的选择压力。因此,稻瘟菌生理小种的分化明显。有报道,我国南方与北方稻作区稻瘟菌小种的组成差异较大[20-21]。元阳哈尼梯田稻作系统相对封闭,农家品种丰富,采用独有的生产方式。推测在这种环境条件下,农家品种对稻瘟菌群体在时间和空间(temporal and spatial)结构上的影响将会表现出不同的作用方式。农家品种是一个不同基因型的混合群体[2, 22-24],本文分析了‘月亮谷’单粒传纯系对梯田环境中稻瘟菌群体的选择作用,初步研究了稻瘟菌的表型性状与致病性的关系。结果表明,不同来源菌株在相同培养基上的培养性状有明显差异,菌落形态差异较大,说明元阳哈尼梯田稻瘟菌群体具有丰富的多样性。但菌落特征、生长速率、产孢能力等形态特征与其来源没有对应关系。
黑色素(melanin)在植物病原真菌中广泛存在,与病原菌致病能力密切相关。稻瘟菌通过提高细胞膨压,机械突破水稻寄主表皮[25-26]。本研究结果表明,在米糠培养基上,寄主菌株菌落颜色呈白色、灰白色,颜色深浅不均匀,除个别菌株外,产生黑色素能力均较强,梯田环境菌株菌落颜色普遍较浅,稻瘟菌株产生黑色素能力相对较弱。由于‘月亮谷’对稻瘟病总体上属于中抗(MR)水平[2],因此从‘月亮谷’单粒传品系上分离到的稻瘟菌菌株比从环境中(可能来源于其他地方品种)捕获的菌株致病性强。
为明确本研究中稻瘟菌菌株可能携带的致病因子或无毒基因,采用以‘丽江新团黑谷’为轮回亲本构建的单基因鉴别品系进行人工接种试验。分别测定了来源于梯田环境和寄主‘月亮谷’纯系的稻瘟菌菌株的联合致病性、毒力频率以及测定菌株可能携带的无毒基因种类。结果显示,梯田环境中的稻瘟菌具有丰富的致病表型,总体上来源于‘月亮谷’的菌株具有更高的毒力频率(38.4 vs 24.8)。显然,从‘月亮谷’上分离到的菌株是梯田环境中菌株经过抗性选择的结果,如果仅考虑与这25个抗性位点相关的遗传位点,说明尽管‘月亮谷’在当地种植了上百年,与稻瘟病菌间的协同进化仍然处于动态进化过程中,远未达到哈迪-温伯格平衡(Hardy-Weinberg equilibrium)。这也许与哈尼族的轮种或换种习惯有关[22,27]。
根据基因对基因假说,从对25个单基因鉴别品系的致病性测定结果可以推导出参测的稻瘟菌菌株的无毒基因种类,即抗病基因Pik-h、Piz-t、Pib、Pit、Pi1、Piz-5(Pi2)、Pi11、Pi12、Pik-m、Pi20、Pita-2相对的无毒基因。由于本研究的样本量较小,还需扩大样本数,采用群体遗传研究策略,进一步测定代表单倍型(haplotype)及其可能携带的无毒基因种类,在清楚当地主要农家品种的抗性基因组成的基础上,才能更好地指导哈尼梯田农家品种科学合理布局,有助于当地水稻生产和元阳哈尼梯田非物质文化遗产的持续保护。

