γ-聚谷氨酸水凝胶对Cd2+、Pb2+的吸附性能
朱学亮, 罗文亚, 李 光, 陈双喜
(河南大学生命科学学院微生物工程研究所,河南开封 475004)
随着工业化迅猛发展,特别是含重金属工业废水的排放,使得环境中积累了大量的重金属,由于重金属具有高毒、难降解等特性,严重危害人类健康和社会可持续发展,所以,重金属污染的治理已经成为一个亟需解决的全球性问题[1-2]。铅(Pb)和镉(Cd)是2种对人体毒性高且无生理功能的重金属元素[3],即使微量也会对成年人和儿童的健康造成极大的损害[4]。有研究显示,儿童体内Pb含量一旦高出100 μg/L时,会影响儿童脑部发育,且Pb每上升100 μg/L时,儿童的智力会下降1~3分[5]。此外,Cd会引起肺癌、肺腺癌、前列腺增生病变、骨折、肾功能不全和高血压等诸多疾病[6]。目前,重金属污水处理中所使用的物理化学及生物方法包括化学沉淀、离子交换、过滤、反渗透、吸附、膜生物反应器和电化学等。其中吸附法因其成本低、效率高、可选择吸附剂多等诸多优点而被广泛用于重金属污染的处理。而在所有吸附剂中,生物质吸附剂的开发受到人们的高度重视[7]。
γ-聚谷氨酸(γ-PGA)是一种由微生物合成的氨基酸聚合物,由D型和L型谷氨酸通过α-NH和γ-COOH之间形成的酞胺键连接而成,分子链上具有大量活性较高的游离侧链—COOH[8],对污染物具有很高的亲和力,有利于其与重金属结合。γ-PGA具有水溶性、无毒性、可生物降解和可食用等特性,因此被广泛用于制药,食品加工,化妆品生产和水处理等领域[9]。国内外许多学者已经研究了将γ-PGA用于重金属的去除[10-11]。但是,由于γ-PGA具有很强的水溶性,吸附重金属后,如果不能找到合适的载体,吸附剂就难以回收再利用,从而造成资源的极大浪费。为了降低经济成本,实现吸附剂的重复利用,本研究以γ-PGA为原料,乙二醇缩水甘油醚为交联剂,采用溶液聚合法合成了新型γ-PGA水凝胶重金属吸附剂,合成后的吸附剂既保留了其吸附特性,又可以回收再使用,而且对Pb2+和Cd2+表现出极高的吸附能力,可以作为良好的生物质重金属吸附材料。
1 材料与方法
1.1 仪器与试剂
仪器:FD-1E-E80超低温真空冷冻干燥机(上海比朗仪器制造有限公司),TS-2102恒温摇床(上海智城分析仪器有限公司),ZWY-110X30往复式恒温水浴摇床,Optima-8000电感耦合等离子体发射光谱仪(铂金埃尔默仪器有限公司),AL-104分析天平(梅特勒-托利多仪器有限公司),Spectrum Two傅里叶变换红外光谱仪(铂金埃尔默仪器有限公司)。
试剂:Cd(NO3)2·4H2O、Pb(NO3)2、HNO3、NaOH、HCl、乙二醇二缩水甘油醚均为分析纯,聚谷氨酸(实验室自制,分子量为600 ku)。
1.2 γ-PGA水凝胶的制备
精确称取1.6 gγ-PGA放入50 mL的三角瓶中,再将 10 mL pH值为5的蒸馏水加入三角瓶中,使用磁力搅拌器搅拌,使γ-PGA充分溶解,而后加入交联剂聚乙二醇二缩水甘油醚0.32 g,振荡混匀后置于40 ℃的恒温水浴摇床中,振荡反应48 h后,取出胶体,放入2 000 mL量杯中,加入过量的蒸馏水。每隔24 h,将量杯中的蒸馏水换1次。待胶体充分吸水后,将胶体取出,放入超低温真空冷冻干燥机冻干,制得γ-PGA-GDE吸附剂。
1.3 红外光谱
将吸附重金属后的γ-PGA-GDE和未吸附重金属的γ-PGA-GDE经超低温真空冷冻干燥机冻干后,溴化钾压片,使用Spectrum Two型傅里叶变换红外光谱仪进行扫描分析。
1.4 扫描电镜
将冷冻干燥过的γ-PGA-GDE样品固定到导电胶布上,竖直放置到离子溅射仪的样品台上,抽真空1 min,离子溅射30 s对样品进行离子溅射镀膜。然后将样品放入SEC扫描电镜中,高真空模式观察其组织形态。
1.5 吸附试验
取250 mL锥形瓶,分别加入20 mgγ-PGA-GDE和 50 mL 含不同浓度的重金属离子溶液(Cd2+、Pb2+)。将三角瓶放入恒温摇床中,25 ℃振荡反应3 h后,取出三角瓶,将吸附剂过滤后,使用ICP(电感耦合等离子体发射光谱仪)测溶液中残留重金属浓度。
1.6 脱附和再生
吸附过后,将吸附剂分离,使用20 mL 0.05 mol/L盐酸溶液洗脱1 h,超纯水洗脱数次后用于再一次的吸附,测量吸附-脱附的溶液金属浓度变化。计算每次脱附后再吸附时吸附剂的吸附容量。
1.7 数据处理
γ-PGA水凝胶对重金属吸附效果可以用吸附容量来表示。其计算公式为
(1)
式中:Qe为吸附达到平衡时γ-PGA-GDE吸附重金属离子量,mg/g;C0为吸附前水溶液中金属离子的浓度,mg/L;V0为吸附前溶液体积,mL;Ce为吸附平衡时溶液中金属离子的浓度,mg/L;Ve为吸附平衡时溶液的体积,mL;m为吸附剂的干质量,g。
2 结果与分析
2.1 材料表征


2.1.2 扫描电镜分析γ-PGA-GDE扫描电镜如图2所示,γ-PGA-GDE中含有极性基团并且有一定交联度。在γ-PGA 和乙二醇二缩水甘油醚以及其聚合物反应后, 高分子链相互缠绕在一起,彼此交联成网状结构。这极大地增加了γ-PGA-GDE的比表面积,即增大了吸附剂与重金属的接触面积,有利于对重金属的吸附。

2.2 pH值对吸附的影响
pH值是影响吸附剂吸附性能的重要因素,因为它不仅影响吸附剂表面的电荷,而且还影响被吸附物的电离程度和形态。不同金属离子在不同的pH值下会以不同的形式存在于溶液中,为了防止金属离子形成沉淀[13],影响吸附效果,对不同的金属选择不同的试验范围(Cd2+:2~7,Pb2+:2~6)进行研究。水凝胶对不同pH值的Cd2+和Pb2+的吸附结果如图3所示,Cd2+和Pb2+在pH值为5时有最大吸附容量,分别是255.3、525.1 mg/g;当pH值<5时,随着pH值的升高,γ-PGA-GDE 对重金属的吸附容量逐渐增加;在 pH值>5时,γ-PGA-GDE对金属离子的吸附容量开始减小。
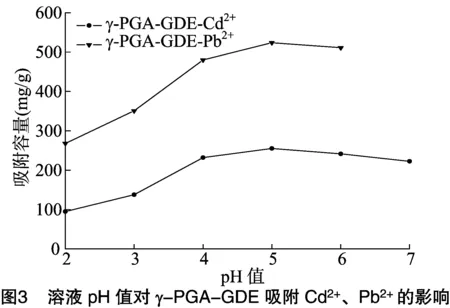
在溶液pH值较低时,γ-PGA-GDE对重金属的吸附容量较低,这是因为在低pH值情况下,溶液中存在大量的H+,γ-PGA-GDE吸附剂的表面活性位点被质子化[14],H+与金属离子竞争吸附位点。因此,金属离子难以被吸附,而在偏中性或者中性条件下,会有更多带有负电荷的吸附位点出现,带有正电荷的金属离子可以被充分吸附。而在高pH值的条件下,金属离子将形成氢氧化物沉淀,同时金属离子将处于OH-包围中,不利于和吸附剂反应,影响吸附效果。
2.3 温度对吸附的影响
温度也是影响吸附过程的一个重要因素,研究温度对γ-PGA-GDE吸附效果的影响,确定γ-PGA-GDE对重金属离子的吸附是放热还是吸热反应,对γ-PGA-GDE的实际应用有着重要意义。
从图4可以看出,对于Cd2+和Pb2+来说,在15~45 ℃ 的范围内,随着温度的升高,γ-PGA-GDE对其吸附量基本不变,分别稳定在255 mg/g 、525 mg/g左右。
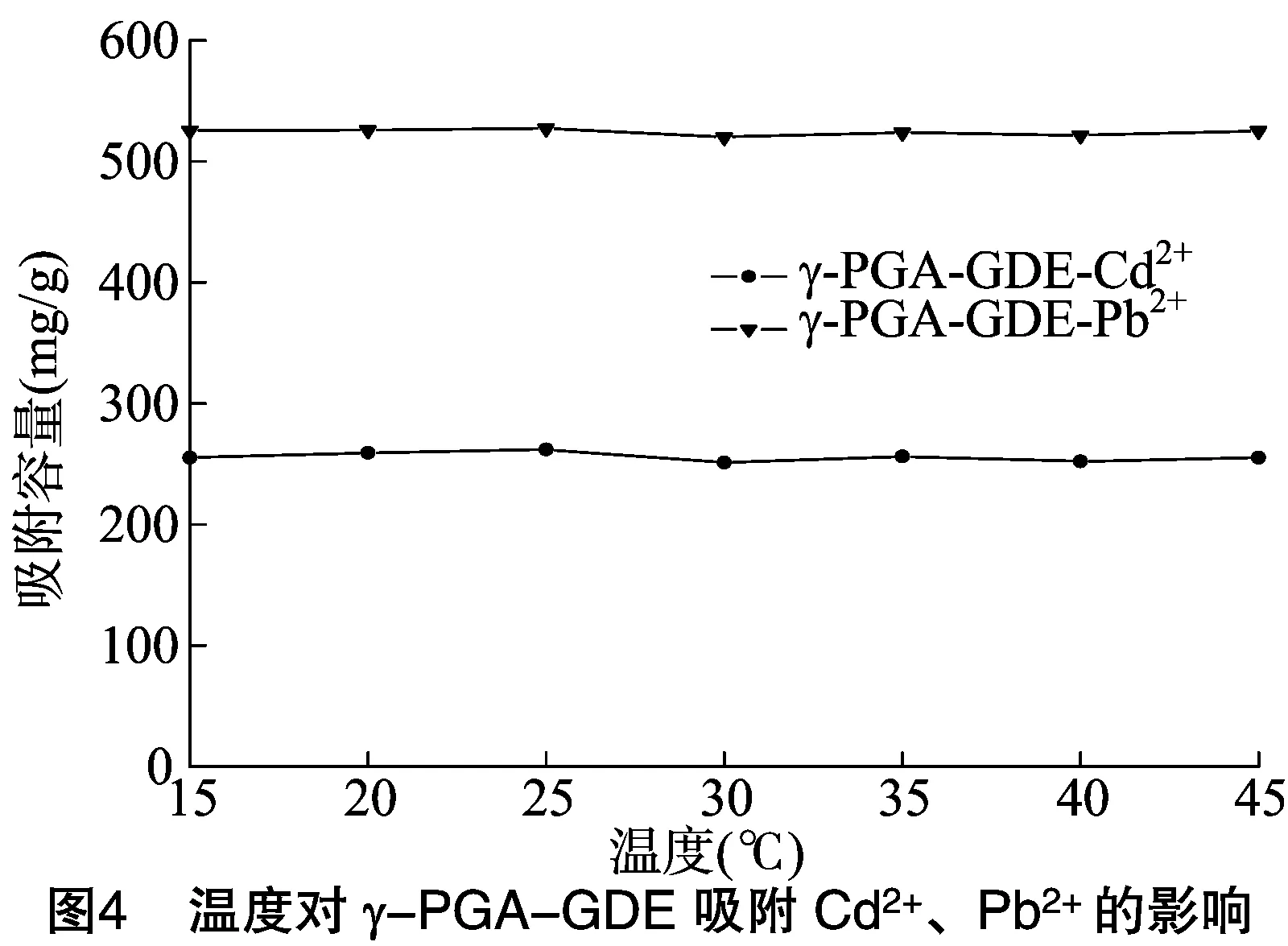
总体来说,温度对γ-PGA-GDE吸附重金属离子的能力影响不大,因此对其吸附行为的探索可以在常温下进行。
2.4 吸附动力学
在25 ℃条件下,吸附容量随吸附时间的变化如图5所示,从图中可以看出,γ-PGA-GDE对重金属的吸附速率非常快,能很快达到吸附平衡。γ-PGA-GDE对Cd2+和Pb2+的吸附在25 min能达到吸附平衡,分别稳定在 255、525 mg/g 左右。
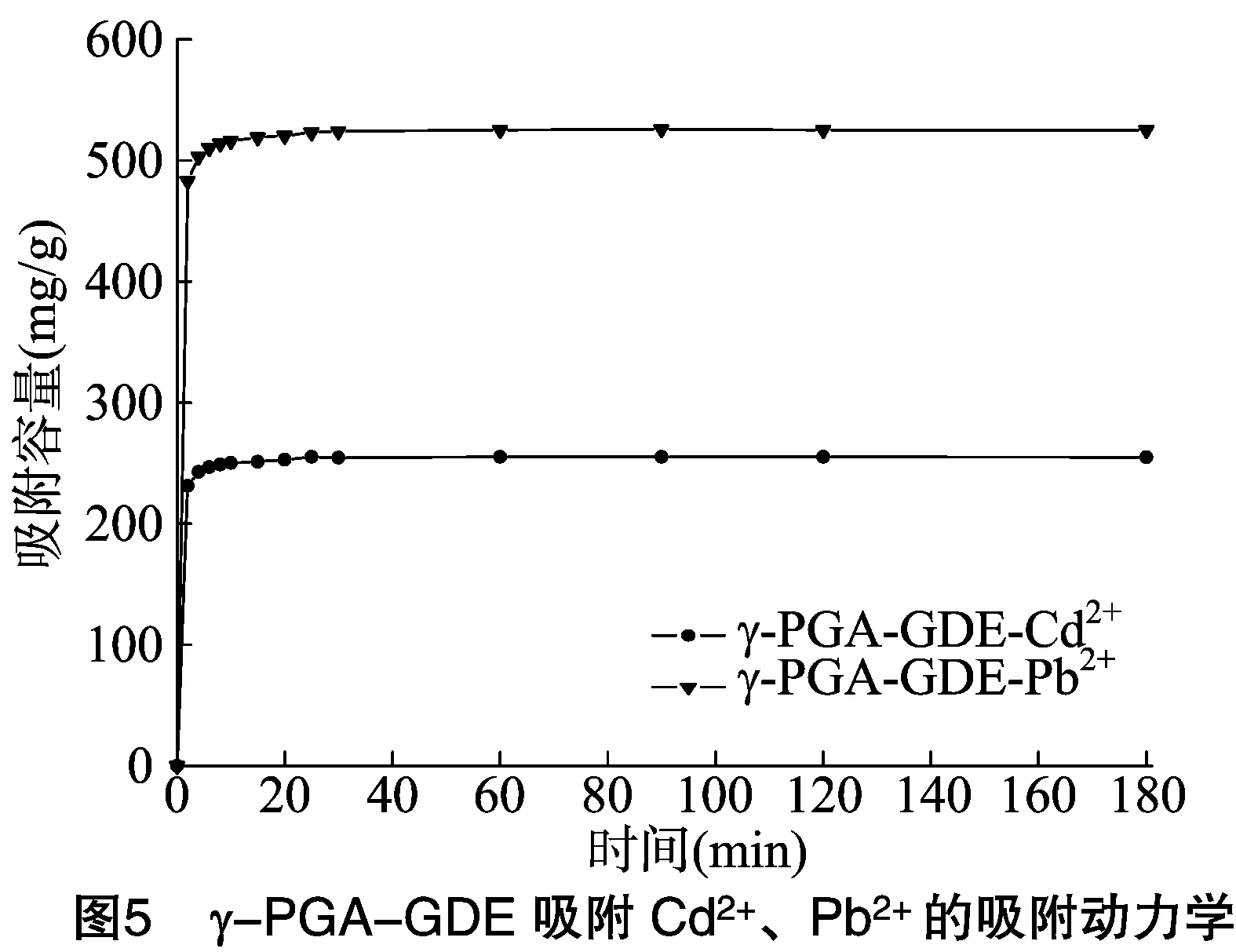
吸附动力学模型不仅可以估计吸附效率,还可以从动力学的深层次来表达反应进行的可能原理。对Cd2+和Pb2+的吸附动力学结果进行准一级动力学和准二级动力学方程拟合。准一级动力学、准二级动力学方程表达式分别为
(2)
(3)
式中:Qe、Qt分别为吸附平衡时和t时的吸附量,mg/g;K1为准一级吸附速率常数,min;K2为准二级吸附速率常数,g/(mg·min);t为吸附时间,min。
从表1可以看出,γ-PGA-GDE吸附重金属离子的准二级动力学的相关系数为Cd2+(0.999)、Pb2+(0.999),均大于准一级动力学的相关系数,而且计算值均与试验值更接近。因此,可推测水凝胶对这2种金属的吸附动力学过程均为准二级动力学吸附,吸附速率被化学吸附所控制。
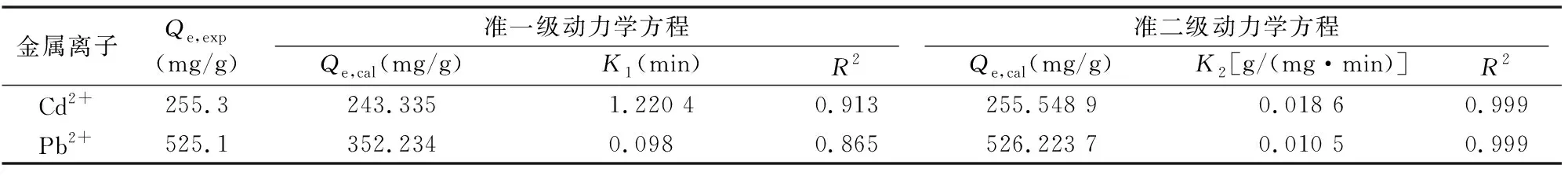
表1 γ-PGA-GDE吸附Cd2+、Pb2+的动力学参数拟合
注:exp表示试验值,cal表示计算值。
2.5 等温吸附
图6是25 ℃条件下γ-PGA-GDE对Cd2+、Pb2+的等温吸附线。它表示在一定的温度下,当达到吸附平衡时,溶液中重金属残留浓度与平衡吸附量之间的关系。从图6可以看出,在低初始浓度范围内,水凝胶对2种重金属离子的吸附量随着初始浓度的增加而迅速增大;当初始浓度逐渐增大到较高值时,吸附量的变化趋于平缓,分别稳定在255、525 mg/g 左右。

利用Langmuir模型、Freundlich模型对上述试验数据进行处理。
Langmuir模型线性简化式为
(4)
Freundlich模型线性简化式为
(5)
式中:Ce是金属溶液平衡时残留浓度,mg/L;Qm是吸附剂理论最大吸附量,mg/g;KL是Langmuir吸附平衡常数,L/mg;n为水凝胶与重金属亲和力,Kf为吸附剂的吸附能力,mg/g。
从表2比较Langmuir模型、Freundlich模型的参数可以发现,Langmuir模型的拟合度更好,更能描述γ-PGA-GDE对重金属的吸附过程。说明γ-PGA-GDE的吸附过程属于单分子层吸附,这可能是水凝胶中—COO—基团与二价金属离子发生配位反应所致。这种点对点的结合更符合Langmuir等温吸附理论的假设,即吸附剂表面的吸附位点均匀分布且具有相同的亲和力,吸附剂与吸附质间形成单分子层吸附。而Freundlich方程仅是一个经验方程,其本身并没有实际的物理意义。
2.6 再生试验
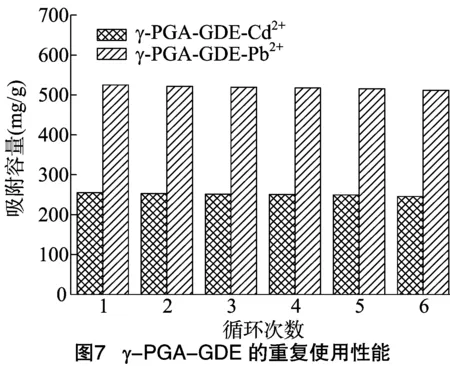
试验研究了已经吸附重金属的γ-PGA-GDE的再生方法,将已吸附Cd2+、Pb2+的γ-PGA-GDE用0.05 mol/L HCl解吸1 h,并用得到的样品进行再吸附试验,结果如图7所示。从图7可以看出,再生后的γ-PGA-GDE进行吸附试验,吸附能力降低很少,6个循环之后,对Cd2+、Pb2+的吸附容量仍能达到245.6、511.3 mg/g。γ-PGA-GDE吸附剂的吸附性能仍能保持90%以上,即γ-PGA-GDE吸附剂至少可以循环使用6次。

表2 γ-PGA-GDE吸附Cd2+、Pb2+的等温方程拟合参数
3 结论和讨论
γ-PGA-GDE对重金属有较高的吸附容量。试验证明,溶液pH值对吸附效果影响明显,在实际应用过程中,可以控制溶液pH值以提高吸附容量;温度对吸附效果影响不大,其吸附可以在常温下进行。红外光谱分析发现其吸附机理可能是羧基和金属离子形成配位化合物。γ-PGA-GDE对Cd2+、Pb2+的吸附能在25 min内达到吸附平衡,吸附动力学可以用准二级动力学方程很好地描述,Langmuir方程拟合效果优于Freundlich方程。γ-PGA-GDE对Cd2+、Pb2+的饱和吸附量分别为255.3、525.1 mg/g。与其他吸附剂相比,本研究制得的吸附剂对Cd2+、Pb2+具有较好的吸附性能和较高的吸附容量(表3);再生能力强,经6次循环后,吸附性能降低很少;可以作为一种理想的重金属废水处理和回收材料。

表3 不同吸附剂吸附容量对比

