植物分枝发育调控的研究进展
付正莉, 刘 蕊, 王宁宁, 朱克明, 陈 松, 张洁夫, 谭小力
(1.江苏大学生命科学研究院,江苏镇江 212013; 2.江苏省农业科学院经济作物研究所,江苏南京 210014)
植物分枝(branching)是植物普遍存在的生长现象,腋芽形成后进一步生长形成侧枝,侧枝上的腋芽也可以发育成侧枝,进而形成株系。植物分枝受基因、激素、自然环境、营养条件等多种因素的影响,也与作物的产量有关,可通过影响作物的结实量进而影响作物的产量。
腋生分生组织(axillary meristem,简称AM)的形成与腋芽的生长为植物分枝发育的2个阶段。腋生分生组织在叶片的叶腋处生成,进而发育成腋芽,腋芽生长成为侧枝。侧枝具有与主茎相同的能力,如产生叶片、花等组织。由于植物的性质和种类有差异,植物的地上株型和分枝组成也各不相同。观察植株的分枝形态,可以将所有的分枝归为五大类:单轴分枝(monopodial branching)、合轴分枝(sympodial branching)、假二叉分枝(false dichotomous branching)、二叉分枝(dichotomous branching)、分蘖(tiller)。通过对植物分枝发育调控机制的研究,从水稻、拟南芥、番茄、玉米、矮牵牛突变体中得到一系列与分枝相关的基因。由于这些基因影响分枝发育的阶段存在差异,将其归纳为三大类:第一类是参与腋生分生组织形成的基因,如MOC/LS、LAX、BLIND等;第二类是参与腋生分生组织生长的基因,如MAX、RMS、DAD等;第三类是对上述2个方面均有影响的基因,如TB1、SPS/BUS。
本文将从腋生分生组织的形成和生长2个方面着手,阐述参与调节植物分枝发育相关基因的研究进展,以期为植物分枝的分子机制研究提供参考。
1 调控腋生分生组织形成的基因
1.1 Lateral suppressor(简称LAS)与LS基因
LS基因调控腋生分生组织的形成,起初是从番茄突变体中被发现的。番茄LS突变体在营养生殖阶段不能产生腋生分生组织,同时花的发育也会产生缺陷,导致花瓣丧失以致生育率下降[1]。LS基因编码的蛋白属于GRAS家族的VHIID转录因子,且GRAS蛋白仅在植物中被发现,在植物生长发育和信号转导等方面具有重要作用[2]。LS和转录调节剂Goblet分级调控番茄叶基部异位分生组织的形成,异位分生组织形成导致芽数量的增加,增强了生存能力并打开了营养繁殖的途径[3],Gob和Ls以分级方式行使功能,因为Ls转录物积累取决于Gob活性,但反之亦然。拟南芥Lateralsuppressor(简称LAS)基因是LS的同源基因,其在叶原基的近轴边界处的带型结构域中表达,是腋生分生组织形成的关键调节子,该基因突变后植株几乎无分枝[4]。系统发育分析表明,LAS功能和调节在进化上是高度保守的。进一步研究表明,LAS的边界特异性表达是由其开放阅读框下游高度保守的增强子所控制的,并且调节序列在LAS和LS中是功能保守的[5]。
1.2 Monoculm1(简称MOC1)
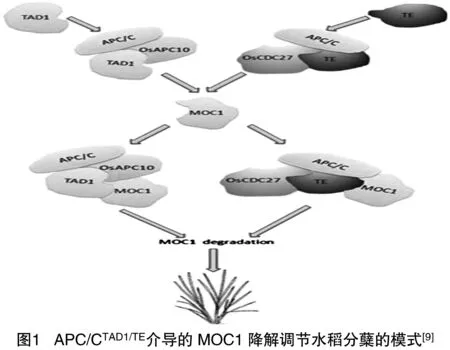
水稻MOC1与来自番茄和拟南芥的LS/LAS属于同源基因,是通过图位克隆方法从少分蘖水稻突变体植株中分离出来的[6]。MOC1定位在核内,编码的蛋白属于GRAS家族蛋白。水稻单秆突变体moc1为1个主茎且无分枝产生,而在野生型植株中过表达MOC1,植株分蘖大量增加,说明MOC1基因作为转录因子对水稻分蘖起到正调控的作用。MOC1基因参与调控水稻AM的起始和分蘖芽的生成,促进分蘖芽的伸长,且在营养生长和生殖生长时期都影响分枝发育。研究者近期报道了2个新型基因TAD1[7]和TE[8],这2个基因被证实作用于MOC1的上游,在叶腋处与MOC1共表达,并通过调控MOC1基因来决定水稻的分枝。TAD1从tad1(tilleringanddwarf1)分蘖矮化突变体中分离出来,该突变体表现为分蘖增多且植株矮化。研究表明,TAD1编码1个后期促进复合物泛素连接酶(APC/C)的共激活因子,APC/CTAd1复合物与OsAPC10结合后作为APC/C的共激活因子作用于MOC1基因,以细胞周期依赖性方式使靶基因MOC1降解。从多分蘖突变体Te(tiller enhancer)中分离出TE基因,TE编码1个水稻同源基因Cdh1,即泛素连接酶APC/C的辅激活因子。APC/CTE复合物与OSCDC27、MOC1相互作用,通过泛素化26S蛋白酶体途径介导MOC1的降解。如图1所示,水稻通过MOC1降解调节分枝,最终影响水稻谷粒产量[9]。
1.3 BLIND(简称BL)/RAX1
Blind番茄突变体表现为腋生分生组织的形成在茎和花序的发育时期受到抑制,进而使分枝数量减少。BLIND基因从番茄突变体blind中被分离出来,通过编码MYB转录因子调节腋生分生组织的起始[10],同时其他侧生分生组织的形成如侧茎、合轴茎等均受到抑制。BLIND基因属于MYB转录因子家族中的R2R3类,该家族参与调节植物次生代谢、细胞周期过程。比较基因组学研究发现,拟南芥分枝调节基因REGULATOROFAXILLARYMERISTEMS1(RAX1)与BLIND同源,属于R2R3MYB基因家族。拟南芥rax1突变体表型与blind相似,即侧生分生组织形成受阻,分枝减少。通过表达研究和互补试验分析表明,BLIND、RAX基因由于启动子分化,已经具有子功能或者新功能化。由功能获得性突变植株得出,基因LS/LAS和BLIND/RAX均通过抑制生长发挥作用[11]。进一步研究发现,LS/LAS和BLIND/RAX功能在参与腋生分生组织AM的形成过程中具有冗余性[10]。同时,RAX1在LAS之前表达,并仅限于腋生分生组织的中心,是最早的腋生分生组织定位基因。
1.4 LAX/BA1
水稻LAX1(LAXPANICLE1)编码转录调节因子,通过定位克隆方法从lax1突变体中分离出来[12]。水稻LAX1(LAXPANICLE1)突变体表现为花序较少、侧生小穗缺失腋生分生组织导致其生长受抑制。进一步研究表明,LAX1在水稻生殖生长时期调节腋生分生组织的起始,在相同的遗传途径中,与SPA(smallpanicle)基因具有冗余性。lax/spa双突变体植株表现为花序无分枝、分蘖数严重减少、腋生分生组织的形成被抑制。LAX1瞬时积聚在第四叶隔期腋生分生组织起始时,并严格调节mRNA的表达和控制随后蛋白质的转运[13]。LAX2基因通过图位克隆的方法从lax2(laxpanicle2)突变体中被分离出来,并且与lax1具有相似的表型,即大多数侧生小穗腋生分生组织缺失、花序减少。LAX2编码1个核定位蛋白且与LAX1相互作用,共同调节水稻腋生分生组织的形成[14]。
玉米中barrenstalk1(简称ba1)基因与玉米LAX基因同源,编码bHLH(basic helix-loop-helix)转录因子。ba1突变体侧生分生组织的形成在营养和生殖生长时期被抑制,表型与lax突变体相似。研究证实,BA1可与BIF2(barren inflorescence 2)发生互作[15],BIF2基因编码1个蛋白激酶,参与调节生长素信号运输过程[16]。BA1直接受到BIF2磷酸化调节,被激活后进而调节下游基因Kn1(knotted1)表达和蛋白分布[17-19],Kn1属于同源异形盒基因,编码1种转录因子,在茎分生组织形成和维持中具有重要作用。如果BA1发生突变,下游基因Kn1无法发挥作用,最终导致AM的形成受阻,植株分枝减少[20-21]。
2 调控腋生分生组织生长相关基因
2.1 MAX/RMS/DAD/D
拟南芥moreaxillarygrowth(简称max)突变体相比于野生型植株分枝增多、株高降低,与豌豆ramosus(简称rms)基因、矮牵牛decreasedapicaldominance(简称dad)基因、水稻dwarf(简称d)基因突变体表型类似,max1、max3、max4在植株根部、茎部抑制分枝。MAX/RMS/DAD/D基因参与独脚金内酯(strigolactones,简称SLs)生物合成和信号转导过程。独脚金内酯是一种调节植物生长发育的新型植物激素,在植物根部产生,沿茎干向上运输,直接或间接抑制植物分枝发育。
拟南芥MAX3与水稻D17、矮牵牛DAD3、豌豆RMS5属于同源基因[22-24],编码类胡萝卜素裂解双加氧酶7(简称CCD7)。MAX3编码1个质体定位蛋白,相比于在根中的表达水平,在茎和穗中的表达水平较高,同时还受到生长素的调节,且调节植物侧枝发育具有保守性。MAX4编码类胡萝卜素裂解双加氧酶8(简称CCD8),与水稻D10、矮牵牛DAD1、豌豆RMS1同源[25-26]。MAX4/D10/DAD1/RMS1定位在质体上,在植株中表达量低,也受生长素诱导[26]。MAX4参与SL的合成过程,并在CCD7的下游发挥作用[27]。MAX1/OsMAX1[28-29]编码细胞色素蛋白P450,可抑制侧枝的发育[30]。研究表明,MAX1/OsMAX1在MAX3/D17/RMS5/DAD3、MAX4/D10/RMS1/DAD1下游发挥作用,通过以CCD7和CCD8的反应产物或其他代谢物为底物,合成SLs复合物[31]。拟南芥MAX2与水稻D3[32]、豌豆RMS4属于同源基因,MAX2编码1种F-box蛋白。max突变体相比于野生型植株初级分枝数较少,腋芽分生组织生长受抑制。MAX2/D3/RMS4位于MAX1/OsMAX1、MAX3/D17/RMS5/DAD3、MAX4/D10/RMS1/DAD1M基因下游,在抑制分枝的过程中不可或缺。近期报道表明,水稻D53[33-34]、D27[35]、D14/D88/HTD2/AtD14/DAD2等基因也通过参与SL信号途径调节植物的分枝发育。将上述基因按参与独脚金内酯途径功能不同归类,即MAX3/D17/RMS5/DAD3、MAX4/D10/RMS1/DAD1、OsMAX1s/MAX1参与调控SL的合成;MAX2/D3/RMS4及D53、D14/D88/HTD2/AtD14/DAD2、MAX2/D3/RMS4调控SL的信号转导。
2.2 WUS/OsWUS
拟南芥WUS(wuschel)基因属于WOX家族,与水稻OsWUS、MOC3基因及玉米Zm-WUS1、ZmWUS2基因同源[36-37]。WUS在茎端分生组织中表达,诱导细胞增殖。WUS功能获得性突变体植株表现为下胚轴细长,相反,WUS功能缺失性突变体下胚轴的伸长被抑制。研究表明,WUS基因在下胚轴异位表达时通过其靶基因GLUTAMINE-RICHPROTEIN23(GRP23)促进细胞分裂[38]。水稻OsWUS、MOC3基因与拟南芥WUS同源[37],OsWUS在调控水稻分蘖时其同源异形域起到关键作用[39]。水稻单秆基因MONOCULM3(MOC3)[40]是最近通过图位克隆方法被分离出来的,在moc3中,分蘖芽的起始受到阻断,植株几乎没有分蘖。MOC3定位在核内,编码1个核定位转录因子,MOC3发生点突变,导致OsWUS的表达提前终止。研究表明,MOC3调控腋芽的形成受到细胞分裂素的诱导。MOC3功能缺失时,会影响细胞分裂素响应调节因子OsRRs、ORR的表达,且可与TPR(topless-related protein)蛋白发生互作,TPL/TPR是一类在植物中广泛存在的转录共抑制子(co-repressor),在激素信号转导途径中起到基因转录抑制作用。而独脚金内酯途径中D53蛋白与TPL/TPR蛋白形成转录抑制复合体,协同抑制SL信号下游靶基因的表达[33],提示MOC3可能通过与TPR互作参与SL途径,从而影响SL信号途径下游基因的响应。
3 调控腋生分生组织形成和生长的基因
3.1 TB1/OsTB1
TB1(teosintebranched1)基因编码1个含TCP[TCP为最先发现的3个该家族的蛋白名称的首字母缩写,分别是玉米中的TEOSINTE BRANCHED1(TB1)、金鱼草中的CYCLOIDEA(CYC)和水稻中的PROLIFERATING CELL FACTORS(PCF)]。结构域的转录调控因子,属于TCP蛋白家族一员。TCP结构域由1个螺旋-环-螺旋构型和DNA结合的基序组成[41]。玉米TB1基因可抑制侧枝发育和雄花的形成,随着植株生长,其表达量逐渐减少,即两者呈负相关。玉米TB1的同源基因水稻OsTB1基因通过图位克隆被分离得到。水稻中OsTB1作为分枝的负调控基因,明显受到MOC1调节。从Ostb1转基因水稻的表型来看,分蘖和圆锥花序的数量在过表达OsTB1水稻中减少,而在RNAi干扰OsTB1水稻中增多,进一步表明OsTB1对水稻分枝起负调控作用[42-44]。近期有报道表明,OsTB1调控OsIAA6的表达,Osiaa6干扰突变体表现出非正常分蘖生长,OsIAA是水稻Aux/IAA的同源基因,在茎基部的叶腋分生组织中特异表达,同时受到生长素转运蛋白OsPIN1的调控作用。生长素转运蛋白PIN介导生长素运输,其中OSPIN1、OSPIN2和OsPIN3t/3a/10a、OsPIN5b参与生长素运输和分布[45-48]。试验结果表明,OsTB1调控生长素相关基因表达,进而调节生长素水平,维持植物激素平衡,参与到水稻分蘖生长调节的过程中[49]。
FC1(FINECULM1)[50]从多分蘖水稻细秆突变体fc1中被分离出来,编码转录因子且与TB1基因同源,序列分析显示,fc1的OsTb1开放阅读框的第327位碱基(C碱基)缺失导致移码突变,产生终止密码子,引起了随后的转录和翻译终止。用独脚金内酯类似物GR24处理fc1植株时,植株表型不受影响,说明FC1是SL抑制腋芽生长所必需的,在d3突变体中过表达水稻FC1,可以部分恢复d3的表型,提示FC1作用于SL的下游,其表达量受到D53基因的抑制[34]。此外,细胞分裂素和SL可快速地减少和增加腋芽中FC1的表达量,意味着FC1/TB1可能是细胞分裂素和SL途径的共同靶目标[51]。
3.2 Supershoot(简称SPS)与bushy(简称BUS)
sps突变体和bus突变体均在拟南芥中被发现,表现为分枝和花序浓密。除此之外,bus突变体还表现出叶片皱缩、维管生长缓慢。在sps突变体中,细胞分裂素和生长素水平提高,SPS/BUS在植株叶腋处表达水平最高,说明SPS/BUS基因在叶腋处通过间接或直接调节植物激素水平进而调控植株腋生分生组织的形成发育[52-53]。SPS/BUS编码的蛋白属于细胞色素P450 CYP79F1亚家族成员,参与生长素的合成过程[52],将CYP79F1失活后,植株顶端优势上升,生长素增多[54-55]。调节植物分枝发育基因的编码蛋白及其功能等信息见表1。
4 讨论
植物分枝基因包含在多个进程中:在蛋白降解途径方面,探究蛋白与已知成分的相互作用在了解独脚金内酯调节植物分枝机制方面也起到了关键作用;在植物激素途径方面,通过改变激素的含量调节生长素、细胞分裂素的平衡等来起作用;有些基因属于转录因子,通过调控其他基因的转录来发挥作用。随着分子生物学和遗传学的快速发展,植物腋生分生组织的形成和腋芽的生长调控机制已被了解。特别是通过筛选突变体而克隆出与植物分枝相关的新基因,然后用转基因技术鉴定出包含在植物分枝过程中的这些基因,可为阐明植物分枝发育机制提供理论依据。人们希望通过对分枝调控网络的了解,找出关键基因并进行改造,进而培育出抗倒伏、高产等具有优良农艺性状的农作物。

表1 调节植物分枝发育的基因
目前,已有超过100种植物品种完成基因组测序工作,部分植株突变体库也已建立,推进了植物分枝机制的研究进程和优良农作物的培育工作。近几年来,科学家从重要的单子叶模式生物水稻中克隆出大量分枝相关基因,并将其与拟南芥比较,得到同源基因。通过对水稻突变体的研究,发现新的基因和新的分枝发育调节途径,有助于对植物分枝发育机制的进一步研究。
通过科学家的不断努力,植物分枝发育分子机制及信号通路中基因间的关系逐渐清晰。但植物分枝发生过程受到多途径调控,包括基因、遗传、激素、环境等相互作用的调节均可影响植株分枝的正常发育。因此,人们在植物分枝发育机制的研究中还需要付出很多努力。

