胃异位胰腺1例并文献复习
贺红艳,孙菁,韩辉,田万管*,黄先勇,孟庆义*
(解放军总医院:1健康管理研究院二病区,2急诊科,北京 100853)
1 病例摘要
患者,男性,66岁,干部。因“体检发现胃占位性病变2个月”就诊于解放军总医院健康管理研究院。患者2个月前在当地医院行胃镜检查发现胃体黏膜下隆起病变,位于小弯侧,大小约2.5 cm×2.5 cm,随后行超声内镜(endoscopic ultrasonography,EUS)检查示胃体中部小弯侧病变,呈低回声,位于黏膜下层,考虑胃体占位性病变,性质待定,未予以治疗。患者无恶心、呕吐、反酸、烧心及腹痛等症状。既往体健,否认高血压、冠心病、糖尿病病史。饮酒史15年,每天饮白酒约250 ml,无吸烟史。
入院查体体温:36.0℃,脉搏:72次/min,血压124/77 mmHg(1 mmHg=0.133 kPa),一般状况良好,神志清楚,查体合作。心肺无异常。腹平软,肝脾肋缘下未触及,全腹无压痛及反跳痛,移动性浊音阴性,肠鸣音4 次/min。
诊疗经过完善血常规、肝肾功能、电解质、凝血功能、心电图、胸片检查,结果均未见明显异常。腹部CT平扫+增强未见异常。入院2 d后在镇静麻醉下行胃镜检查示:胃体黏膜光滑,小弯侧有一大小约1.0 cm×1.2 cm半球形黏膜下隆起病变,遂行黏膜下肿瘤切除术,圈套后电凝电切,氩气凝固创面,胃窦黏膜光滑,红白相间,以红为主,分泌物少(图1)。病理结果:胃(体小弯)肌层内见异位胰腺(heterotopic pancreas,HP)组织。给予禁食、积极抑酸、胃黏膜保护剂及补充电解质、其他对症治疗,治疗3 d,患者无不适后痊愈出院。目前随访中,病情平稳。
2 临床病理讨论
贺红艳主治医师本例患者为老年男性,查体发现胃体黏膜下隆起病变,位于小弯侧,大小约2.5 cm×2.5 cm,EUS检查示胃体中部小弯侧病变, 性质待定, 为求进一步诊治就诊于解放军总医院健康研究院。就诊后给予胃镜检查示胃体HP,内镜下切除。病理结果胃体小弯肌层内见HP组织。术后给予积极的内科治疗,病情好转出院。
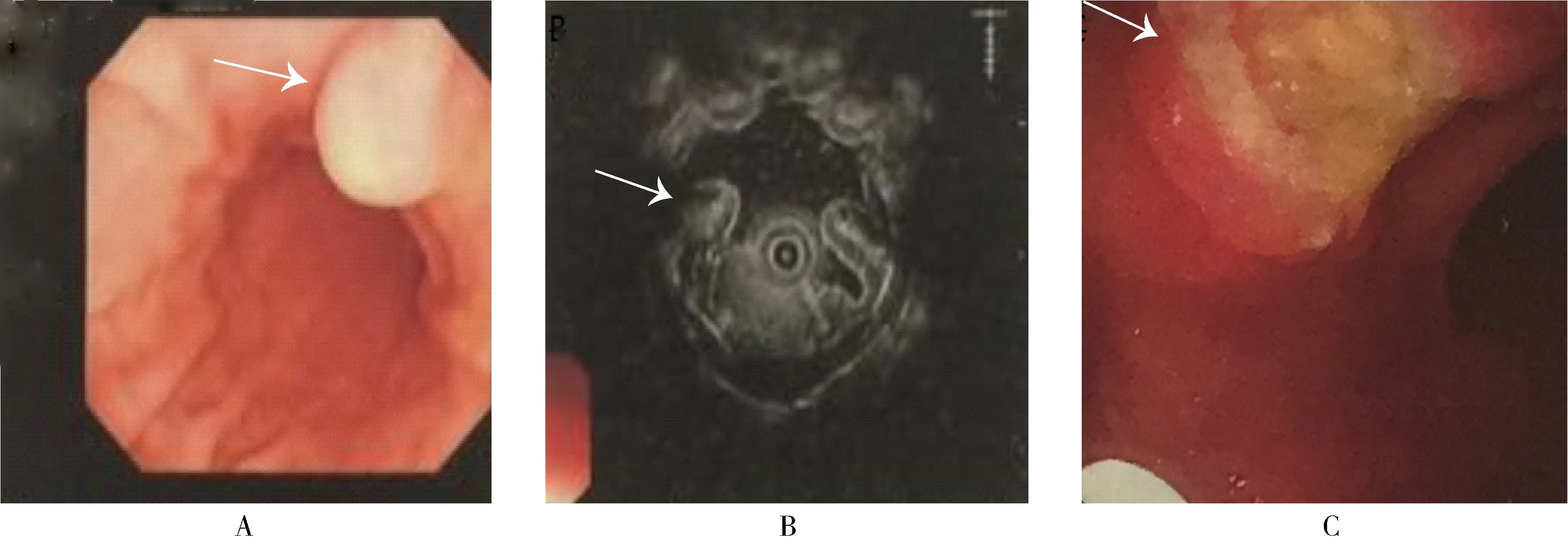
图1 胃异位胰腺内镜检查和治疗
A: esophagogastroduodenoscopy shows a submucosal mass in the distal gastric body along the lesser curvature (arrow); B: under endoscopic ultrasono-graphy, the mass arises from the submucosa(the third layer), and the lamina propria(the fourth layer) is intact; C: successful endoscopic resection and electrocoagulation of the lesion after ringing, and coagulating wound with argon
孙菁主治医师HP是一种发育异常疾病,是指与正常胰腺完全分离的孤立的胰腺组织,与正常胰腺组织间没有组织、神经和血管相连[1,2]。1729年,Jean-Schultz首次报道了本病,Klobb证实了它的组织学结构。HP又称为迷走胰腺、异常胰腺和副胰腺等[3,4]。大多数HP患者都无症状,通常在尸检或手术过程中偶然被发现。尸检结果中HP的发生率为0.6%~13.7%[5,6],在上腹部手术中的发生率为0.2%,胃切除术中的发生率为0.9%[7,8]。
韩辉副主任医师同意前面两位临床医师的分析。关于HP的发病机制尚不清楚,HP可能是从胚胎的胰芽衍生而来。目前主要有两种假说:错位理论和化生理论。错位理论者认为HP来源于前肠转位等运动而使胰腺原基逐渐分离,在邻近的胃、肠壁或肠系膜等处形成。而化生理论者则认为HP是来源于内胚层的胰腺化生,在胚胎发育过程中,内胚层会迁徙到黏膜下层[9]。
HP 可发生于任何年龄段,但50~69岁最常见,男性发病率高于女性[6,10]。最常见的部位是胃(25%~38%)、十二指肠(17%~21%)、以及近端空肠(15%~21%)[11],也可见于回肠、Meckel 憩室、肠系膜、食管、胆道、脾脏等,极少数可见于肺、纵隔、肾上腺、阑尾、腹壁、大网膜、输卵管和精索等[12]。胃肠道HP最常位于黏膜下层(54%),而黏膜下层和固有肌层均累及(23%)较少,仅发生于固有肌层为8%,浆膜下11%,全层4%[3]。
田万管副主任医师HP分为4型:含胰腺导管、腺泡和胰岛为Ⅰ型;仅含胰腺导管和腺泡为Ⅱ型;仅含胰腺导管为Ⅲ型;仅有胰岛为Ⅳ型[1,12]。Ⅰ型具有胰腺腺泡、导管和胰岛以及独立血供和导管系统,并且有正常的外分泌和内分泌功能[1]。因此,虽然一般情况下无症状,但是患者易患正常胰腺的各种疾病,包括急性或慢性胰腺炎、囊肿和恶变[7,13,14]。HP由于其大小、位置和组织学类型不同,临床表现也不同。本病例无任何临床症状,胃镜检查发现胃体部黏膜下隆起病变。
胃HP多位于胃窦的后壁和前壁,占85%~95%,多分布于大弯侧[15]。大多数HP患者都无症状,偶然情况下被发现[3]。但有时也会出现一些非特异性症状,这些症状与位置、大小、黏膜受累情况及发生的胰腺疾病有关。据报道直径为1.5~2.0 cm会出现临床症状[16]。常见症状是腹痛,与消化酶分泌引起的组织损伤、炎症或化学刺激有关。较少见的症状包括恶心、呕吐、出血、梗阻性黄疸、溃疡、肠梗阻和肿瘤性病变[6,17]。
黄先勇主任医师前面各位医师对本病进行了剖析,使我们对本病有了更进一步认识。HP的鉴别诊断主要包括胃肠道间质肿瘤(gastrointestinal stromal tumors,GIST)、胃肠道自主神经肿瘤、胃良性肿瘤、淋巴瘤或胃癌,通过影像学检查或内镜检查难以区分[12,18]。增强CT扫描有助于诊断,可为外科手术提供依据[18],如病灶主要位于胃窦部、表面黏膜明显强化、长短径比值>1.4以及向腔内生长。HP强化的方式和程度反映病变的组织类型。以腺泡组织为主的病变与其他类型相比,强化更均匀和更明显[18]。表面黏膜明显强化与HP引起的炎症反复作用有关。胃镜检查HP表现为管腔内黏膜下隆起性病变,常常诊断为GIST[19]。EUS检查HP特征表现为病灶呈低回声,广基,不均质,中央凹陷有脐,固定,略不规则,边界不清[12],而胃GIST主要表现为低回声、均质、边界清楚。但有时也会出现溃疡和不规则的边缘。HP可累及黏膜下层(73%)、肌层(17%)、浆膜下层(10%),或三者均累及[20]。绝大多数情况下,浅表活组织检查没有诊断价值[21]。据报道,EUS对HP的诊断有帮助;EUS引导下细针穿刺活检对确诊HP尤其有效,文献报道其敏感度为80%~100%[22,23]。尽管诊断方法取得了进展,但是HP与黏膜下肿瘤如GIST的鉴别诊断对临床医师来说仍是难题。
孟庆义主任医师胃HP的治疗应根据有无并发症或大小和浸润深度决定。无症状患者可长期观察,不需进一步干预[16,24]。但也有学者建议切除HP可预防急性胰腺炎和慢性胰腺炎及恶变的发生[15]。HP既往的治疗多为外科手术,手术方式视病变位置、大小、程度而定,因为手术本身既有诊断价值,又可避免可能的并发症,但手术创伤较大,随着消化内镜技术的发展,EUS能较准确地判断消化道黏膜下隆起的来源,大部分通过内镜下治疗,如黏膜下切除术、黏膜下剥离术及内镜隧道技术。
综上所述,胃HP需与其他黏膜下病变如GIST相鉴别,术前给予确定性诊断极重要,这样可避免外科干预。由于HP不常见,在鉴别胃黏膜外肿块时应考虑。

