局部脑缺血再灌注损伤对小鼠TMEM166基因和神经细胞自噬的影响
王 瑜,王天龙,赵 磊,李 丽
(首都医科大学宣武医院麻醉科,北京 100053)
TMEM166(transmembrane protein 166,也称为FLJ13391)基因定位于人2号染色体短臂12区(2p12),其进化较保守,是目前通过高通量功能筛选出的一个明显下调内参活性同时诱导细胞死亡的新基因。研究发现,过表达TMEM166可以抑制HeLa细胞的克隆形成能力,最终引起HeLa细胞的自噬性死亡[1]。TMEM166基因相对分子量约17 450,表达产物由152个氨基酸组成,在人体多种组织广泛表达,与细胞自噬密切相关[2]。LC3-II是自噬体的标志分子,是由LC3前体在蛋白水解酶的作用下剪切C末端形成的LC3-I经泛素样加工与磷脂酰乙醇胺(PE)结合而形成,能靶向定位于自噬体膜,参与自噬的形成[3]。本研究拟在脑缺血再灌注损伤模型上观察TMEM166的表达变化,探讨其与脑缺血损伤后神经细胞自噬之间的关系。
1 材料和方法
1.1 实验动物
SPF级9 ~ 10周龄C57/BL6J雄性小鼠50只,体重22 ~ 28 g,由首都医科大学实验动物科学部提供[SCXK (京) 2016-0006]。动物饲养于屏障系统饲养设备,温度20℃ ~ 26℃,湿度40% ~ 70%,光照12 h亮12 h暗[SYXK (京) 2016-0010]。
1.2 主要试剂与仪器
戊巴比妥钠购自广州莱绿宠商贸有限公司;小鼠抗TMEM166抗体(sc-162329)、兔抗LC3-II抗体(sc-400714)购自美国Santa Cruz公司;ABC过氧化物酶试剂盒,抗小鼠、抗兔ABC过氧化物酶试剂盒购自上海鲁汶生物科技有限公司;DAB显色试剂盒购自武汉博士德生物工程有限公司;Western blot相关试剂购自美国Bio-Rad公司。Olympus BX51光学显微镜购自奥林巴斯(中国)有限公司;X胶片、Gel Doc XR+凝胶成像系统购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 动物分组与模型建立
C57/BL6J雄性小鼠50只随机分为缺血90 min再灌6,12,24及48 h组,每组12只。动物用戊巴比妥钠(40 mg/kg)腹腔注射麻醉,仰卧位固定后做颈部正中切口,保持头后仰,呼吸道通畅,钝性分离右侧颈总动脉及其上行颈外动脉、颈内动脉及翼腭动脉分支。动脉夹暂时夹闭颈总动脉,缝线结扎翼腭动脉,并分别于颈外动脉近心端、远心端底部留置缝线,将其远心端打结系紧,近心端系一个松结备用,随后在颈外动脉的两缝线间用血管剪一个小口,将一5.0自制硅胶线栓送入颈内动脉,深度约10 mm,之后将近心端丝线拉紧以防血液反流渗出,用湿润的纱布覆盖手术切口,并注意保暖,密切观察其变化。栓塞1.5 h后拔除线栓,依次缝合切口。术中监测体温、血压、呼吸等各项生命体征,用电热毯保持体温在(37±0.5)℃左右,手术结束动物苏醒后出现左侧前肢偏瘫的实验动物进入下一步实验。实验过程中按实验动物使用的3R原则给予人道主义关怀。
1.3.2 神经功能评分
采用Garcia神经功能评分标准[4]用双盲法于再灌注后各时间点对实验动物进行评分,最低评分3分,最高评分18分,得分越低提示神经功能损伤越严重。
1.3.3 免疫组化染色
各组动物按再灌注时间深麻醉后迅速剪开胸骨暴露心脏,20 mL注射器针头小心刺入左心室,并剪开右心耳,于左心室快速灌注预冷的生理盐直至从右心耳流出的血液颜色变浅,随后再以冷的4%多聚甲醛先快后慢灌注,待充分固定后取全脑放入30%蔗糖,4℃冰箱保存至沉底。OTC包埋后做连续冠状冰冻切片,切片厚10 μm,风干后4℃保存。盐酸抗原修复30 min,充分浸洗;3%双氧水消除内源性过氧化物酶活性10 min(避光),洗涤后置于牛血清封闭30 min,吸除血清后添加一抗孵育液4℃过夜,阴性对照组用PBS替代,抗体稀释浓度分别为:小鼠抗TMEM166 1∶200,兔抗LC3-II 1∶500。充分浸洗后按照ABC过氧化物酶试剂盒,抗小鼠、抗兔ABC过氧化物酶试剂盒的说明书进行二抗、三抗的孵育,最后DAB显色并封片。Olympus BX51显微镜20×下观察缺血侧大脑皮层及基底核区,光镜下棕染有细胞形态的为阳性细胞。
1.3.4 Western blot分析
留取各时间点小鼠缺血侧大脑皮层及基底核区的新鲜样本,根据蛋白浓度测定结果,取相同总量蛋白,沸水浴变性10 min。配分离胶(8%/10%/12%,根据分子量大小不同选择不同浓度的胶),及4%的浓缩胶,待其聚合后上样,每个泳道50 μg,设置电压45 V开始电泳,当溴酚蓝过上层胶后升高电压至100 V,根据分子量大小适时停止电泳启动电泳。电泳完毕后,关闭电源,取出凝胶,放入电转液中漂洗,按顺序正确安装电转槽,倒入预冷的电转液,电转结束后,取下硝酸纤维素膜,置入5%脱脂奶粉封闭液室温2 h。1× TBST漂洗后加入一抗4℃过夜,抗体稀释浓度分别为:小鼠抗TMEM166 1∶1000,兔抗LC3-II 1∶800。复温30 min,缓冲液冲洗3遍加入二抗,室温孵育1 h。按比例配制发光液,室温下避光孵育5 min。暗室下曝光显影。X胶片曝光后经凝胶成像系统分析数据。
1.4 统计学方法
2 结果
2.1 模型的选择
选取手术结束动物苏醒后出现左侧前肢偏瘫评分为6 ~ 11分的实验动物进入下一步实验,实验中有1只动物因损伤太重死亡,1只因评分太高均被排除。

表1 再灌注后不同时间点的神经功能评分Table 1 Neurological scores at different time points after reperfusion
2.2 免疫组化染色
TMEM166及LC3-II的棕黄色阳性细胞在再灌注6 h时已经有表达[(60±2),(60±2)],阳性细胞的数目在12 h时进一步增加[(84±2),(86±2)],24 h达到高峰[(123±2),(122±2),P< 0.05],48 h后开始下降[(87±2),(85±2)],见图1、图2。
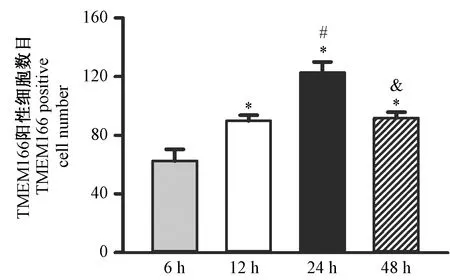
注:与6 h比较,*P < 0.05;与12 h比较,#P < 0.05;与24 h比较,& P < 0.05。图1 再灌注后TMEM166在不同时间点的阳性细胞数目Note. Compared to 6 h, * P < 0.05. Compared to 12 h,#P < 0.05. Compared to 24 h, & P < 0.05.Figure 1 TMEM166 positive cell number at different time points after reperfusion

注:与6 h比较,*P < 0.05;与12 h比较,#P < 0.05;与24 h比较,& P < 0.05。图2 再灌注后LC3-II在不同时间点的阳性细胞数目Note. Compared to 6 h, * P < 0.05. Compared to 12 h,#P < 0.05. Compared to 24 h,& P < 0.05.Figure 2 LC3-II positive cell number at different time points after reperfusion
2.3 Western blot结果
TMEM166及LC3-II在再灌注6 h时已经表达,在12 h时表达明显增强,二者均在24 h达到高峰,强度约为6 h的3倍(P< 0.05),48 h后开始下降,与12 h之间相比差异无显著性,但与6 h相比差异有显著性(图3、图4)。

注:与6 h比较,*P < 0.05;与12 h比较,#P < 0.05;与24 h比较,& P < 0.05。图3 再灌注后TMEM166在不同时间点的表达水平Note. Compared to 6 h,*P < 0.05. Compared to 12 h,#P < 0.05. Compared to 24 h,& P < 0.05.Figure 3 Relative expression level of TMEM166 protein at different time points after reperfusion

注:与6 h比较,*P < 0.05;与12 h比较,#P < 0.05;与24 h比较,& P < 0.05。图4 再灌注后LC3-II在不同时间点的表达水平Note. Compared to 6 h,*P < 0.05. Compared to 12 h,#P < 0.05. Compared to 24 h,& P < 0.05.Figure 4 Relative expression level of LC3-II protein at different time points after reperfusion
3 讨论
缺血致神经细胞死亡的机理尚未十分明确,目前的研究表明脑缺血后神经细胞可以呈现三种死亡方式:坏死(necrosis)、凋亡(apoptosis)和自噬(autophagy)[5]。近年来,有关细胞死亡可能机制的研究引起了学者们极大的关注,细胞坏死和凋亡已被众多学者进行了深入细致的研究[4, 6-9],然而对自噬的研究和认识却略显欠缺。坏死主要发生在缺血中心区,为病理性细胞死亡,是快速且不可逆的细胞死亡。而细胞凋亡主要发生在半影区,进展较慢。然而,有相当一部分的神经元死亡并不表现出典型的细胞坏死或凋亡的特征,并具有截然不同的细胞死亡机制,称为自噬性细胞死亡或Ⅱ型程序性细胞死亡(autophagic cell death)[10-11]。自噬是迄今为止发现的广泛存在于真核细胞中的一种代谢途径,可通过自噬小体-溶酶体途径,或通过影响凋亡和坏死的发生、发展对细胞死亡进行调控,LC3-II是其特征性标记物,研究发现LC3-II的活性与细胞自噬水平呈正相关[12]。目前,自噬在急性脑缺血后神经元损伤过程中的作用及其机制尚不明确。
TMEM166是人们最新发现的和细胞生存密切相关的基因之一,又称FLJ13391,TMEM166蛋白为溶酶体/内质网相关蛋白,但目前国内外对TMEM166的报道主要集中在肿瘤领域[13- 14],其在脑缺血后神经细胞凋亡过程中的作用研究尚不多见。
最新的研究发现,Hela细胞转染TMEM166质粒后,表现出了凋亡和自噬的典型特征,而应用小干扰RNA下调TMEM166的表达,则可以抑制饥饿诱导的Hela细胞自噬[1]。该研究团队还发现,Hela细胞在转染后期同时也表现出了细胞凋亡的典型特征,说明TMEM166可以同时诱导Hela细胞的自噬和凋亡。此外,TMEM166可以明显抑制人非小细胞肺癌肿瘤细胞的发生[15]。Chang等[13]用腺病毒Ad5-TMEM166转染人类肿瘤细胞后发现,mTOR(哺乳动物雷帕霉素靶蛋白,自噬负性调节蛋白)及其下游p70s6k的磷酸化水平明显下调,肿瘤细胞自噬水平升高,提示TMEM166可能是通过调节mTOR的活性来调节细胞自噬。该研究团队进一步发现TMEM166有显著的抗胶质母细胞瘤生物活性的作用,分别在三种胶质母细胞瘤(U251、U87和SHG44)中过表达TMEM166后,胶质母细胞瘤的自噬活性增加,增殖呈剂量及时间依赖性被抑制,且mTOR/RPS6KB1信号通路被抑制。除此之外,TMEM166在胰腺炎患者的胰岛α细胞中有强表达,在胰腺腺泡细胞癌的细胞膜及胞浆中也有不同程度的表达,令人感兴趣的是TMEM166的表达在其它类型的胰腺癌,如胰腺导管癌、导管内乳头状黏液性肿瘤、粘液性囊腺瘤、实性乳头状瘤和胰腺神经内分泌肿瘤中却没有检测到[2],这可能提示TMEM166作用的组织特异性。除了肿瘤细胞外,在角膜内皮营养不良的小鼠动物模型中,锂可以通过上调TMEM166的表达进而通过诱导角膜细胞自噬而起到视力保护作用[2]。TMEM166与神经干细胞的再生与分化也关系密切,研究发现TMEM166通过调节自噬参与调控胚胎神经系统的发生发育[14]。TMEM166在心肌重塑中也有重要作用,TMEM166敲除鼠的心肌细胞自噬活性被抑制,心肌出现纤维化、心室肥厚,最终发展成各种心肌病甚至导致死亡[17]。
本研究旨在探讨TMEM166在小鼠脑缺血再灌注后脑组织中的表达,结果证实TMEM166在缺血再灌注损伤6 h后即有明显表达,其阳性细胞的数目及表达强度均随着再灌注时间的延长而增加,在再灌注后24 h达到高峰,其强度约为再灌注6 h时的3倍左右。而这一过程与自噬特异性标记物LC3-II的表达趋势基本吻合。LC3-II的表达在缺血后6 h开始,12 h继续升高,同样在24 h达到高峰,48 h回落。这说明TMEM166与脑缺血后神经细胞的自噬之间可能存在某种关联,这一发现与本课题组之前发表的在大鼠模型中的研究结果类似,TMEM166在大鼠脑组织有表达,脑缺血再灌注损伤后表达明显上调,在再灌注24 h达到高峰,此时动物神经功能的损害也最为显著[18]。
综上所述,TMEM166可能与脑缺血再灌注损伤后的神经细胞自噬密切相关,其机制有待进一步研究。在这一成果基础上,本课题组已经制备TMEM166基因敲除鼠,将对其诱导神经细胞凋亡的具体机制进行深入研究。

