黄瓜与西芹间作土壤细菌多样性及其对黄瓜枯萎病发生的影响*
秦立金, 徐 峰, 刘永胜, 王学敏, 李 全, 云兴福**
黄瓜与西芹间作土壤细菌多样性及其对黄瓜枯萎病发生的影响*
秦立金1,2, 徐 峰3, 刘永胜4, 王学敏5, 李 全1, 云兴福1**
(1. 内蒙古农业大学农学院 呼和浩特 010018; 2. 赤峰学院生命科学学院 赤峰 024000; 3. 赤峰市敖汉旗农业技术服务中心 赤峰 024000; 4. 陕西省渭南市潼关县农业局园艺站 渭南 714300; 5. 内蒙古巴彦淖尔市农牧业科学研究院 巴彦淖尔 015000)
本试验以黄瓜与西芹间作种植模式为处理, 黄瓜单作和西芹单作种植模式为对照, 利用Illumina公司Miseq平台对上述不同处理土壤进行16S rDNA细菌群落多样性高通量测序分析和田间接种黄瓜枯萎病菌, 探讨黄瓜与西芹间作模式土壤细菌的多样性及其对田间黄瓜枯萎病发生的影响。16S rDNA测序结果表明, 黄瓜与西芹间作土壤的细菌物种总数最多, 群落多样性水平最高, 与对照相比显著提高了土壤细菌observed species指数、Shannon指数和Chao1指数(<0.05); Beta多样性聚类分析表明, 黄瓜与西芹间作土壤的环境群落物种与黄瓜单作和西芹单作有一定差异性。在门分类水平上, 共检测到45个菌门, 其中变形菌门占明显优势, 其次为酸杆菌门和放线菌门等; 黄瓜与西芹间作土壤细菌种类所占比例最高, 达98.63%。在属水平上, 共检测到428类菌属, GP6、GP16、GP4、芽单胞菌属、节细菌属5属的丰度值较大; 黄瓜与西芹间作土壤的节细菌属分布比例最高,红游动菌属、鞘氨醇单胞菌属和芽球菌属丰度值较大, 为黄瓜与西芹间作土壤细菌明显优势菌属。田间接种黄瓜枯萎病菌试验结果表明, 采用上述3种不同种植模式土壤种植黄瓜, 在黄瓜苗期接种黄瓜枯萎病菌, 黄瓜与西芹间作处理的黄瓜枯萎病的田间发病率较西芹单作和黄瓜单作分别降低57.03%~63.54%和66.95%~72.15%。因此, 黄瓜与西芹间作增加了土壤细菌群落多样性, 降低了黄瓜枯萎病的发病率, 对后茬黄瓜土传病害防控具有一定科学指导意义。
黄瓜枯萎病; 黄瓜与西芹间作; 16S rDNA测序; 土壤细菌多样性; 田间发病率; 菌群丰度
黄瓜枯萎病是由尖镰孢菌黄瓜专化型(f. sp.)侵染而引起的维管束坏死的一种真菌性土传病害, 危害严重, 防治困难, 至今未找到一种有效的防治方法。已有研究表明, 植物土传病害的发生与土壤微生物之间有一定的关系[1], 且有一些微生物能够有效降低土传病害的发生。苏阿德等[2]证实芽孢杆菌(spp.)能降低番茄青枯病的发生; 高芬等[3]发现蜡质芽孢杆菌()对黄瓜枯萎病菌(f.sp.)具有良好抑制作用; 假单胞菌(spp.)中许多细菌菌株可以有效地抑制多种真菌和细菌引起的根部病害[4]。很多相关研究均证实了土壤细菌种群多样性和细菌群落结构对土壤真菌的抑制作用有重要影响[5-6]。
利用间作套种能较好地控制多种土传病害发生的报道在国内外已有很多[7-9]。董艳等[10]利用小麦()与蚕豆()进行间作, 发现蚕豆根际微生物数量显著增加, 而蚕豆枯萎病发病率和病情指数显著降低。苏世鸣[11]利用旱作水稻()与西瓜()进行间作, 发现二者间作处理的总微生物数量显著增加, 且间作处理的西瓜均生长正常, 而单作西瓜枯萎病发病率非常高, 达66.7%。
目前, 关于黄瓜枯萎病的防治与土壤微生物多样性之间关系的报道较少, 特别是黄瓜()与西芹()间作对土壤微生物多样性的研究尚少见报道。本课题组近几年的大量研究结果表明, 西芹能有效防控黄瓜枯萎病的发生[12-14]。本研究在此基础上, 选择西芹为黄瓜间作作物, 田间种植并接种黄瓜枯萎病菌, 通过采集不同种植模式的土壤进行16S rDNA高通量测序和田间调查枯萎病发病率, 揭示黄瓜与西芹间作土壤细菌群落的变化规律和预防枯萎病发生的防治效果, 进一步探讨黄瓜与西芹间作土壤细菌群落多样性变化与黄瓜枯萎病田间发病之间的关系, 为通过间套混作等农业措施改善设施土壤微生态环境以及土传病害田间防控提供科学理论支撑。
1 材料与方法
1.1 试验地概况及材料
试验地位于内蒙古呼和浩特市赛罕区(110°40′~ 112°10′E, 40°36′~40°57′N), 该区土壤为黏壤土, 年平均气温13.6 ℃, 年日照时数1 600 h, 无霜期113~134 d, 年平均降水量335.2~534.6 mm, 中温带大陆性季风气候。0~20 cm供试土壤基本化学性质为: pH 6.61, 电导率93.65 μS×cm-1, 有机质43.73 g×kg-1, 硝态氮7.42 mg×kg-1, 铵态氮1.77 mg×kg-1, 速效磷77.63 mg×kg-1,速效钾259.62 mg×kg-1。因年年种植黄瓜, 造成土壤连作, 土传病害发生严重, 尤其是枯萎病发生严重, 发病率达30%~40%。供试黄瓜品种为‘津春四号’, 由天津科润黄瓜研究所提供。供试西芹品种为‘美国西芹’, 由寿光惠农种业有限公司提供。供试菌种黄瓜枯萎病菌由中国农业科学院蔬菜花卉研究所提供。
1.2 试验方法
1.2.1 土样采集及处理方法
田间种植试验于2017年2—9月在内蒙古农业大学科研教学基地进行。以黄瓜与西芹间作种植(JZ)为处理, 西芹单作(XD)和黄瓜单作(HD)种植为对照。黄瓜单作于3月24日播种育苗, 4月24日定植, 株行距35 cm×55 cm。西芹单作于2月14日播种育苗, 4月24日定植, 株行距30 cm×20 cm。黄瓜与西芹间作采用二者隔行种植, 1行黄瓜, 2行西芹, 4月24日定植, 种植密度同上。每处理3次重复, 完全随机排列, 小区面积18 m2, 常规管理。7月27日(黄瓜拉秧前), 使用土钻采用“X”型5点取样法, 采集植株附近0~15 cm耕层土壤, 将土样充分混匀后, 一部分土壤装塑封袋, 送实验室于室内阴凉处, 摊开晾干, 剔除植物残体、石块和其他杂物, 风干后磨碎, 过2 mm筛孔放于-80 ℃冰箱保存, 用于16S rDNA细菌多样性分析。另一部分土壤作为苗钵土种植黄瓜, 进行黄瓜枯萎病菌接种试验。
1.2.2 黄瓜枯萎病田间接种方法
用上述不同土壤种植黄瓜, 每处理装25个苗钵, 4次重复。28 ℃光照培养箱恒温催芽, 待黄瓜种子露白时, 将其播种于上述苗钵里, 每穴1粒。在黄瓜幼苗第1片真叶完全展开时, 采用灌根法接种黄瓜枯萎病菌Foc, Foc浓度为1.0×106个×mL-1, 接种菌量为5 mL×钵-1, 接种7 d后开始调查枯萎病发病情况, 每隔2 d调查1次, 共调查5次, 计算黄瓜枯萎病病情指数和抑制率。黄瓜枯萎病不同发病级数参照标准为: 0级, 无症状; 1级, 胚轴及子叶轻微萎蔫, 子叶失去光泽; 2级, 植株轻度萎蔫或子叶萎蔫; 3级, 植株明显萎蔫或矮化; 4级, 植株严重萎蔫或倒伏枯死。
病情指数(%)=100×Σ(病情级值×该级病情株
数)/(病情最高级值×总株数 (1)
防治效果(%)=(对照病情指数-处理病情指数)/
对照病情指数×100% (2)
1.3 16S rDNA试验流程
将田间采集的上述土壤样品送往上海联川生物工程有限公司, 利用OMEGA的试剂盒提取土壤DNA。对提取到的基因组DNA进行琼脂糖电泳检测, 查看基因组DNA的完整度与浓度。利用Qubit 2.0 DNA检测试剂盒对基因组DNA精确定量, 以确定PCR反应加入的DNA量。16S rDNA测序使用高可变区PCR扩增产物建库, 文库构建步骤遵循Illumina测序仪文库构建方法。具体步骤为: 本次16S rDNA测序以V3和V4为目标区域进行引物设计, V3和V4大约共469 bp, 不同物种长度上会有略微差异。引物围绕V3和V4周围的保守区域设计, 16S rDNA融合319F引物(5’-ACTCCTACGGGAGGCAGCAG-3’)和融合R引物(5’-GGACTACHVGGGTWTCTAAT-3’), 其中, F、R为Miseq测序平台通用引物。使用Phusion酶扩增相应高可变区, 使用DNA模板50 ng, 25mL的PCR体系, 扩增35个循环。一轮扩增反应之后, 在正反向引物两端分别加上不同的adapters和barcodes, 再进行下一轮扩增, 扩增完成的PCR产物纯化之后进行上机测序。PCR扩增体系如下:TMHot Start Version12.5mL; Forward Primer(1) 2.5mL; Reverse Primer(1) 2.5mL; Template DNA 50 ng; ddH2O 25mL。PCR产物用AxyPrepTM Mag PCR Normalizer做归一化处理。构建好的文库上样到cBot或簇生成系统, 利用Illumina MiSeq测序仪进行2 x 300 bp paired-end测序。对于MiSeq测序获得的双端数据, 首先根据barcode信息进行样品区分, 然后根据overlap关系进行merge拼接成tag, 接着对拼接完成的数据进行数据过滤, 随后进行Q20、Q30等质控分析。对最终获得clean数据进行OTU聚类分析和物种分类学分析。
1.4 数据处理
Alpha多样性指数及数据分析采用SPSS 17.0方差分析Duncan多重比较和Excell软件处理。
2 结果与分析
2.1 不同处理土壤细菌OUT分布venn图
宏基因组测序经常用OTU, 即可操作分类单元(operational taxonomy unit)进行物种分类及物种相对丰度的分析。本试验采用CD-HIT将序列相似性大于97%的clean tags定为一个OTU, 选择其中序列最长的reads做为该OTU的代表序列, 通过OTU分析样品中的微生物多样性和不同微生物的丰度。不同处理土样细菌venn图如图1所示。测序结果表明, 黄瓜与西芹间作土样的OUT总数最多, 为6 793种; 黄瓜单作次之, 为6 357种; 西芹单作最少, 为6 341种。其中, 3种不同处理土壤共有细菌种类可达3 748种, 不同细菌种类中, 黄瓜与西芹间作土壤最多, 达587种, 比黄瓜单作和西芹单作分别增加27.89%和38.12%, 说明黄瓜与西芹间作处理增加了土壤细菌的新种类。

图1 不同处理土壤细菌OUT分布venn图
XD、HD、JZ分别代表西芹单作、黄瓜单作和黄瓜与西芹间作。XD, HD, and JZ indicate celery monoculture, cucumber monoculture and cucumber-celery intercropping, respectively.
2.2 不同处理土壤细菌多样性指数
2.2.1 Alpha多样性指数
Alpha多样性指数能够反映细菌群落的丰富度和均匀度, 不同处理土壤细菌Alpha多样性指数统计结果见表1。结果表明, 不同处理土壤细菌物种不同, 黄瓜与西芹间作处理的土壤observed species指数和Chao1指数均达到最大值, 土壤细菌物种最丰富, 与西芹单作和黄瓜单作达显著差异(0.05); 不同处理土壤细菌生物多样性水平也存在显著差异, 黄瓜与西芹间作处理的土壤细菌群落多样性水平最高, Shannon指数最高, 高于西芹单作和黄瓜单作, 且与二者达显著性差异(0.05)。Alpha多样性水平的不同说明黄瓜与西芹间作处理改变了土壤细菌群落的组成和分布, 增加了间作处理土壤的细菌群落多样性, 黄瓜单作次之, 西芹单作最低。不同处理间Simpson指数无显著性差异。
2.2.2 Beta多样性分析
Beta多样性通常用于分析不同环境群落之间的物种差异性。本试验Beta多样性分析是基于各土样的OTU组成分析结果, 采用weighted unifrac法计算土样间距离(表2), 根据计算得到的样品距离矩阵, 采用UPGMA(unweighted pair group method with arithmetic mean)方法对土样进行聚类, 做出聚类树形(图2)。表2表明, 黄瓜与西芹间作和西芹单作的距离系数最小, 为0.14; 黄瓜与西芹间作处理和黄瓜单作距离系数其次, 为0.16; 黄瓜单作和西芹单作距离系数最大, 为0.16。图2表明, 黄瓜与西芹间作(JZ1与JZ2)聚为一类, 黄瓜单作(HD1, HD2, HD3)聚为一类, 西芹单作(XD1, XD2与XD3)聚为一类, 说明黄瓜与西芹间作处理后, 土壤环境群落的物种不同于黄瓜单作和西芹单作, 具有一定差异性。
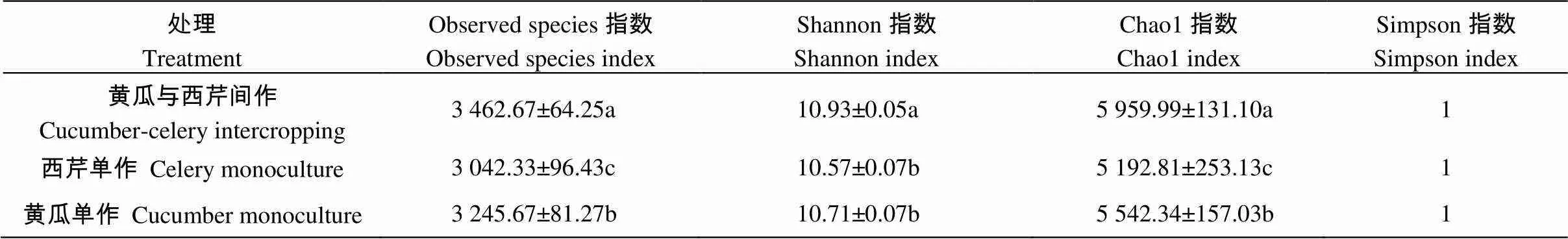
表1 不同处理土壤细菌Alpha多样性指数分析
同列不同小写字母表示0.05水平差异显著。Data with different lowercase letters in the same column are significantly different at 0.05 level.
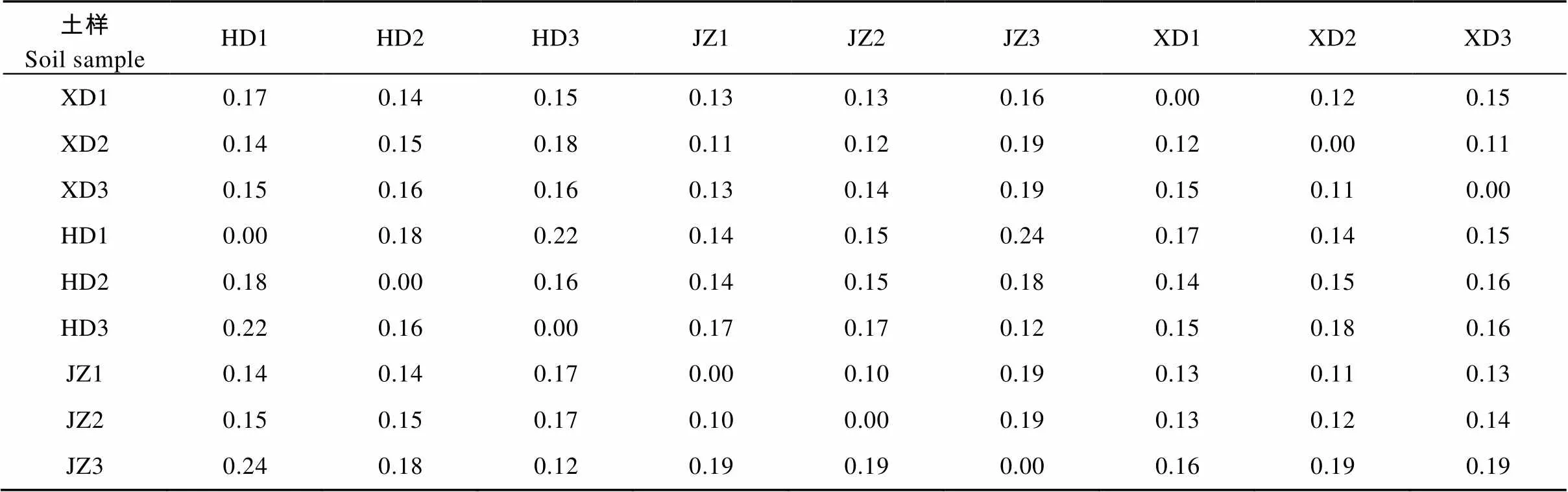
表2 Weighted unifrac法计算的不同处理样品土壤细菌群落间的距离
XD、HD、JZ分别代表西芹单作、黄瓜单作和黄瓜与西芹间作。1、2和3为各处理的重复。XD, HD, and JZ indicate celery monoculture, cucumber monoculture and cucumber-celery intercropping, respectively. 1, 2 and 3 show replicates of treatments.

图2 不同处理样品土壤细菌群落的聚类树形图
XD、HD、JZ分别代表西芹单作、黄瓜单作和黄瓜与西芹间作。1、2和3为各处理的重复。XD, HD, and JZ indicate celery monoculture, cucumber monoculture and cucumber-celery intercropping, respectively. 1, 2 and 3 show replicates of treatments.
2.3 不同处理土壤细菌在门水平的分布
2.3.1 细菌门水平群落组成
在门分类水平上, 不同处理土壤细菌群落组成见表3。表3表明, 16S rDNA共检测出45个菌门, 其中变形菌门(Proteobacteria)是明显优势类群, 其次为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes)。上述5类菌门中, 黄瓜与西芹间作土壤细菌群丰度百分比之和最高, 为87.33%, 其次为黄瓜单作和西芹单作, 分别为86.44%和85.70%, 差异不明显; 门分类水平菌群丰度百分比为前10种细菌中, 黄瓜与西芹间作土壤细菌群落组成所占比例最高, 达98.63%, 比黄瓜单作和西芹单作分别增加1.69%和1.22%。其中, 酸杆菌门、放线菌门、绿弯菌门和芽单胞菌门所占比例增加最高, 黄瓜与西芹间作处理所占比例达53.70%, 明显高于黄瓜单作和西芹单作, 比黄瓜单作和西芹单作分别增加9.75%和7.90%, 说明黄瓜与西芹间作丰富了土壤细菌群落, 增加了土壤细菌种类。而变形菌门与上述3种菌门所占比例不同, 黄瓜与西芹间作土壤所占比例最低, 为33.63%, 黄瓜单作所占比例最高, 为36.77%, 西芹单作次之, 为36.67%, 达差异显著性(0.05)。

表3 不同处理土壤细菌在门水平上的群落组成
表中只列出门分类水平上菌群丰度百分比≥0.1%的菌门。同行不同小写字母表示0.05水平差异显著。XD、HD、JZ分别代表西芹单作、黄瓜单作和黄瓜与西芹间作。Only phyla with ≥0.1% abundance percentages were listed. Data with different lowercase letters in the same line are significantly different at 0.05 level. XD, HD, and JZ indicate celery monoculture, cucumber monoculture and cucumber-celery intercropping, respectively.
2.3.2 土壤细菌门水平群落分布
物种分类热图(taxa heat map)颜色梯度变化及相似程度能够反映多个样品在各分类水平上群落组成的相似性和差异性。图3表明, 不同丰度的物种经过分块聚集后不同土壤细菌群落组成既有一定相似性, 又表现出一定差异性。在门分类水平上, 黄瓜与西芹间作土壤细菌群落分布的比对期望值(expectation value)最大, 颜色最深, 说明物种丰富度高, 西芹单作和黄瓜单作次之。聚类分析表明, 黄瓜单作和西芹单作土壤细菌种类丰度一致, 群落结构相似, 聚为一类, 黄瓜与西芹间作土壤与之不同。OP3、绿弯菌门、Cyanobacteria、WS3、拟杆菌门(Bacteroidetes)、芽单胞菌门、变形菌门、放线菌门、浮霉菌门(Planctomycetes)、硝化螺旋菌门(Nitrospirae)、迷踪菌门(Elusimicrobia)、酸杆菌门、Latescibacteria、绿弯菌门在黄瓜与西芹间作土壤中表达量最高, 丰富度最高。其中, OP3与绿弯菌门、WS3和拟杆菌门分别聚为一类, 在不同土壤中表达量分别为黄瓜与西芹间作>黄瓜单作>西芹单作。芽单胞菌门与变形菌门聚为一类, 在不同土壤中表达量分别为黄瓜与西芹间作>西芹单作>黄瓜单作。浮霉菌门与硝化螺旋菌门、迷踪菌门与酸杆菌门、Latescibacteria与绿弯菌门分别聚为一类, 在不同土壤中表达量为黄瓜与西芹间作>西芹单作>黄瓜单作。其中, 比较特殊的是蓝藻细菌(Cyanobateria), 其在不同土壤中的表达量为黄瓜单作>黄瓜与西芹间作>西芹单作, 而Candidatus Saccharibacteria的表达量为西芹单作>黄瓜与西芹间作>黄瓜单作。Others与unclassified菌门在黄瓜与西芹间作土壤表达量最高, 说明间作处理土壤还有大量其他或未知菌门需要进一步鉴定、分类和分析。

图3 不同处理土壤细菌门水平的物种分类热图
XD、HD、JZ分别代表西芹单作、黄瓜单作和黄瓜与西芹间作。XD, HD, and JZ indicate celery monoculture, cucumber monoculture and cucumber-celery intercropping, respectively.
2.4 不同处理土壤细菌在属水平上分布
2.4.1 土壤细菌属水平群落组成
不同土壤细菌属水平群落组成见图4。在属分类水平上, 16S rDNA共检测出428类细菌, 其中, GP6、GP16、GP4、芽单胞菌属()、节细菌属()5属的丰度值较大, 平均占检测总菌属的20.3%。不同土壤细菌属水平分布结构不同, 存在一定差异性。土壤细菌菌群丰度百分比≥0.1%的菌属平均占34.9%, 其他(菌群丰度百分比<0.1%和未分类菌属)菌属占65.1%, 其中, 未分类菌属平均占33.9%。黄瓜与西芹间作土壤的节细菌属分布比例最高, 为1.73%, 高于黄瓜单作和西芹单作, 分别为1.67%和1.07%, 一般研究认为, 节细菌属是环境微生物中代谢烟碱的优势种群, 可以通过固氮作用产生多种植物激素以促进作物水分和矿质元素吸收。其余红游动菌属()、鞘氨醇单胞菌()和芽球菌属()也占一定比例。
2.4.2 土壤细菌属水平群落分布
不同土壤细菌物种属水平分类热图如图5所示。结果表明, 不同丰度的物种经过分块聚集后不同土壤细菌群落组成既有一定相似性, 又表现出了一定差异性。其中, 在属分类水平上, 黄瓜与西芹间作土壤细菌群落分布颜色最深, 比对期望值最大, 物种丰度最高, 说明其细菌群落组成最丰富。聚类分析表明, 黄瓜单作和西芹单作土壤细菌种类丰度一致, 群落结构相似, 聚为一类, 而黄瓜与西芹间作未与之聚为一类。GP16、GP6、GP4、鞘氨醇单胞菌属、GP17在黄瓜与西芹间作土壤中表达量最高, 丰富度最高。其中, GP16与GP6聚为一类, 在不同土壤中表达量为黄瓜与西芹间作>黄瓜单作>西芹单作; 鞘氨醇单胞菌属与GP17聚为一类, 在不同土壤中表达量为黄瓜与西芹间作>西芹单作>黄瓜单作。比较特殊的是红游动菌属和, 其表达量为西芹单作>黄瓜与西芹间作>黄瓜单作。

图4 不同处理土壤细菌属水平上的群落组成
XD、HD、JZ分别代表西芹单作、黄瓜单作和黄瓜与西芹间作。XD, HD, and JZ indicate celery monoculture, cucumber monoculture and cucumber-celery intercropping, respectively.

图5 不同处理土壤细菌属水平上的物种分类热图
2.5 黄瓜与西芹间作对黄瓜枯萎病田间发病的影响
不同土壤田间种植黄瓜, 在黄瓜第1片真叶完全展开时, 采用灌根法接种黄瓜枯萎病菌FOC, 接种7 d后不同土壤黄瓜枯萎病发病情况及防治效果如表4所示。结果表明, 黄瓜与西芹间作处理土壤黄瓜枯萎病病情指数明显低于西芹单作和黄瓜单作, 且分别与黄瓜单作和西芹单作达显著差异(<0.05)。接种黄瓜枯萎病菌后, 随着接种日期的延后, 不同土壤的黄瓜枯萎病病情指数均呈现逐渐增加趋势, 接种13 d后, 病情指数趋于稳定变化趋势较小。黄瓜与西芹间作对西芹单作对黄瓜枯萎病的防治效果达57.03~ 63.54%, 对黄瓜单作的防治效果达66.95%~72.15%。

表4 不同处理土壤对黄瓜枯萎病发病及防治效果的影响
同列不同小写字母表示0.05水平差异显著。Data with different lowercase letters in the same column are significantly different at 0.05 level.
3 讨论与结论
3.1 黄瓜与西芹间作土壤微生物多样性分析
微生物在土壤养分循环和生态系统功能上起着重要作用, 研究微生物群落有助于更好地认识土壤特性[15]。环境改变、根际化感物质或分泌物质量和数量改变都会引起土壤细菌群落结构的变化[16]。已有研究表明, 利用小麦与黄瓜进行间作, 改变了黄瓜土壤微生物的区系组成, 土壤细菌和放线菌数量明显增加[17]; 黄瓜与毛苕子()间作, 黄瓜根际微生物多样性水平明显增加, 土壤生态环境得到明显改善[18]。有研究表明, 西芹根系能够分泌酸类、酯类、酚类、醇类及含氮化合物等物质, 这些物质与植物间化感作用密切相关[19]。本试验利用宏基因组学16S rDNA高通量测序技术对黄瓜与西芹间作土壤细菌多样性进行了分析, 测序结果能够较高程度地分析不同土壤的细菌群落多样性, 结果表明, 黄瓜与西芹间作增加了土壤细菌种群种类和数量, 丰富了黄瓜与西芹间作土壤Alpha多样性, 提高了黄瓜与西芹间作土壤细菌生物多样性水平。Beta多样性聚类分析表明, 黄瓜与西芹间作土壤环境群落的物种与黄瓜单作和西芹单作不同, 具有一定差异性。
16S rDNA测序结果表明, 在门水平上共检测出45个菌门, 其中变形菌门占明显优势, 其次为酸杆菌门、放线菌门、绿弯菌门、芽单胞菌门。同时, 不同土壤样品中未分类菌门(unclassified bacteria)仍占有一定比例, 说明各样品土壤中仍存在大量未知和稀有细菌。通过对不同土壤细菌群落结构的分析, 虽然黄瓜与西芹间作处理与黄瓜单作和西芹单作细菌整体分布结构相对稳定, 但分布存在一定差异。不同土壤变形菌门(33.63%~36.77%)是最丰富的细菌类群, 这一结果与国内外关于农田土壤细菌多样性的很多研究一致[20]。其次为酸杆菌门、放线菌门、绿弯菌门和芽单胞菌门。放线菌门细菌偏好碱性环境, 且土壤中较高的碳氮比及低分子有机质含量能更好地促进作物生长。绿弯菌门细菌可通过光合作用产生能量, 并且对于土壤环境的污染具有一定降解功能。本试验研究结果表明, 黄瓜与西芹间作土壤的放线菌门、绿弯菌门和芽单胞菌门所占比例高于黄瓜单作和西芹单作; 门水平物种分类热图结果进一步表明, 黄瓜与西芹间作土壤的细菌物种最丰富, 黄瓜单作和西芹单作细菌种类丰度一致, 群落结构相似, 聚为一类, 而黄瓜与西芹间作与黄瓜单作和西芹单作不同。
16S rDNA测序结果表明, 在属水平上共检测出428个菌属, 其中, GP6、GP16和GP4 3种酸杆菌、芽单胞菌属、节细菌属5类菌属丰度值较大, 平均占检测菌属20.3%, 其次, 红游动菌属、鞘氨醇单胞菌和芽球菌属也占一定比例。未分类(unclassified)菌属所占比例较高, 达33.9%, 说明各样品土壤中仍存在大量未知和稀有细菌需要进一步鉴定和分析,探索其功能和作用。本试验结果表明, 黄瓜与西芹间作土壤的节细菌属分布比例最高, 其可以通过固氮作用产生多种植物激素, 对促进黄瓜和西芹吸收水分和矿质元素具有一定作用; 鞘氨醇单胞菌是降解土壤有毒物质最有效的微生物之一, 且可以促进作物根际营养吸收、抵抗多种病原菌, 有研究认为, 鞘氨醇单胞菌属某些菌株还具有固氮和脱氢特性, 在维持植物土壤氮平衡方面起着重要作用[21]。本研究中黄瓜与西芹间作土壤的鞘氨醇单胞菌为较具优势的一类种群, 分布比例达1.1%; 芽球菌属在黄瓜与西芹间作土壤中也占有一定比例, 有研究表明, 芽球菌属能够抵御不良的环境条件、防治土壤病害的发生[22]。
3.2 黄瓜与西芹间作土壤微生物多样性与黄瓜枯萎病发生的关系
国内外研究表明, 土壤微生物多样性与土传病害的发生具有很强相关性[23]。一方面, 土传病害的发生会降低土壤微生物多样性, 相比于健康土壤, 患有马铃薯青枯病土壤的细菌群落结构发生了明显变化且多样性明显减少[24]。另一方面, 土壤微生物中群落结构及其多样性的变化也会影响土传病害的发生, 土壤微生物多样性与群落结构对土壤抑病能力非常关键, 微生物多样性高的土壤病原菌数量少且外源病原菌难以入侵生存[25]。已有研究表明, 黄瓜枯萎病的发生及发病程度的轻重, 是病原菌和土壤中各种微生物相互作用的结果[26]。土壤微生物多样性与植物土传病害抑制水平密切相关, 根际微生物在抑制土传病害和促进植物生长过程中具有重要的作用[27]。本试验中, 在黄瓜与西芹间作土壤上种植黄瓜, 田间接种黄瓜枯萎病菌后, 其枯萎病发病率明显降低, 可能与土壤放线菌门、节细菌属、鞘氨醇单胞菌比例增加有关, 这些菌门和菌属细菌种类的增加促进了黄瓜植株的生长, 增强了黄瓜植株抵抗病原菌的能力, 从而降低了黄瓜枯萎病菌的田间发病率。
本研究以传统栽培模式为背景, 将黄瓜作为种植主体, 选择具有化感作用的西芹为间作植物, 对黄瓜与西芹间作模式下土壤细菌群落结构组成、变化和田间黄瓜枯萎病发生进行了研究。结果表明, 黄瓜与西芹间作丰富了土壤细菌生物多样性水平, 改变了土壤细菌的群落结构, 增加了一些有益菌的数量, 提高了田间黄瓜植株对黄瓜枯萎病菌的抵抗能力, 从而降低了黄瓜枯萎病菌的田间发病率, 对今后通过间套作等农业措施修复土壤和防控土传病害具有指导意义。
[1] DE BOER M, BORN P, KINDT F, et al. Control of fusarium wilt of radish by combining pseudomonas putida strains that have different disease-suppressive mechanisms[J]. Phytopathology, 2003, 93(5): 626–632
[2] 苏阿德, 谢关林, 李斌, 等. 芽孢杆菌在促进番茄生长和控制青枯病上的比较优势[J]. 浙江大学学报: 农业与生命科学版, 2004, 30(6): 603–610 SU A D, XIE G L, LI B, et al. Comparative performance ofspp. in growth promotion and suppression of tomato bacterial wilt caused by[J]. Journal of Zhejiang University: Agriculture and Life Sciences, 2004, 30(6): 603–610
[3] 高芬, 马利平, 乔雄梧, 等. 蜡质芽孢杆菌BC98-Ⅰ发酵液与抑菌粗提物对黄瓜枯萎病菌的抑菌特性研究[J]. 中国生态农业学报, 2006, 14(1): 189–192 GAO F, MA L P, QIAO X W, et al. The antimicrobial characters of the fermenting liquor of BC98-Ⅰ (.) and its antifungal crude extraction on(Schl.) f. sp.Owen[J]. Chinese Journal of Eco-Agriculture, 2006, 14(1): 189–192
[4] 徐美娜, 王光华, 靳学慧. 土传病害生物防治研究进展[J]. 吉林农业科学, 2005, 30(2): 39–42 XU M N, WANG G H, JIN X H. Progress in studies on biological control of soil mediated diseases[J]. Journal of Jilin Agricultural Sciences, 2005, 30(2): 39–42
[5] 吴敏娜, 张惠文, 李新宇, 等. 土壤抑真菌作用与细菌群落结构的关系[J]. 应用生态学报, 2008, 19(7): 1574–1578 WU M N, ZHANG H W, LI X Y, et al. Relationship between fungistasis of soil and bacterial community structure[J]. Chinese Journal of Applied Ecology, 2008, 19(7): 1574–1578
[6] YANG C H, CROWLEY D E, MENGE J A. 16S rDNA fingerprinting of rhizosphere bacterial communities associated with healthy and phytophthora infected avocado roots[J]. FEMS Microbiology Ecology, 2001, 35(2): 129–136
[7] ZHU Y Y, CHEN H R, FAN J H, et al. Genetic diversity and disease control in rice[J]. Nature, 2000, 406(6797): 718–722
[8] GÓMEZ-RODRÍGUEZ O, ZAVALETA-MEJÍA E, GONZÁ1EZ- HEMÁNDEZ V A, et al. Allelopathy and microclimatic modification of intercropping with marigold on tomato early blight disease development[J]. Field Crops Research, 2003, 83(1): 27–34
[9] REN L X, SU S M, YANG X M, et al. Intercropping with aerobic rice suppressedwilt in watermelon[J]. Soil Biology and Biochemistry, 2008, 40(3): 834–844
[10] 董艳, 董坤, 郑毅, 等. 不同品种小麦与蚕豆间作对蚕豆枯萎病的防治及其机理[J]. 应用生态学报, 2014, 25(7): 1979-1987 DONG Y, DONG K, ZHENG Y, et al. Faba bean fusarium wilt () control and its mechanism in different wheat varieties and faba bean intercropping system[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 1979-1987
[11] 苏世鸣. 西瓜与旱作水稻间作抑制西瓜连作枯萎病及其机理[D]. 南京: 南京农业大学, 2007 SU S M. Decreasingwilt of watermelon in continuing cropping system by intercropping with aerobic rice[D]. Nanjing: Nanjing Agricultural University, 2007
[12] 高晓敏, 王琚钢, 李杰, 等. 西芹鲜根丙酮浸提物层析流分对黄瓜枯萎病菌的化感作用以及化感物质鉴定[J]. 中国生态农业学报, 2014, 22(11): 1364–1371GAO X M, WANG J G, LI J, et al. Allelopathic effects of fresh parsley root acetone extracts onf. sp.and allelochemicals identification[J]. Chinese Journal of Eco-Agriculture, 2014, 22(11): 1364–1371
[13] 钱程, 云兴福, 高晓敏, 等. 西芹鲜根浸提液作用后黄瓜枯萎病菌弱毒菌株的筛选[J]. 中国生态农业学报, 2013, 21(5): 606–614QIAN C, YUN X F, GAO X M, et al. Screening of virulence- attenuated strains forf. sp.after treatment with parsley fresh root extract[J]. Chinese Journal of Eco-Agriculture, 2013, 21(5): 606–614
[14] 包妍妍, 云兴福, 张东东, 等. 西芹根物质浸提液处理后黄瓜叶片内几种氮代谢物质含量的变化[J]. 中国生态农业学报, 2012, 20(11): 1508–1513BAO Y Y, YUN X F, ZHANG D D, et al. Nitrogen metabolites in cucumber leaves treated with parsley root extracts[J]. Chinese Journal of Eco-Agriculture, 2012, 20(11): 1508–1513
[15] MACDONALD C A, THOMAS N, ROBINSON L, et al. Physiological, biochemical and molecular responses of the soil microbial community after afforestation of pastures with[J]. Soil Biology Biochemistry, 2009, 41(8): 1642–1651
[16] WHITNEY D, ROSSMAN A, HAYDEN N. Evaluating an existing subsurface flow constructed wetland in Akumal, Mexico[J]. Ecological Engineering, 2003, 20(1): 105–111
[17] 王玉彦, 吴凤芝, 周新刚. 不同间作模式对设施黄瓜生长及土壤环境的影响[J]. 中国蔬菜, 2009, (16): 8–13WANG Y Y, WU F Z, ZHOU X G. Effects of different intercropping patterns on the growth of cucumber in greenhouse and soil environment[J]. China Vegetables, 2009, (16): 8–13
[18] 吴凤芝, 周新刚. 不同作物间作对黄瓜病害及土壤微生物群落多样性的影响[J]. 土壤学报, 2009, 46(5): 899–906 WU F Z, ZHOU X G. Effect of intercropping of cucumber with different crops on cucumber diseases and soil microbial community diversity[J]. Acta Pedologica Sinica, 2009, 46(5): 899–906
[19] 高晓敏, 王琚钢, 云兴福, 等. 西芹醇层物对黄瓜枯萎病菌的化感作用及化感物质鉴定[J]. 中国生物防治学报, 2017, 33(2): 281–288 GAO X M, WANG J G, YUN X F, et al. Allelopathic effects of fresh parsley root ethanol extracts onf. sp.and allelochemicals identification[J]. Chinese Journal of Biological Control, 2017, 33(2): 281–288
[20] 焦中志, 李相昆, 张立成, 等. 反硝化聚磷菌菌种筛分与除磷特性分析[J]. 沈阳建筑大学学报: 自然科学版, 2009, 25(3): 535–540JIAO Z Z, LI X K, ZHANG L C, et al. Isolation and characteristic of denitrifying phosphorus accumulating organism[J]. Journal of Shenyang Architecture University: Natural Science, 2009, 25(3): 535–540
[21] 单娜娜, 赖波. 风沙土成土演变过程中土壤微生物生物学特性研究进展与展望[J]. 新疆环境保护, 2004, 26(S1): 79–82 SHAN N N, LAI B. Study progresses and prospect on the ecological characteristics of soil-inhabiting microorganism in soil forming process of Aeolian sand soil[J]. Environmental Protection of Xinjiang, 2004, 26(S1): 79–82
[22] 孙红敏, 余利岩, 张玉琴. 地嗜皮菌科放线菌的研究进展[J]. 微生物学报, 2015, 55(12): 1521–1529 SUN H M, YU L Y, ZHANG Y Q. Recent advance in— Areview[J]. Acta Microbiologica Sinica, 2015, 55(12): 1521–1529
[23] GARBEVA P, VAN VEEN J A, VAN ELSAS J D. Microbial diversity in soil: Selection of microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology, 2004, 42: 243–270
[24] GORISSEN A, VAN OVERBEEK L S, VAN ELSAS J D. Pig slurry reduces the survival ofbiovar 2 in soil[J]. Canadian Journal of Microbiology, 2004, 50(8): 587–593
[25] BENIZRI E, PIUTTI S, VERGER S, et al. Replant diseases: bacterial community structure and diversity in peach rhizosphere as determined by metabolic and genetic fingerprinting[J]. Soil Biology and Biochemistry, 2005, 37(9): 1738–1746
[26] 邓晓, 李勤奋, 侯宪文, 等. 香蕉枯萎病不同感病级别植株根际与非根际土壤微生物物种多样性研究[J]. 中国农学通报, 2012, 28(30): 239–248 DENG X, LI Q F, HOU X W, et al. Study on the microbial species diversity of rhizosphere and non-rhizosphere soils from different grades infected by banana fusarium wilt[J]. Chinese Agricultural Science Bulletin, 2012, 28(30): 239–248
[27] GARBEVA P, VAN VEEN J A, VAN ELSAS J D. Assessment of the diversity, and antagonism towardsAG3, ofspecies in soil from different agricultural regimes[J]. FEMS Microbiology Ecology, 2004, 47(1): 51–64
Analysis of soil bacterial diversity under cucumber-celery intercropping and its influence on cucumberwilt*
QIN Lijin1,2, XU Feng3, LIU Yongsheng4, WANG Xuemin5, LI Quan1, YUN Xingfu1**
(1. College of Agriculture, Inner Mongolia Agricultural University, Hohhot 010018, China; 2. College of Life Science, Chifeng University, Chifeng 024000, China; 3. Agricultural Technical Service Center of Aohan Banner, Chifeng 024000, China; 4. Horticultural Station of Tongguan County Agricultural Bureau in Weinan City, Shaanxi Province, Weinan 714300, China; 5. Research Institute of Agriculture and Animal Husbandry in Bayannur City, Inner Mongolia, Bayannur 015000, China)
Cucumber wilt is a soil disease that is highly prevalent in the production and cultivation of cucumber. The disease is highly difficulttoprevent and cure. A number of studies have shown that intercropping was one of the most effective methods of reducing the occurrence of plant soil diseases. Also celery has been proven to have high allelopathy. To explore the application of allelopathic effects of celery on cucumber fusarium wilt control, we conducted cucumber and celery intercropping experiment. In the experiment, three planting patterns were set, which were cucumber-celery intercropping, celery monocropping and cucumber monocropping. The cucumber-celery intercropping pattern was regarded as treatment group and monocropping patterns of celery and cucumber regarded as the control group. The Miseq platform of Illumina Company was used to analyze 16S rDNA bacterial community diversity through high-throughput sequencing to discuss the influence of cucumber-celery intercropping on cucumber soil bacterial diversity. Cucumber was planted in soil from different planting patterns and inoculated withf.sp.(Foc) in the pot experiment to investigate the control effect of cucumber-celery intercropping on cucumber fusarium wilt. The 16S rDNA sequencing results showed that total bacterial species amount and community diversity were highest in soil under cucumber-celery intercropping, which significantly enhanced observed bacteria species index, Shannon index and Chao1 index (< 0.05). Beta diversity clustering analysis showed there existed a difference in environmental community species between soil from cucumber-celery intercropping and mono-cropped cucumber or celery. Moreover, 15 bacterial phyla were detected. Proteobacteria, which was followed by Acidobacteria and Actinobacteria, had a distinct advantage (35.7%-38.0%). Then the proportion of bacterial species derived from cucumber-celery intercropped soil was highest (98.63%). About 428 bacterial genera were detected with 5 dominant bacterial genera, which were GP6, GP16, GP4,and.,,andwere dominant bacteria genera in cucumber-celery inter-cropped soil. The 4 genera demonstrated that cucumber and celery intercropping enriched the diversity of bacterial communities compared with monocropped celery or cucumber. The results of fusarium wilt inoculation experiment of cucumber suggested that the control efficiency of cucumber-celery intercropping to cucumber fusarium wilt reached 57.03%-63.54% and 66.95%-72.15% relative to monocroped celery and cucumber, respectively. Therefore cucumber-celery intercropping increased the diversity of bacterial communities, and reduced incidence rate of cucumber fusarium wilt. This was of scientific interest for the prevention and control of soil borne diseases.
Cucumber fusarium wilt; Cucumber-celery intercropping; 16S rDNA sequencing; Soil bacterial diversity; Field incidence;Bacteria abundance
, E-mail: yxf5807@163.com
Jan. 19, 2018;
Mar. 22, 2018
S476
A
1671-3990(2018)08-1180-10
云兴福, 研究方向为高寒地区蔬菜栽培与生理。E-mail: yxf5807@163.com 秦立金, 研究方向为设施蔬菜土传病害生物防治与土壤修复。E-mail: 1597355169@qq.com
2018-01-19
2018-03-22
* This study was founded by the National Natural Science Foundation of China (31160100) and the Inner Mongolia Autonomous Region Application Technology Research and Development Project (201602050).
10.13930/j.cnki.cjea.180097
* 国家自然科学基金项目(31160100)和内蒙古自治区应用技术研究与开发项目(201602050)资助
秦立金, 徐峰, 刘永胜, 王学敏, 李全, 云兴福. 黄瓜与西芹间作土壤细菌多样性及其对黄瓜枯萎病发生的影响[J]. 中国生态农业学报, 2018, 26(8): 1180-1189
QIN L J, XU F, LIU Y S, WANG X M, LI Q, YUN X F. Analysis of soil bacterial diversity under cucumber-celery intercropping and its influence on cucumberwilt[J]. Chinese Journal of Eco-Agriculture, 2018, 26(8): 1180-1189

