贝加尔针茅草原土壤线虫与微生物群落特征及其相互作用
张爱林, 赵建宁, 洪 杰, 杨殿林*
(1. 农业部环境保护科研监测所,天津 300191; 2. 沈阳农业大学园艺学院,辽宁 沈阳 11086;3. 内蒙古鄂温克旗草原工作站,内蒙古 巴彦托海 021100)
中国北方温带草原一直以来广泛采用自由放牧的土地利用方式,牛、羊等家畜在进行采食、践踏和排泄等活动时会对草原产生多方面的影响[1]。不合理的土地利用方式及过大的土地利用强度会影响草原植被,引起草原植被退化,草场质量下降[2]。氮肥是草原生态系统最主要的限制因素[3],施氮作为提高草地生产力和恢复草地退化的有效途径和方法,已经被广泛使用[4]。目前研究结果均有表明,施氮肥会增加草地生长系统的地上生物量,且地上生物量的增加幅度与施肥梯度呈正相关,也就是施氮在短期内能加速草原生态系统生产力的恢复[5-6]。相比较于施肥对地上生物量的显著影响,施肥对于地下生物群落群落和生态环境的影响远比对地上生物量的影响要复杂。而且相比较对地上生产力,施氮对地下生态系统和土壤理化环境的影响更为重要[6]。
土壤线虫和土壤微生物是草地地下生态系统的重要组成部分,也是土壤物质循环和能量流动的主要参与者,是土壤生态系统中最活跃的部分。因此,土壤线虫及微生物多样性及其相关性能够作为生态系统功能的敏感指标,较早地指示草地生态环境变化和生态系统功能的变化。研究掌握土壤动物和土壤微生物多样性和相关性及其在外界施肥条件下对土壤环境和地下生态系统的影响是生态学领域关注的问题之一,在草原生态系统保护、恢复及重建中具有重要理论和实践意义[7]。
贝加尔针茅(Stipabaicalensis)草原是亚洲中部草原区所特有的草原群系,是草甸草原的代表类型之一。自20世纪80年代以来,由于放牧、刈割等不合理的利用制度,贝加尔针茅草原发生不同程度的退化,是中国草原主要的退化草地类型之一[8]。本研究以贝加尔针茅草原为研究对象,通过外界施氮,探讨贝加尔针茅草原土壤线虫和微生物群落的相关性,研究施氮对贝加尔针茅草原地下生态环境的影响,对于制定科学的草地生态系统管理对策,实现天然草地的可持续发展具有重要的理论和实践意义。
1 材料与方法
1.1 试验样地概况
本试验研究区域位于内蒙古呼伦贝尔市鄂温克旗境内(48°27′~48°35′ N,119°35′~119°41′ E),地带性植被为贝加尔针茅草甸草原,属于半干旱大陆性季风气候。海拔高度760 m,年均温-1.6℃,年降水量328.7 mm。土壤类型为暗栗钙土。0~20 cm土壤表层全氮 1.74 g·kg-1,全磷0.35 g·kg-1,土壤pH值7.4,土壤容重1.26 g·cm-3。试验地四周用围栏保护。优势植物为贝加尔针茅、羊草(Leymuschinensis) 。常见植物有羽茅 (Achnatherumsibiricum) 、日荫菅(Carexpediformis) 、线叶菊(Filifoliumsibicum)、肾叶唐松草(Tnalictrumpetaloidoum)、扁蓿豆(Pocockiaruthenica)、草地麻花头(Serratulakomarovii)、糙 隐 子 草(Cleistogenessquarrosa) 和寸草苔 (Carexduriuscula)等,共有植物66种,分属21科49属。
我们选择地形平坦,植被典型的地段自2014年6月开展长期氮素添加试验。试验施氮素处理强度和频度参考国际上同类研究的处理方法[9-10],设置氮素添加水平为 0、15、30、50、100、150、200、300 kg N·ha-1·yr-1,4次重复,小区面积64 m2(8 m×8 m),小区之间间隔2 m,重复间距设5 m隔离带。施肥每月1次,于每年6月中旬和7月中旬分两次施肥。按照施氮量换算成小区 NH4NO3施用量。为能够尽可能均匀施肥,生长季(5~9月)根据氮处理水平,将每个小区每次所需要喷施的氮素(NH4NO3)溶解在8 L水中(全年增加的水量相当于新增降水1.0 mm)后,均匀喷施到小区内,CK样方同时喷洒相同量的水。
1.2 样品采集与处理
于8月中旬,按照“随机”、“等量”和“多点混合”的原则,在各个处理小区内用直径为5 cm的土钻,按照S型取样法选取10个点,去除表面植被,取0~20 cm土壤混匀过筛,去除根系和土壤入侵物,采用“四分法”选取土样,迅速装入无菌封口袋,冰盒冷藏并迅速运至实验室。样品前处理分成两部分,一部分土样于4 °C保存用于线虫分析;一部分土样置于-70 °C超低温保存,供土壤微生物分析用。
1.3 土壤线虫的测定及分析
每个样品取土壤鲜样50 g,利用改良浅盘法[11]在25 °C下分离48 h。将分离后的线虫加入固定液(9%福尔马林、1%甘油和2~3滴冰醋酸)保存,利用显微镜进行计数和到属水平的鉴定,计算每100 g干土中含有线虫的条数。鉴定采用形态学方法鉴定,鉴定参照《De nematoden van Nederland》《Dorylaimida—Free-living,Predaceous and Plant-parasitic Nematodes》《中国土壤动物检索图鉴》《植物线虫分类学》。根据线虫头部形态学特征和取食生境将土壤线虫分为不同的c-p类群和4个功能营养类群:食细菌类群(Bacterivores)、食真菌类群(Fungivores)、植物寄生类群(Plantparasites)、捕食类群/杂食类群(Predators/Omnivores)[12]并计算土壤线虫群落结构生物多样性指标。
1.4 土壤微生物磷脂脂肪酸的测定分析
取-70 ℃保存的新鲜土样进行冻干处理,采用Bligh-Dyer法进行土壤微生物脂类的提取和磷脂脂肪酸[13]分析。取2 g冻干土,加氯仿-甲醇-柠檬酸缓冲液(1∶2∶0.8)震荡离心提取总脂,经氮吹后,加氯仿经活化柱(SiO2键合柱)分离得到磷脂脂肪酸,将分离后的磷脂加入甲醇甲苯混合液进行甲酯化,氮吹后加入内标,然后采用HP6890气相色谱-HP5973质谱联用仪(GC-MS)[14]进行分析。测定时,以十九烷酸甲酯(19∶00)作为内标,脂肪酸的定量方法采用峰面积和内标曲线法,再根据不同脂肪酸的分子结构划分为不同的微生物类群[15-16]。
根据不同微生物群落脂肪酸的分子结构和基团位置,将其分为细菌(革兰氏阳性G+和阴性菌G-)、真菌、放线菌等。其中,15∶00、i15∶00、a15∶00、16∶00、i16∶00、16∶1w5、16∶1w9、16∶1w7t、17∶00、i17∶00、a17∶00、cy17∶00、18∶1w5、18∶1w7、18∶1w7t、i19∶00、a19∶00、cy19∶00等属于细菌;i14∶00、i15∶00、a15∶00、i16∶00、i17∶00、a17∶00等为革兰氏阳性细菌;16∶1w7t、16∶1w9c、16∶1w7c、18∶1w7c、18∶1w9c、cy17∶00、cy19∶00等为革兰氏阴性细菌;18∶1w9、18∶2w6,9、18∶3w6、18∶3w3等为真菌;10me16∶00、10me17∶00、10me18∶00等为放线菌[17]。PLFA总量,以检测得到的脂肪酸加和表示。
1.5 数据分析
数据经过Excel前期处理后,使用SPSS 17.0和origin 9.1进行单因素方差分析和一般线性模型分析,采用LSD进行多重比较检验,显著水平为P<0.05。
2 结果与分析
2.1 氮素添加水平下土壤微生物的群落和活动
在本实验样地0~20 cm表层土壤中,共检测出34种生物标记的磷脂脂肪酸,其中细菌群落含量最高,占到PLFA总量的47.1%~65.6%;其次是真菌群落,占总PLFA的6.8%~19.7%(图1C、D)。分析表明,随着施氮水平的增加,土壤中总PLFA的含量变化不显著(图1A),说明施氮对贝加尔针茅草原表层土壤的微生物群落数量无显著的影响。但随施氮水平的增加,土壤中的细菌群落和真菌群落随施氮水平的改变有显著变化;土壤中的细菌群落在N15和N30的低氮条件下显著高于不施氮的空白对照,而在>N50的高氮条件下土壤细菌群落的增加量降低,与低氮处理相比显著减少(图1C);土壤中的真菌群落在不同的氮处理水平下有差异,但差异不显著,在N150的高氮处理时真菌群落显著低于N30的低氮处理(图1D)。在不同的施氮水平下,土壤中的真菌/细菌在14.5%~32.5%,都远小于50%,说明土壤中的微生物群落以细菌为主;同时,土壤中的真菌/细菌的变化趋势与土壤中的真菌变化趋势一致(图1B),说明施氮对土壤中的真菌和细菌群落有一定的影响,其中对真菌的影响远高于细菌。

图1 不同氮素添加水平土壤总PLFA、真菌/细菌、细菌群落、真菌群落的变化Fig.1 Changes of soil total PLFA, fungi / bacteria, bacterial community and fungi communities at different nitrogen levels
表1 不同氮素添加水平土壤线虫生态指标Table 1 Ecological indicators of soil nematodes under different nitrogen application levels

指标Index物种数Number of species丰富度SR多样性H'均匀度J’成熟度MI通路指数NCR结构指数WIN0 29ab3.73ab2.63a0.87ab8.71ab0.62a2.91aN1534a3.92a2.70a0.88ab9.92ab0.60a4.46aN3033a3.87a2.76a0.90b9.65a0.60a3.96aN5028b3.16b2.57a0.89a8.17b0.62a3.97aN100 29ab3.42ab2.54a0.86b8.53ab0.68a3.53aN150 27ab3.47ab2.50a0.85b8.22ab0.65a3.50aN20031a3.87a2.54a0.83b9.20ab0.60a4.34aN300 29ab3.49 ab2.56a0.86b8.65ab0.64a3.66a
注:同列不同字母表示差异显著(P<0.05)
Noye: Different letters in the same column indicate significant differences at the 0.05 level
2.2 氮素添加水平下土壤线虫的分布和群落结构
分析样地土壤中土壤线虫的群落结构发现,随着施氮水平的增加,土壤线虫的密度变化并不显著(图2)。在对土壤线虫群落的分析中,根据线虫头部形态学特征和取食生境将土壤线虫分为4个功能营养类群:食细菌类群(Bacterivores)、食真菌类群(Fungivores)、植物寄生类群(Plantparasites)、捕食类群/杂食类群(Predators/Omnivores)[19]。随着施氮水平的增加,食细菌类群线虫在
在不同的施氮处理下,土壤线虫的多样性(H’)、通路指数(NCR)、结构指数(WI)变化差异不显著,说明施氮对土壤线虫的稀有物种和土壤中线虫类群的比值影响不显著。施氮对土壤线虫的物种数量和多样性有显著影响且变化趋势一致,在施氮水平较低,

图2 不同氮素添加水平土壤线虫丰度的变化Fig.2 Changes of soil nematode abundance under different nitrogen application levels

图3 不同氮素添加水平土壤线虫类群的变化Fig.3 Changes of Soil Nematode in Different Nitrogen Levels
2.3 氮素添加水平下土壤线虫和微生物的相互作用
在不同的施氮水平下,不同类群的土壤线虫和土壤微生物的总PLFA、细菌群落、真菌群落和真菌/细菌的相关性不同(表2)。在不同的施氮水平下,土壤中的食细菌类群线虫、食真菌类群线虫和捕食类群/杂食类群线虫与土壤中微生物的磷脂脂肪酸总量、细菌群落和真菌群落之间都没有明显的相关性,即在不同施氮水平下土壤微生物群落的改变,对土壤中自由生活类群线虫(食细菌类群线虫和食真菌类群线虫)和杂食类群线虫没有显著的影响。但土壤中植物寄生性类群线虫和土壤中细菌、真菌和真菌/细菌之间有明显的线性关系。植物寄生类群线虫和土壤中的细菌群落、真菌/细菌呈显著正相关,与土壤中的真菌群落呈极显著正相关,说明在不同施氮水平下土壤中细菌和真菌群落的改变显著影响土壤中植物寄生类群线虫群落(图4)。
在不同的施氮水平下,土壤微生物群落的改变对土壤线虫不同生态指标的影响不同。土壤中真菌/细菌与土壤线虫的丰富度(SR)呈显著正相关,与土壤线虫的结构指数(WI)呈极显著负相关。土壤真菌群落与土壤线虫的均匀度(J’)呈显著正相关,与土壤线虫的结构指数(WI)呈极显著负相关。说明土壤中真菌群落的增加或细菌群落的减少都会促进土壤线虫物种丰富度的增加,同样真菌群落的增加也会促进土壤线虫均匀度的增加,增加线虫群落的稳定性。但当土壤真菌群落增加时,会显著抑制瓦斯乐思卡指数增长,说明土壤真菌群落的增加会提高植物受线虫感染的几率,改变土壤矿化途径,而土壤细菌群落和微生物的总量对线虫群落和生态指标影响较小(表3)。
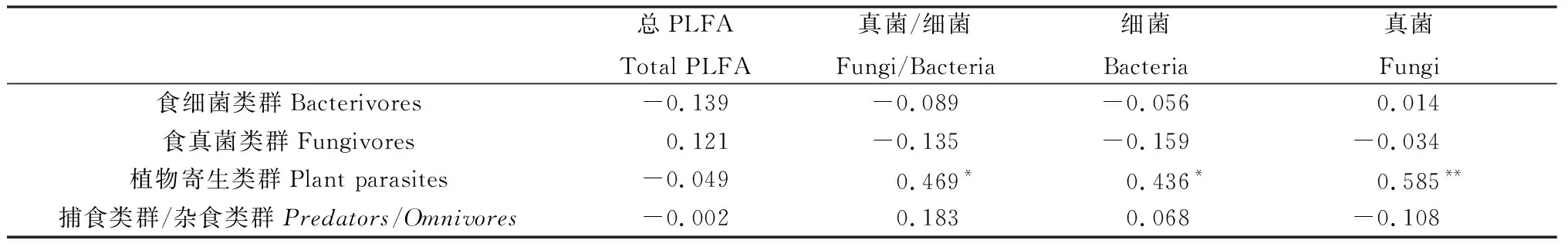
表2 土壤微生物与土壤线虫群落的相关性Table 2 Correlation between soil microorganism and soil nematode community
注:*表示差异显著(P<0.05);**表示差异显著(P<0.01)。下同
Noye: * indicates significant differences at the 0.05 level;**indicates significant differences at the 0.01 level;The same as below

图4 不同氮素添加水平植物寄生类群线虫与土壤微生物群落的关系Fig.4 Relationship between plant parasitic nematodes and soil microbial community under different nitrogen application levels
表3 土壤微生物与土壤线虫生态指标的相关关系Table 3 Correlation between soil microbes and ecological indicators of soil nematodes

丰富度SR多样性H'均匀度J’成熟度MI通路指数NCR结构指数WI总PLFATotal PLFA0.070-0.151-0.078-0.130-0.315-0.141真菌/细菌Fungi/Bacteria0.454*0.3680.312-0.100-0.112-0.542**细菌 Bacteria0.1960.104-0.0150.3250.057-0.287真菌 Fungi0.3350.3850.428*-0.047-0.033-0.575**
3 讨论
3.1 土壤线虫和微生物对施氮处理的响应
施肥对植物地上生物量、土壤理化性质、土壤养分和植物根系分泌物等都有显著影响[18-19],而土壤微生物的群落结构和数量也受到以上因素的影响[20],说明施氮会对土壤微生物的群落和数量产生一定的影响。本实验通过磷脂脂肪酸法测定土壤微生物的群落发现,在贝加尔针茅草原进行不同水平的施氮处理,对土壤总PLFA含量影响不显著,这与Shicheng Zhao等[21]的研究结果相一致,说明施氮对草甸草原土壤微生物的总量无显著影响。但在不同的施氮水平下,土壤细菌群落数量出现波动,在不同施氮水平下细菌群落变化不显著,但施氮处理下的细菌群落都显著高于空白对照,这与Yuji Jiang等[22]的研究结果相一致,这说明施氮可以显著增加土壤细菌群落的数量,原因可能由于草原土壤养分匮乏,施氮促进了草原植被的显著增长,使植物根系分泌物增加,促进了细菌群落的增长[23]。而不同施氮水平对土壤真菌群落和土壤真菌/细菌的影响结果相同,在
不同梯度的施氮处理对土壤线虫的影响与土壤微生物的相似,施氮对土壤线虫的总量也无显著影响,在施氮处理下食细菌类群线虫、食真菌类群线虫、植物寄生性类群线虫和捕食类群/杂食类群线虫都有不同程度的下降,说明施氮对不同的线虫类群都有一定程度的抑制作用,这可能是由于施氮处理影响了土壤理化性质和土壤环境,施氮引起土壤pH值的下降,土壤粒径的改变和土壤肥力的增加[25],改变土壤线虫的生长环境,限制其生长。但随施氮水平的增加,食细菌类群线虫、食真菌类群线虫和植物寄生类群线虫都有不同程度的波动增长,这可能与土壤微生群落和植物生长的改变有关。同时,施氮也显著降低了土壤线虫的均匀度,改变线虫的物种丰富度,说明施氮显著影响了线虫群落的稳定性,而在不同的施氮水平下线虫的通路指数均小于0.75,说明施氮处理不影响食微线虫的结构比例,土壤有机质分解途径以真菌通道为主。
3.2 在施氮条件下土壤线虫与微生物间的相互作用
本研究发现,在贝加尔针茅草原不同施氮水平下,食微线虫类群(食细菌类群线虫和食真菌类群线虫),捕食类群/杂食类群线虫和土壤中微生物群落的PLFA总量,细菌类群,真菌类群和细菌/真菌类群无显著的相关性,即土壤中微生物群落结构和数量的改变对土壤食微类群线虫和捕食类群/杂食类群线虫的群落数量无明显影响。而植物寄生类群线虫与土壤中的细菌群落,真菌/细菌呈显著正相关,与土壤中的真菌类群呈极显著正相关,说明土壤微生物与土壤植物寄生类群线虫之间有明显的相互促进的作用,且真菌群落与植物寄生类群线虫的相互作用更为明显。这可能是因为植物寄生类群对植物的侵染,为土壤中的微生物提供了更多的能量和营养来源[26],而且有研究表明土壤pH对土壤线虫的影响最大[27],所以食微类群线虫作为土壤线虫的优势类群,主要受环境酸碱性变化和土壤养分的影响,而捕 食 类 群 / 杂 食 类 群线虫一般以食微线虫或者植食类线虫为食物来源[28],所以与食微类群线虫的变化相似。
本研究发现 在不同的施氮水平下,土壤真菌群落与土壤线虫之间相关性大于土壤细菌群落,说明土壤真菌群落与土壤线虫之间的相互作用更强。通过对土壤微生物群落与土壤线虫的生态指标进行分析发现,土壤真菌/细菌和土壤真菌群落与土壤线虫的丰富度和均匀度呈显著正相关,而土壤真菌群落的影响大于细菌群落,说明土壤真菌群落的增加能促进土壤线虫物种丰富度的增加和线虫群落的稳定,而土壤真菌群落与土壤的结构指数呈极显著负相关,且结构指数均大于1,说明土壤真菌群落的增加抑制了土壤线虫结构指数的增长,植物受线虫感染增加即食物寄生类群线虫增多,这与前文土壤真菌群落与土壤植物寄生类群呈显著正相关的结果相一致。
4 结论
贝加尔针茅草原在长期施氮处理下,土壤微生物群落总量无显著变化,施氮对土壤真菌群落的影响大于对土壤细菌群落的影响。施氮改变了土壤线虫的群落结构,降低了土壤线虫的丰富度和稳定性。土壤中的真菌群落与土壤中植物寄生性类群线虫具有相互促进的作用,同时与土壤线虫的结构指数呈显著负相关,增加了植物受线虫感染的几率。但土壤微生物与食微类群线虫无明显的相关性。

