龙须菜hsp和gln基因克隆及其在不同品系发育过程中表达分析*
彭 冲,李晓东,隋正红,商二磊,刘昊昕
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
龙须菜(Gracilariopsislemaneiformis)隶属于江蓠科(Gracilariaceae)[1-3],是中国的一种重要的经济海藻,生产琼胶的重要原料[4]。龙须菜具有红藻门中典型的三世代型生活史,由四分孢子体世代、果孢子体世代和配子体世代组成[5]。龙须菜的生活史可以在实验室条件下完成,可以作为一种理想的遗传学研究材料[6]。王津果等将龙须菜的发育过程分成了4个阶段[7],龙须菜具体发育阶段的确认与划分,为其育性表现的研究奠定了基础。
热激蛋白(hot shock protein,hsp)是一类广泛分布于各类生物细胞内且高度保守的蛋白分子,在高温、干旱、过氧化、重金属等逆境下均能大量表达[8],主要通过参与蛋白合成、折叠、细胞定位及蛋白降解等多种生物功能来维持植物内环境的稳定[9],在植物抵御逆境及适应环境过程发挥重要作用[10],行使分子伴侣、应激防御和稳定细胞结构等功能,不仅受环境胁迫的诱导也参与细胞各项正常生理活动[11]。
在高等植物中,谷氨酰胺(glutamine,gln)合成酶是氮素代谢途径中的关键酶之一,它可以联合谷氨酸合成酶催化谷氨酸转化为谷氨酰胺[12]。有研究发现谷氨酰胺合成酶与生物育性相关。谷氨酰胺合成酶在盘基网柄菌孢子母细胞中的活性比在柄细胞中的活性高约4倍,为谷氨酰胺合成酶调节盘基网柄菌发育提供了证据[13]。谷氨酰胺合成酶在水稻花粉成熟过程中起到重要作用,抑制谷氨酰胺合成酶活性,会使水稻圆锥花序中的氨积累,而导致水稻不育[13]。
研究发现,鲁龙1号与龙须菜野生型之间的孢子放散数量并未出现显著差异,而981释放的孢子数量却是最少,比野生型孢子放散量少一到2个数量级,呈现显著差异[7]。本研究针对龙须菜981品系与鲁龙1号表现出不同的育性性状的这一现象,结合已完成981品系和鲁龙1号品系的不同发育阶段龙须菜的转录组测序工作,挑选出在不同发育阶段差异表达显著的2个基因(hsp和gln),通过测序分析和荧光定量PCR技术,从单个基因水平,对龙须菜981低育原因进行探究,为研究红藻发育调控提供了新的思路。
1 材料与方法
1.1 实验材料
龙须菜981品系和鲁龙1号品系的四分孢子体样品采集于青岛胶州湾养殖海区(36°08′N, 120°17′E)。将表面的附生生物、泥沙等肉眼可见的污染物冲洗干净后,挑选生长状态良好的藻株置于洁净灭菌的广口锥形瓶中,加入含有Pro培养基[14]的灭菌海水,置于22 ℃、盐度30、光照50 μmol·m-2·s-1、光暗周期12/12h L/D的条件下驯养1周,中间更换1次海水加入新的培养基。
实验室驯养1周后,将981和鲁龙1号样品置于最佳孢子放散条件下培养,即25 ℃、15 μmol·m-2·s-1、盐度35、光暗周期8/16~14/10 h L/D[15],培养过程中利用光学显微镜观察藻体表面,根据王津果等[7]划分的龙须菜不同发育阶段的特征判断样品藻体的发育阶段,用消毒的刀片分别对处于各发育阶段的龙须菜样品进行取样,每份样品约0.2 g,液氮中速冻后置于-80 ℃保存。
1.2 基因组DNA的提取及cDNA的制备
利用植物基因组DNA提取试剂盒(天根)对龙须菜样品基因组DNA进行提取。利用植物RNA提取试剂盒(OMEGA)对龙须菜样品进行总RNA的提取,利用核酸蛋白质检测仪测定提取RNA的浓度以及OD260/OD280,用琼脂糖凝胶电泳检测RNA的完整性。利用RNA反转录试剂盒(Takara),参照说明书将提取的RNA反转录成cDNA,置于-20 ℃条件下保存。
1.3 hsp和gln全基因序列与上游序列的获得及基因片段克隆
根据龙须菜全基因组Survey数据[16]和不同发育阶段的转录组数据中hsp和gln基因序列[17],使用Primer Premier 5.0软件设计2基因的全长扩增引物(-all)、上游序列扩增引物(-up)和荧光定量引物(-q),选择gapdh基因[18]和18s基因[19]作为荧光定量PCR的双内参基因(见表1)。

表1 本研究所用引物序列Table 1 The sequence of primers used in this study
PCR反应体系中含有10×PCR Buffer 2 μL,25 mmol/L的MgCl21.2 μL,2.5 mmol/L的dNTP 1.5 μL,10 μmol/L的正反向引物各1 μL,1 U的TaqDNA聚合酶和20 ng全基因组DNA模板。反应条件为:94 ℃预变性5 min,1个循环;94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸90 s(在基因片段克隆的扩增反应中设为45 s),30个循环;72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测。基因全长序列与上游序列的PCR产物送上海生工生物公司,用扩增引物进行双向测序。
已发现在龙须菜中18s和gapdh这2个基因表达恒定,因此在本研究用作参照基因,双参照基因相比单内参能够减小内参基因方面引起的误差,使结果更加准确。以双内参基因作为标准,对龙须菜2个品系不同阶段的样品进行归一化处理,就可以在不同的样品间对目标基因表达量进行比较分析。hsp、gln、18s、gapdh荧光定量引物扩增产物利用琼脂糖凝胶回收试剂盒(天根)进行目的条带回收。参照PMD18-T说明书,将回收的目的条带与PMD18-T载体连接,转化到感受态大肠杆菌DH5α菌株中,PCR检测显示阳性克隆的单菌落接种于LB培养基中培养6 h,然后利用质粒提取试剂盒(天根)提取菌液质粒,提取的质粒于-20 ℃中保存备用。
1.4 序列的生物信息学分析
用BioEdit v7.0软件[20]检查双向测序的结果,删除序列两端背景杂乱碱基,并利用MEGA6.0软件拼接得到基因全长序列和上游序列,然后分别与龙须菜转录组和全基因组Survey数据中基因所在的Scaffold片段进行比对,确定目的基因的存在及其序列信息。利用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)推测开放阅读框,结合MEGA6.0软件进行氨基酸序列翻译。蛋白质的分子量与等电点使用ProtParam tool(http://web.expasy.org/protparam/)进行预测;利用SignalP2.0(http://www.cbs.dtu.dk/services/SignalP-2.0/)分析蛋白信号肽;跨膜区通过TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)进行分析;利用SMART(http://smart.embl-heidelberg.de/)进行蛋白质功能结构域分析;将获得的hsp和gln氨基酸序列在NCBI上通过BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&BLAST_SPEC=&LINK_LOC=blasttab)进行同源性比对分析,下载其他物种的hsp和gln氨基酸序列分别与获得的氨基酸序列一起使用Clustal X软件进行多重比对分析,通过MEGA 6.0软件构建NJ系统进化树,用Bootstrap法对进化树进行评估,Bootstrap设置为1 000次重复。利用PantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对获得的hsp和gln基因的上游序列的启动子元件进行分析。
1.5 hsp和gln基因的表达分析
以1.3中提取的质粒为模板,按1∶10梯度用灭菌双蒸水进行稀释,共设8个梯度,每个梯度设置3个技术重复,分别以hsp-q、gln-q、18s-q、gapdh-q(见表1)为引物,进行荧光定量PCR反应,PCR体系中包含有10 μL的LightCycler 480 SYBR Green I Master,10 μmol/L的正反向引物各1 μL,1 μL模板,其余的用灭菌的ddH2O补足20 μL体系。在Roche LightCycler480实时定量PCR仪上进行实时荧光定量PCR反应,反应程序为:95 ℃ 5 min,1个循环;95 ℃ 10 s,60 ℃ 10 s,72 ℃10 s,45个循环;95 ℃5 s,65 ℃1 min,1个循环;40 ℃ 10 s,1个循环。根据得到的Ct值制作标准曲线,检测引物是否符合荧光定量PCR要求(扩增效率在95%~105%)。
以1.2中来自龙须菜981品系和鲁龙1号品系不同发育阶段的cDNA为模板,每份样品设置3个生物学重复,每个生物学重复设置3个技术重复,依照上述步骤分别进行hsp、gln、18s、gapdh的荧光定量PCR反应。反应结果采用2-ΔΔCT法进行计算[21],并利用SPSS软件采用t检验对数据结果进行差异显著性系统学分析(P),并利用Origin6.0软件对数据进行作图分析。
2 结果
2.1 hsp、gln基因的获得及氨基酸序列分析
hsp基因序列全长501 bp,编码166个氨基酸,分子量为19.05 kD,理论等电点为6.38。带负电的氨基酸残基(Asp + Glu)为23个,带正电的氨基酸残基(Arg + Lys)为21个,不存在信号肽和跨膜结构域。蛋白功能结构预测发现在49~164 aa处为HSP20结构域(见图1)。龙须菜Hsp的氨基酸序列与其它物种序列的比对如图1所示,龙须菜的Hsp序列与其它物种存在较大差异,与星球虫科Tetrasphaeraaustraliensis相似性为35%,与其他物种,如杉藻科的角叉菜(Chondruscrispus),酵母科的Schizosaccharomycesoctosporus、绿菌门的Chlorobibacterium、放线菌目的Phycicoccussp.、Friedmanniellaflava、Rhodococcussp.与Knoelliaaerolata,相似性范围为28%~34%。Hsp序列中共有8个保守位点,均处于HSP20结构域内。

(实线表示蛋白功能预测HSP20区;阴影部分为保守区域;相同氨基酸用“*”表示,相似氨基酸用“.”与“:”表示。Solid line indicated predicted protein function region of HSP 20;shade part was conserved region;identical amino acids indicated by “*”,and similar ones by “·” and “:”.Phycicoccussp.(WP_056923286.1);红球菌Rhodococcussp(WP_032374627.1);Tetrasphaeraaustraliensis(CCH71736.1);红球菌Rhodococcussp.(WP_057473142.1);Friedmanniellaflava(SEQ28565.1);红球菌Rhodococcussp.(WP_027494920.1);角叉菜Chondruscrispus_1(XP_005713022.1);Phycicoccussp.(WP_057378702.1);Tetrasphaeraaustraliensis(WP_048701086.1);角叉菜Chondruscrispus_2(XP_005710585.1);Gracialriopsislemaneiformis(本研究);红球菌Rhodococcussp.(WP_008711816.1);Knoelliaaerolata(WP_035937060.1);角叉菜Chondruscrispus_3(XP_005710590.1);八孢裂殖酵母Schizosaccharomycesoctosporus(XP_013018981.1);Chlorobibacterium(KXB97182.1))
图1 Hsp序列比对结果
Fig.1 The amino acid sequences alignment ofhspgene
gln基因序列全长1 209 bp,编码402个氨基酸,分子量为43.91 kD,理论等电点为5.57。带负电的氨基酸残基(Asp + Glu)为49个,带正电的氨基酸残基(Arg + Lys)为43个,不存在信号肽,存在2个跨膜区,分别为TMⅠ(位置1~18 aa,长度18 aa,方向为膜外向膜内)和TMⅡ(位置47~69 aa,长度23,方向为膜外向膜内)(见图2)。蛋白功能结构预测发现在29~41 aa的位置,存在一段长13 aa的低复杂性区域(Low complexity region,LCR)(见图2)。在65~144 aa位置为谷氨酰胺合成酶N结构域(见图2)。龙须菜与角叉菜(Chondruscrispus)的Gln序列相似性最高,为73%,与其他物种如红藻纲的Dixoniellagrisea、真红藻纲的细毛石花菜(Gelidiumcrinale)、温泉红藻纲的Galdieriasulphuraria、双子叶植物纲的胡萝卜(Daucuscarotasubsp.sativus)、酸枣(Ziziphusjujube)、可可(Theobromacacao)、芝麻(Sesamumindicum)、苎麻(Boehmerianivea)、麻疯树(Jatrophacurcas)、杨树(Populustrichocarpa)和PopulussimoniixPopulusnigra,相似性范围为56%~69%。将龙须菜的Gln序列与其它物种的序列进行比对,发现共有124个保守位点,有30个保守位点在谷氨酰胺合成酶N结构域中。龙须菜Gln的谷氨酰胺合成酶N结构域与红藻门的Dixoniellagrisea、Galdieriasulphuraria、细毛石花菜(Gelidiumcrinale)序列结构相近。龙须菜Gln中的TMⅠ、TMⅡ跨膜区、LCR为龙须菜中特有的序列区域。
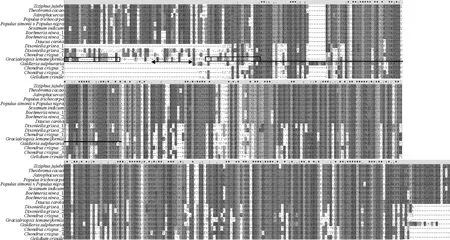
(实线框表示预测跨膜区,双箭头实线表示预测LCR区,实线表示预测的谷氨酰胺合成酶N结构域;阴影部分为保守区域;相同氨基酸用“*”表示,相似氨基酸用“.”与“:”表示。Solid frame indicated predicted trans-membrane region;solid double arrow indicated LCR region;solid line indicated predic ted N-terminal domain of glutamine synthase;shade part was conserved region;indentical amino acids indicated by “*”,and similar ones by “·” and “:”.杨树Populustrichocarpa(XP_002312733.1)、PopulussimoniixPopulusnigra(ALJ94030.1)、酸枣Ziziphusjujube(XP_015888259.1)、麻疯树Jatrophacurcas(XP_012069490.1)、苎麻Boehmerianivea_1(AJI44225.1)、苎麻Boehmerianivea_2(AJD14836.1)、芝麻Sesamumindicum(XP_011090823.1)、胡萝卜Daucuscarotasubsp.sativus(XP_017223067.1)、角叉菜Chondruscrispus_1(XP_005712206.1)、Galdieriasulphuraria(XP_005705248.1)、Dixoniellagrisea_1(ADX97446.1)、Dixoniellagrisea_2(ADX97445.1)、细毛石花菜Gelidiumcrinale(AAK60408.1)、角叉菜Chondruscrispus_2(XP_005717136.1)、角叉菜Chondruscrispus_3(XP_005717133.1))
图2 Gln序列比对结果
Fig.2 The amino acid sequences alignment ofglngene
2.2 氨基酸序列进化分析
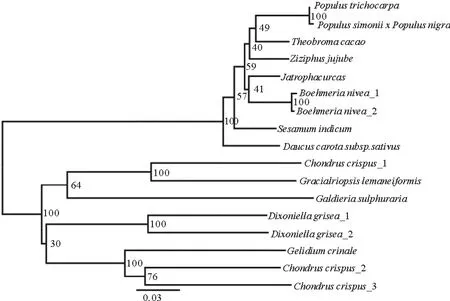
Hsp序列系统进化树见图3,整个NJ树的树形分为1个较大的类群和1个较小的类群,较小类群由角叉菜组成,龙须菜与红球菌、八孢裂殖酵母和其他细菌序列聚合成一支较大的类群。
Gln序列系统进化树见图4,进化树分为2个大类群,一大类群由双子叶植物纲的植物组成,一大类群由红藻门海藻组成,这与氨基酸序列对比的结果一致。龙须菜处于红藻门海藻的类群中,先与角叉菜聚为一支,然后与Galdieriasulphuraria聚为一支,最后与Dixoniellagrisea和角叉菜所在的分支聚为大枝。

(Phycicoccussp.1(WP_056923286.1)、Phycicoccussp.2(WP_057378702.1)、Knoelliaaerolata(WP_035937060.1)、Tetrasphaeraaustraliensis_1(CCH71736.1)、Tetrasphaeraaustraliensis_2(WP_048701086.1)、Friedmanniellaflava(SEQ28565.1)、红球菌Rhodococcussp.1(WP_008711816.1)、红球菌Rhodococcussp.2(WP_032374627.1)、红球菌Rhodococcussp.3(WP_057473142.1)、红球菌Rhodococcussp.4(WP_027494920.1)、八孢裂殖酵母Schizosaccharomycesoctosporus(XP_013018981.1)、Chlorobibacterium(KXB97182.1)、龙须菜Gracilariopsislemaneiformis(KY971285)(本实验)、角叉菜Chondruscrispus_2(XP_005710585.1)、角叉菜Chondruscrispus_1(XP_005713022.1)、角叉菜Chondruscrispus_3(XP_005710590.1))
图3 基于hsp氨基酸序列的NJ进化树
Fig.3 NJ tree based onhspamino acids
2.3 hsp、gln基因上游序列的启动子元件分析
测序获得hsp基因上游序列807 bp和gln基因上游序列951 bp分别进行启动子预测分析,hsp和gln基因上游部分的序列具有多个TATA-box、CAAT-box,hsp上游序列含有11处TATA-box,18处CAAT-box;gln上游序列含有14处TATA-box、11处CAAT-box。hsp和gln上游序列中除了基本的转录起始元件TATA-box、CAAT-box之外,还存在着许多应答元件如光响应元件、缺氧诱导的调控元件、茉莉酸甲酯反应调控元件和昼夜控制的调节元件(见图5、6和表2)。hsp上游序列还具有冷反应和脱水反应的调控元件(1个)、防御和应激反应中的作用元件(1个)、脱落酸反应作用元件(3个)和MYB结合位点(4个)。gln上游序列具有低温反应作用中的元件(2个)、热应激反应中的作用元件(1个)、水杨酸反应中的作用元件(1个)、生长素反应元件(1个)和与分生组织相关的调控元件(2个)。
(杨树Populustrichocarpa(XP_002312733.1)、PopulussimoniixPopulusnigra(ALJ94030.1)、可可Theobromacacao(XP_017975012.1)、酸枣Ziziphusjujube(XP_015888259.1)、麻疯树Jatrophacurcas(XP_012069490.1)、苎麻Boehmerianivea_1(AJI44225.1)、苎麻Boehmerianivea_2(AJD14836.1)、芝麻Sesamumindicum(XP_011090823.1)、胡萝卜Daucuscarotasubsp.sativus(XP_017223067.1)、角叉菜Chondruscrispus_1(XP_005712206.1)、龙须菜Gracilariopsislemaneiformis(KY971286)(本实验)、Galdieriasulphuraria(XP_005705248.1)、Dixoniellagrisea_1(ADX97446.1)、Dixoniellagrisea_2(ADX97445.1)、细毛石花菜Gelidiumcrinale(AAK60408.1)、角叉菜Chondruscrispus_2(XP_005717136.1)、角叉菜Chondruscrispus_3(XP_005717133.1))
图4 基于gln氨基酸序列的NJ进化树
Fig.4 NJ tree based onglnamino acids
2.4 龙须菜hsp、gln基因表达分析
根据hsp、gln、18s、gapdh基因的标准曲线,获得此4个基因的扩增效率分别为98.2%、100.4%、99.7%、101.0%,均接近100%且偏差在5%内,说明荧光定量引物合格可用。在龙须菜鲁龙1号和981品系的发育过程中,hsp基因表达水平的变化趋势相似(见图7),从Ⅰ~Ⅲ阶段,hsp基因表达水平呈缓慢上升状态,到Ⅳ阶段时表达水平出现骤然大幅升高(p<0.05);与981品系相比,鲁龙1号品系hsp基因相对表达量增加更多。gln基因在龙须菜鲁龙1号和981品系的发育过程中,表达水平的变化趋势也十分相似(见图8),从Ⅰ~Ⅱ阶段呈上升趋势,从Ⅱ阶段到Ⅳ阶段基因表达水平下降,到Ⅳ阶段使达到最低水平;鲁龙1号Ⅱ阶段到Ⅲ阶段的gln基因的相对表达量下降更多(p<0.05)。
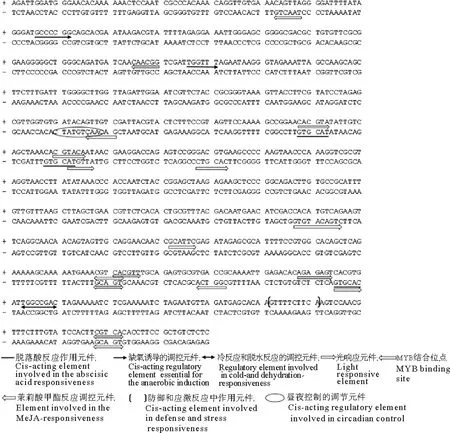
图5 hsp启动子部分序列分析Fig.5 Promoter analysis of hsp upstream sequence sequence
3 讨论
本实验克隆得到了龙须菜hsp和gln基因,经信号肽预测发现,两基因的蛋白均不存在信号肽,为非分泌型蛋白。Hsp氨基酸序列的49~164 aa分析为HSP20的功能结构域,此序列区与角叉菜最为相近。HSP20是热休克蛋白(HSP)家族中平均分子量为20 kD的蛋白,作为分子伴侣在高温下防止蛋白质发生变性和聚集[22- 23]。氨基酸序列比对发现Hsp序列在物种间存在较大差异,全长166 aa的氨基酸序列上,共有8个保守位点,均处于HSP20结构域内,说明该结构域对蛋白功能的重要意义。Hsp的NJ进化树分析发现,龙须菜的Hsp与杉藻科角叉菜的Hsp在进化中处于不同的进化分支上,而与放线菌、酵母、绿菌及星球虫科Tetrasphaeraaustraliensis的Hsp处于同一进化支中,发现Hsp在不同红藻中的起源存在不同。
Gln序列的65~144 aa处分析为谷氨酰胺合成酶N结构域,与谷氨酰胺合成酶的生物合成、酶活性相关,有助于谷氨酰胺合成酶结合底物[24]。跨膜区预测发现Gln序列含有两个跨膜区为(1~18 aa TMⅠ和47~69 aa TMⅡ),说明其为跨膜蛋白。蛋白功能结构预测发现29~41 aa为LCR。LCR是蛋白质片段中重复出现一种或少数几种氨基酸,氨基酸多样性比较低[25]。LCR与蛋白质稳定性相关,LCR在蛋白质表面的含量随蛋白质半衰期的增长而增多[26]。Gln序列比对结果发现,TMⅠ、TMⅡ跨膜区、LCR均为龙须菜中特有的序列区域,这些特有的序列结构可能是龙须菜在进化过程中产生的,使蛋白质具有独特的功能特征,如跨膜区可能使蛋白质具有附于膜上的能力。比对结果中还发现,双子叶植物纲的Gln序列结构相似,龙须菜的Gln序列与红藻的序列结构相似。这一结果与系统进化树的分析结果一致。系统进化树中将红藻的Gln与双子叶植物的Gln分为了2大类群,这说明红藻与双子叶植物的Gln在进化过程中产生了分歧,从而形成了2个进化支,龙须菜的Gln处于红藻Gln进化支中与角叉菜Gln相近的位置。

图6 gln启动子部分序列分析Fig.6 Promoter analysis of gln upstream sequence
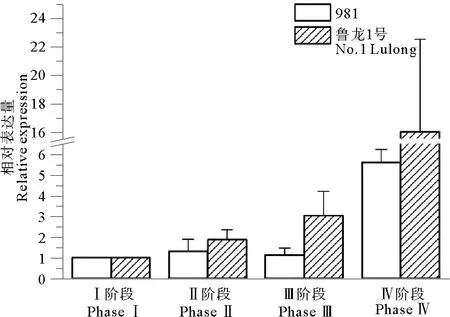
图7 龙须菜981和鲁龙1号不同发育阶段中hsp基因的相对表达量Fig.7 Relative analysis of hsp in different development stages of different Gp.lemaneiformis strains

表2 启动子区的调控元件分析Table 2 Cis-acting regulatory elements analysis of promoter sequences of hsp and gln
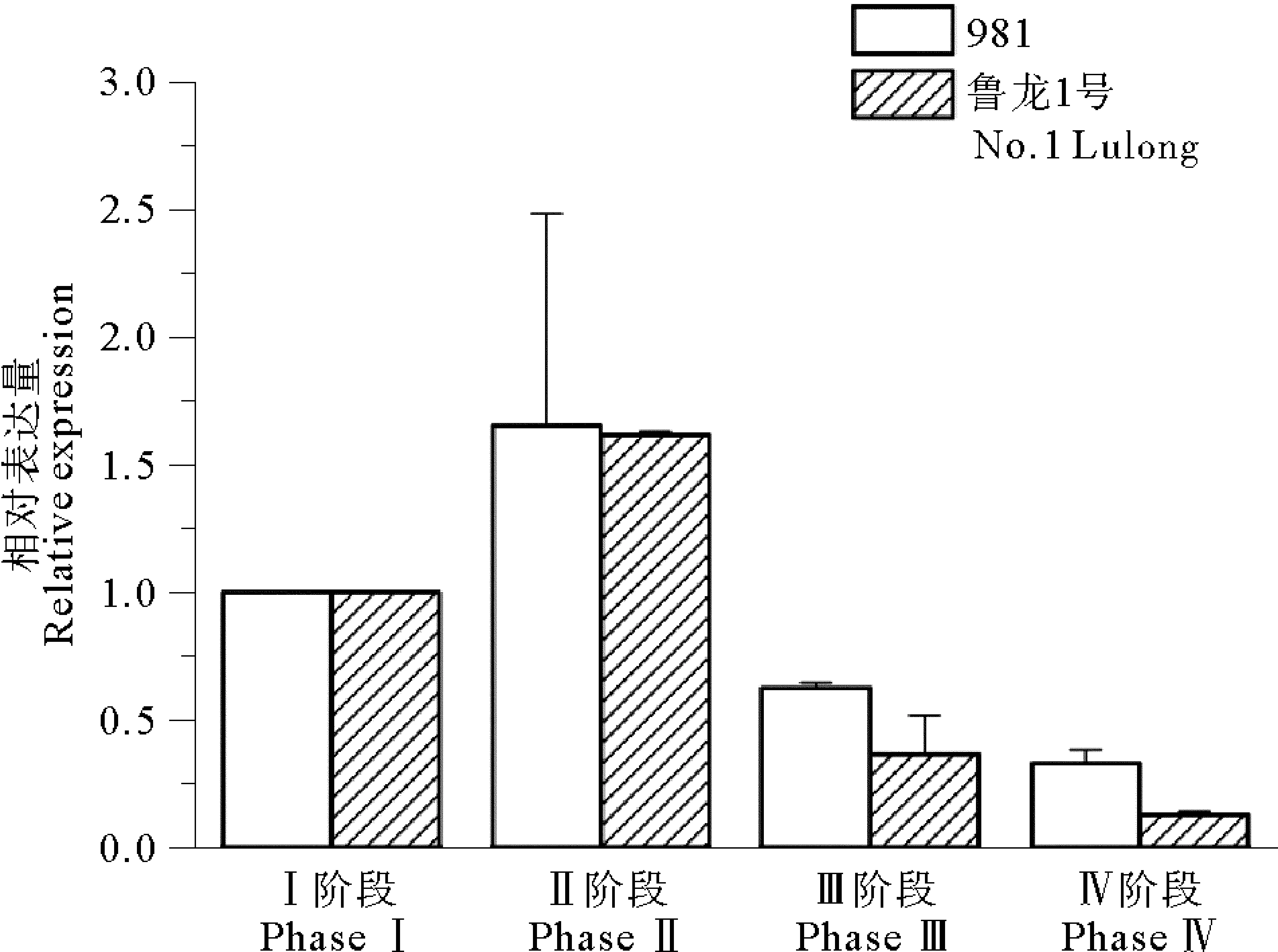
图8 龙须菜981和鲁龙1号不同发育阶段中gln基因的相对表达量Fig.8 Relative analysis of gln in different development stages of different Gp.lemaneiformis strains
植物启动子包括核心元件和一般上游元件,分析发现获得的gln和hsp基因上游均具有TATA-box和CAAT-box,这是绝大多数启动子正确启动转录所必需的。TATA-box一般位于转录起始位点前25~30 bp的区域内,是RNA聚合酶II结合位点,保证转录的精确起始,并调控上游激活蛋白[27]。CAAT-box主要分布在转录起始位点及其前面的150 bp范围内,主要控制着转录起始的频率,并增强转录,是启动子、增强子区域常见作用元件[28]。除了参与调控真核基因转录的基本元件,gln和hsp上游序列中还具有多种调节元件,2基因的表达均可能受光照、茉莉酸甲酯、厌氧和昼夜环境影响。植物激素对红藻生殖发育具有调控作用,如精胺具有促进蜈蚣藻果胞的成熟和释放的作用[29-30];乙烯能够促进翼枝菜的四分孢子囊成熟[31]。通过上游序列分析发现,gln基因表达可能受水杨酸、生长素的影响,而hsp基因的表达可能受MYB转录因子、脱落酸影响。有研究发现水杨酸、生长素、MYB、脱落酸转录因子均与植物生殖发育相关,如水杨酸可抑制小苍兰种球的生长、推迟花期、减少小花数目[32];生长素对花分生组织的形成、雄蕊花丝发育、雌蕊心皮边缘的轴向对称和胎座框的发育相关[33-34];MYB 转录因子与胚轴细胞伸长、转基因植株花瓣大小、花粉和花芽的发育等相关[35];脱落酸在植物的成花诱导、花芽分化及开花调控中也起着非常重要的作用[36],还参与多种果实发育的生理过程,如柿子(Diospyroskaki)[37]、柑橘(Citrusreticulata)[38]、樱桃(Prunusspecies)[39]、葡萄(Vitisvinifera)[40]、草莓(Fragaria×ananassa)[41]。在昆布属(Ecklonia)海藻的孢子中, 脱落酸(ABA)的含量随季节的变化而变化[42]。因此,推测这些因素可能通过调控gln与hsp基因的表达来影响龙须菜的育性表现,但这一推测仍需要进一步的研究。
基因表达水平检测研究发现hsp基因在龙须菜不同品系发育的前3个阶段处于缓慢升高的状态,到Ⅳ阶段上升幅度突然增大。研究发现,许多hsp家族成员参与生物体性成熟,如百合产生小孢子的减数分裂一期中,细胞核或染色体的变化可能有hsp70同源蛋白参与[43];酿酒酵母的减数分裂受启动子附近的热休克元件相互作用诱导[44];在番茄花粉发育早期的造孢组织、小孢子和绒毡层前体中检测到存在hsp70同源的mRNA和蛋白,hsp70同源蛋白储存在成熟的花粉粒中[45];兰州百合的hsp16.45可能帮助花粉母细胞和绒毡层细胞,在减数分裂的偶线期晚期到粗线期阶段对抗极端温度[46];hsp70同源蛋白mRNA的缺失可能是造成高粱细胞质雄性不育的重要原因[47];在玉米花粉发育过程中的减数分裂前期和减数分裂期,hsp81在胚中大量表达[48]。龙须菜发育的Ⅳ阶段特征为藻体表面四分孢子放散完毕,藻体便面出现大量孔洞,因此推测hsp在Ⅳ阶段表达量特异性升高可能与四分孢子放散完毕后,藻体表面形成的大量伤口的修复相关,但此推测还需进一步的实验验证。gln基因在龙须菜2个品系的发育过程中的Ⅱ阶段表达水平最高,Ⅳ阶段表达水平最低,Ⅰ阶段和Ⅲ阶段为变化的过渡阶段。有研究发现谷氨酰胺合成酶与生物育性相关。谷氨酰胺合成酶在盘基网柄菌孢子母细胞中的活性比在柄细胞中的活性高约4倍,为谷氨酰胺合成酶调节盘基网柄菌发育提供了证据[13];谷氨酰胺合成酶在水稻花粉成熟过程中起到重要作用,抑制谷氨酰胺合成酶活性,会使水稻圆锥花序中的氨积累,而导致水稻不育[13]等等。龙须菜在Ⅱ阶段形成大量的四分孢子囊,并伴有少量的四分孢子放散现象;在Ⅳ阶段孢子放散完毕,因此推测gln基因可能与龙须菜藻体表面大量四分孢子囊的形成相关。相比981品系,鲁龙1号品系中hsp和gln基因的变化趋势更加急剧,这可能与龙须菜两品系不同的育性表现相关,但这些推测均还需要后续研究工作继续探究。
致谢:特别感谢李晓东对本研究的贡献,完成了表达谱数据筛选及基因克隆工作。

