miR-25对缺氧/复氧诱导的H9c2细胞凋亡的作用
刘启方, 黄 晶▲, 徐 敏
(贵州省人民医院 1心内科, 2康复科, 贵州 贵阳 550002)
冠状动脉粥样硬化性心脏病(简称冠心病;coronary atherosclerotic heart disease,CHD)严重影响人类生命健康。近年来,冠心病的治疗方案得到飞速的发展,其中冠状动脉内血运重建是其主要的治疗策略。然而,大量的研究证明缺血后的心肌重新恢复血流灌注同样会导致心肌损伤加重及心肌细胞凋亡。因此,阻止缺血再灌注导致的心肌损害和细胞凋亡对改善心脏功能,降低死亡率具有重要的意义。微小RNA(microRNA,miRNA,miR)是一类小的非编码RNA分子,依靠调控多个蛋白的表达对细胞产生巨大的影响,它们影响细胞的生长、分化和凋亡[1-3]。miR-25是miR-106b~25家族中的一个成员,在心血管疾病中,miR-25作为在心脏中相对高表达的miRNA,参与心脏重构和心力衰竭等许多病理生理的调节[4-6]。部分研究推测miR-25在心肌细胞中表达具有促进细胞增殖和抑制细胞凋亡的作用。H9c2心肌细胞是源来于胚胎期心脏组织的细胞,许多生物学活性与原代心肌细胞相似。本研究通过构建高表达miR-25的H9c2稳定细胞系,探讨miR-25的表达变化对缺氧/复氧(hypoxia/reoxygenation, H/R)诱导细胞凋亡的作用以及其作用机制。
材 料 和 方 法
1 材料
心肌细胞株H9c2来自于中国科学院上海细胞库;Annexin V-FITC/PI双染试剂盒购于上海吉凯生物公司;DMEM培养基和胎牛血清购自Gibco;RIPA裂解液(强)、Bradford蛋白浓度测定试剂盒和BCA 蛋白浓度检测试剂盒购自江苏碧云天生物有限公司; 抗cleaved capase-3、高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)和Bcl-2抗体购自Gibco;mRNA逆转录试剂盒购自Fermentas;pRNAT-U6.1/Neo vector购自GenScript。慢病毒载体由上海吉凯公司构建。
2 方法
2.1高表达miR-25 H9c2稳定细胞系的构建 实验分为5组:空白对照(control)组(未进行转染)、LV-control组(转染LV-control-miRNA micmic)、LV-miR-25组(转染LV-miR-25 mimic)、LV-anti-control组(转染LV-control-miRNA inhibitor)和LV-anti-miR-25组(转染LV-miR-25 inhibitor),转染后建立稳定细胞株。选取处于生长对数期的H9c2细胞作为转染对象,调节细胞悬液密度至1×108/L,取6孔培养板,每孔分别接种2 mL细胞悬液,培养24 h后进行慢病毒感染。向各转染组细胞悬液分别加入5 μL polybrene及慢病毒载体(LV-control-miRNA mimic、LV-miR-25 mimic、LV-anti-control-miRNA inhibitor和LV-anti-miR-25 inhibitor),MOI=100,用吸管吹打均匀后接种于6孔板,6 h后加入新鲜培养基,观察细胞生长,待细胞完全贴壁后,更换新鲜DMEM培养基。动态观察感染细胞生长密度,抗生素压力筛选于细胞生长至80%以上融合时进行。观察未感染的对照组细胞全部死亡,而感染组细胞生长状态良好,表示压力筛选成功。扩大培养各感染组阳性细胞。
2.2H9c2细胞缺氧/复氧损伤模型的建立 缺氧培养基的制备:取新鲜不含血清的DMEM培养液,制备前使用CO2和氮气的混合气体充分饱和DMEM培养基,饱和时间至少3 h 以上;复氧培养基制备:取含小牛血清的DMEM液,放置于37 ℃的常氧培养箱。按照Ekhterae等[7]构建缺氧/复氧模型的方法,取出正常条件下培养的H9c2细胞,加入混合气体饱和过的缺氧培养基,放入低氧培养箱(37 ℃、1% O2、5% CO2、94% N2、100% 湿度)中培养,构建缺氧模型;缺氧培养后,取出培养瓶,加入胰酶消化,1 000 r/min离心5 min;吸去上清液,加入复氧培养基,放置37 ℃的常氧培养箱(95%空气和5% CO2)中,继续培养心肌细胞,构建复氧模型。依据前期实验行H9c2细胞缺氧24 h 后复氧1 h,构建细胞凋亡模型。
2.3Real-time PCR检测miR-25和HMGB1 mRNA的表达 用TRIzol RNA提取试剂盒提取细胞总RNA,进行逆转录。miR-25 的逆转录引物为5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGC-ACTG-GATACGACTCAGACC-3’。miR-25的上游引物为 5’-ATCCAGTGCGTGT-CGTG-3’,下游引物为5’-TGCTCATTGCACTTGTCTC-3’。PCR的扩增条件为:95 ℃预变性1 min;95 ℃ 变性 10 s、60 ℃ 退火、延伸40 s,重复40个循环。HMGB1的上游引物序列为5’-TATGGCAAAAGCGGACAAGG-3’,下游引物序列为5’-CTTCGCAACATCACCAATGGA-3’。PCR扩增条件为:95 ℃ 5 min;94 ℃ 30 s、52 ℃ 30 s、72 ℃ 30 s,共35个循环。以2-ΔΔCt法计算miR-25 和HMGB1 mRNA的相对表达量。
2.4Western blot检测HMGB1、Bcl-2和cleaved caspase-3的蛋白表达水平 取待测细胞于EP管中,加入蛋白裂解液,离心沉淀提取全蛋白,Brad-ford 法测定蛋白浓度。行SDS-PAGE,半干法转移凝胶至PVDF 膜,5% BSA 慢摇4 h封闭膜,TTBS 洗膜后分别加入兔抗Bcl-2多克隆抗体、兔抗HMGB1单克隆抗体和兔抗cleaved caspase-3单克隆抗体,4 ℃过夜,加入羊抗兔 II 抗,慢摇2 h后进行ECL显色,X线胶片显影定影,将胶片进行扫描,用图像分析软件Imageproplus 6.0对图像进行灰度分析。
2.5流式细胞术检测细胞周期及细胞凋亡率 本研究应用Annexin V/PI双染法检测细胞调亡。将各组细胞以1×108/L接种于6孔板, 构建缺氧/复氧损伤模型,根据双染法试剂盒说明书进行操作:用0.25%的胰酶在细胞培养孔中进行细胞消化,待细胞收缩变成圆形时,用含10%FBS的高糖DMEM培养基终止消化。离心弃上清重悬细胞,加入10 mL Annexin V,室温孵育15 min。采用200目滤网过滤,上流式细胞仪分析。细胞周期检测分别用胰酶消化液消化并制成1×109/L的细胞悬液,离心弃上清。用PBS缓冲液洗2次,离心,弃上清。加入1 mL 70%预冷乙醇,吹打均匀,4 ℃固定过夜。PBS洗涤去乙醇,1 000 r/min 离心5 min,洗2遍。加入0.2 mL碘化丙啶,注意避光孵育30 min。采用流式细胞术检测细胞周期。
2.6双萤光素报告基因检测miR-25与HMGB1的靶向作用 从NCBI中下载人HMGB1-3’UTR序列(NM_002128.4),采用Primer 5.0软件进行引物设计。通过琼脂糖凝胶电泳将扩增条带分离,扩增条带分离后, 将纯化的扩增片段收回,克隆到psiCHECKTM-2 载体,构建HMGB1-3’UTR-psiCHECKTM-2与Mut-HMGB1-3’UTR-psiCHECKTM-2载体。将miR-25与质粒共转染细胞,转染前一天取24孔培养板,每孔接种2×104个细胞,用含10%小牛血清的高糖DMEM培养基继续培养,将脂质转染试剂与质粒及miR-25溶液混合,在37 ℃恒温培养箱中孵育5 h后,换新鲜的含血清DMEM培养基。细胞转染后2 d,收集细胞裂解液。加入预先配好的用于萤光素酶检测的工作液,采用生物发光检测仪读取背景值。
2.7稳定转染HMGB1-shRNA的H9c2细胞系的构建 转染HMGB1-shRNA抑制HMGB1的表达,将对数生长期的H9c2细胞接种于6孔板上,第2天待细胞生长达80%融合时进行转染。按照脂质体转染试剂Lipofectamine 2000试剂盒说明将shRNA-HMGB1和control-shRNA分别转染H9c2细胞,实验分空白对照组、shRNA-HMGB1组和control-shRNA组。转染6 h后更换培养液继续培养,于37 ℃、5%CO2培养箱孵育48~72 h。转染成功后行缺氧/复氧损伤处理,再检测HMGB1表达及细胞凋亡情况。
3 统计学处理
应用SPSS 13.0统计软件进行数据分析。所有的实验结果均应用均数±标准差(mean±SD)表示,多组数据的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 成功构建高表达miR-25的稳定细胞系
Real-time PCR检测各转染组H9c2细胞中miR-25的表达,结果显示,相比于对照组,LV-miR-25组 H9c2心肌细胞中miR-25的表达水平显著升高,LV-anti-miR-25组H9c2细胞中miR-25表达水平降低(P<0.01),表明miR-25高表达和低表达的稳定细胞株构建成功,见图1。

Figure 1. The relative expression of miR-25 detected by real-time PCR in the H9c2 stable cells with overexpression and silencing of miR-25. Mean±SD.n=6.**P<0.01vscontrol group.
图1miR-25在各组H9c2心肌细胞中的表达
2 高表达miR-25的H9c2细胞在缺氧/复氧条件下HMGB1表达降低
构建miR-25高表达的H9c2稳定细胞系后,建立缺氧/复氧损伤模型,分别收集不同转染组的细胞,用real-time PCR和Western blot法检测各组心肌细胞HMGB1的mRNA和蛋白表达,结果发现相比于对照组,高表达miR-25的H9c2细胞中HMGB1表达明显减少,转染LV-anti-miR25 inhibitor后HMGB1表达显著增加(P<0.01),可见miR-25的表达与HMGB1的mRNA表达在H9c2细胞中呈负相关,miR-25能够抑制心肌细胞HMGB1的蛋白表达,见图2、3。
3 高表达miR-25的H9c2细胞在缺氧/复氧条件下Bcl-2蛋白表达增加,cleaved caspase-3蛋白表达减少
Western blot结果显示,与control组及LV-control组相比,LV-miR-25组中Bcl-2的表达显著升高,而cleaved caspase-3的蛋白表达降低,提示细胞凋亡减少;LV-anti-miR-25组中cleaved caspase-3蛋白水平高于其它组,而Bcl-2明显降低,差异具有统计学意义(P<0.01),见图4。
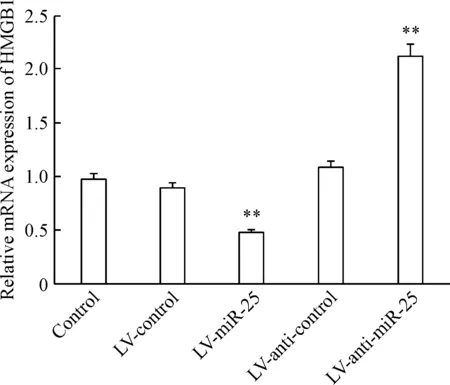
Figure 2. The relative mRNA expression of HMGB1 detected by real-time PCR in the H9c2 stable cells with overexpression or silencing of miR-25 under the condition of H/R. Mean±SD.n=6.**P<0.01vscontrol group.
图2Real-timePCR检测HMGB1mRNA在各组缺氧/复氧H9c2心肌细胞中的表达
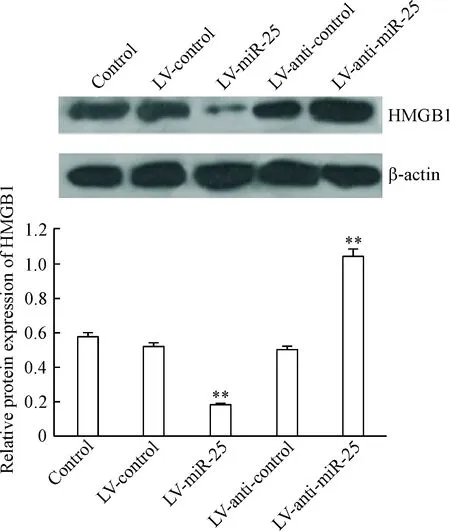
Figure 3. The protein expression of HMGB1 determined by Western blot in H/R-treated cells in each group. Mean±SD.n=6.**P<0.01vscontrol group.
图3Westernblot检测HMGB1蛋白在各组缺氧/复氧H9c2心肌细胞中的表达
4 流式细胞术检测细胞凋亡率及细胞周期变化
miR-25高表达稳定细胞系构建后,制作缺氧/复氧H9c2细胞模型,流式细胞术检测细胞凋亡情况,结果显示,与control组及LV-control组相比, LV-miR-25组的凋亡细胞明显减少,而LV-anti-miR-25组的凋亡细胞明显增多(P<0.05),见图5。
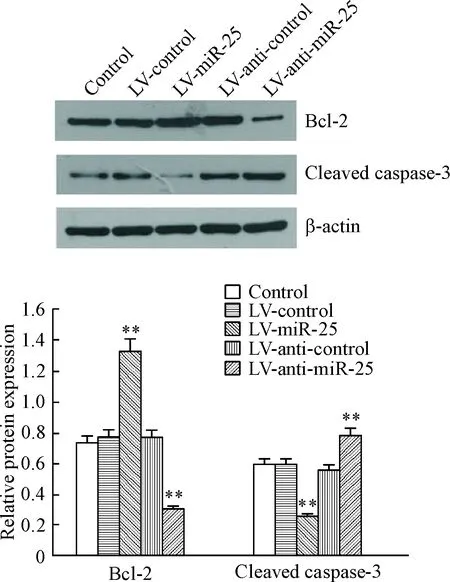
Figure 4. The levels of apoptosis-related proteins determined by Western blot. Mean±SD.n=6.**P<0.01vscontrol group.
图4Westernblot检测Bcl-2和cleavedcaspase-3在各组H9c2心肌细胞中的蛋白水平
流式细胞术检测细胞周期的结果显示,与对照组相比,LV-miR-25组的S期细胞明显增多,G1期减少; LV-anti-miR-25组的S期细胞减少,G1期增多(P<0.05),提示细胞周期受到阻滞,见图6。
5 双萤光素报告基因检测miR-25与HMGB1的靶向作用
用microRNA.org的Targets and Expression程序进行HMGB1的miRNA预测,发现miR-25与HMGB1存在潜在的靶向作用。通过分别转染 miR-25 mimic、miR-25 inhibitor、NC-miRNA 或 NC-miRNA inhibitor和HMGB1-3’UTR-psiCHECKTM-2(野生型)与Mut-HMGB1-3’UTR- psiCHECKTM-2(突变型)的萤光素酶报告基因载体进入H9c2细胞,测定萤光素酶活性的变化。结果显示,转染miR-25 mimic后,相对于空白对照组,携带有HMGB1野生型报告基因载体组的萤光素酶活性下降,而携带有HMGB1突变型报告基因载体组在转染miR-25mimic后萤光素酶活性没有明显变化,表明miR-25靶向调控HMGB1基因,见图7。

Figure 5. Analysis of apoptosis by flow cytometry in the H9c2 stable cell lines of each group. Mean±SD.n=6.*P<0.05vscontrol group.
图5流式细胞术检测转染后各组细胞的凋亡率变化
6 转染HMGB1-shRNA降低缺氧/复氧诱导的H9c2细胞凋亡
转染HMGB1-shRNA组的HMGB1表达明显降低,与对照组相比有统计学意义(P<0.01),见图8。对干扰HMGB1表达的稳定细胞系行缺氧/复氧损伤,发现转染HMGB1-shRNA组的细胞cleaved caspase-3蛋白水平显著降低,Bcl-2蛋白表达明显升高(P<0.05),见图9。细胞凋亡率检测显示,与control-shRNA相比,HMGB1-shRNA组晚期凋亡细胞聚集的右上区明显减少;正常细胞聚集的左下区增多,转染HMGB1-shRNA后,细胞的凋亡率与对照组相比明显降低(P<0.05),见图10。
讨 论
细胞凋亡可由内源性或外源因素所诱发,缺血和氧化应激均可导致细胞凋亡[8]。Gottlieb等[9]在离体兔心肌灌注模型中发现缺血30 min再灌注4 h后心肌细胞出现了典型的凋亡形态学改变,进一步研究证实再灌注损伤的心肌有大量的凋亡细胞,而单纯缺血的心肌细胞中未检测到细胞凋亡,据此他们推测细胞凋亡是缺血/再灌注损伤中特征之一,因此减少缺血再灌注损伤引起的细胞凋亡具有重要的意义。在缺血再灌注损伤的心肌中发现,细胞凋亡保护蛋白Bcl-2表达明显减低,凋亡蛋白caspase-3表达明显增加,提示心肌细胞凋亡增加。在心肌细胞高表达抗凋亡蛋白Bcl-2 和Bcl-xL,能减少缺血再灌注损伤后心肌细胞凋亡和梗死面积[10-12]。细胞凋亡与Bcl-2和caspase-3表达水平密切相关,检测Bcl-2和caspase-3能反应细胞凋亡的程度,本研究通过检测Bcl-2和caspase-3的表达水平间接反应细胞凋亡的程度。
本实验通过慢病毒构建高表达miR-25的稳定细胞系后,行缺氧/复氧处理,结果提示高表达miR-25的Bcl-2 蛋白表达增加,而cleaved caspase-3的蛋白水平减少,细胞凋亡率明显减少;细胞周期检测S期细胞明显增加。转染 miR-25抑制剂构建干扰miR-25的稳定细胞系组,得到相反的结果。由此推断miR-25对缺氧/复氧导致H9c2心肌细胞具有促进增殖,抑制凋亡的作用。Jeanine等[4]在研究急性冠脉综合征患者miRNA差异性表达时发现,急性冠脉综合征患者高表达miR-25,并推测其具有促进细胞增殖,防止细胞凋亡的功能,本研究得到的结果与其推测是一致的。
该研究同样发现通过构建高表达 miR-25的稳定细胞系后,行缺氧/复氧处理,高表达miR-25组的HMGB1表达显著降低。HMGB1作为炎症因子,广泛参与不同组织和细胞病理生理变化。Jan等[13]研究发现缺血再灌注损伤患者HMGB1表达增加,通过Toll样受体2引起细胞凋亡和坏死,抑制HMGB1的表达或给予HMGB1抑制剂(HMGB1 A盒)可以减少缺血再灌注引起的心肌细胞损伤,改善心脏功能;Andrassy等[14]同样发现HMGB1通过晚期糖基化终产物受体途径引起心肌细胞损害,抑制HMGB1的表达或给予HMGB1抑制剂可降低心肌细胞损害和心功能恶化。由此可见调控HMGB1的表达水平对减轻组织器官损伤具有重要意义。在组织细胞高表达miR-25下调HMGB1的表达水平,降低其与相关受体结合导致的炎症反应,最终达到减轻组织细胞的损伤,可能会成为一种新的治疗策略。

Figure 6. The cell cycle distribution of H9c2 stable cell lines analyzed by flow cytometry. Mean±SD.n=6.*P<0.05vscontrol group.
图6流式细胞术检测各组细胞周期的变化
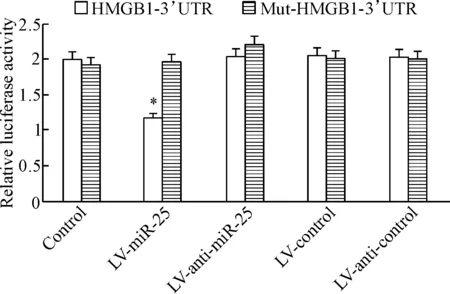
Figure 7. Dual-luciferase reporter assay confirmed thatHMGB1 was the target gene of miR-25.Mean±SD.n=8.*P<0.05vscontrol group.
图7双萤光素酶报告基因检测miR-25与HMGB1靶向关系

Figure 8. The protein expression of HMGB1 measured by Wes-tern blot in the H9c2 cells transfected with HMGB1-shRNA. Mean±SD.n=6.**P<0.01vscontrol-shRNA group.
图8Westernblot检测转染HMGB1-shRNA后HMGB1的表达

Figure 9. The levels of apoptosis-related proteins determined by Western blot. Mean±SD.n=8.*P<0.05vscontrol-shRNA group.
图9Westernblot检测Bcl-2和cleavedcaspase-3在各组缺氧/复氧H9c2心肌细胞中蛋白水平的变化

Figure 10. The apoptosis of the H9c2 stable cell lines with silencing ofHMGB1 expression under the condition of H/R analyzed by flow cytometry. Mean±SD.n=6.*P<0.05vscontrol-shRNA group.
图10流式细胞术检测转染后各组细胞凋亡率的变化
本研究证实了miR-25高表达具有降低细胞凋亡的作用,用生物信息学预测程序发现miR-25序列与HMGB1存在潜在的靶向作用,进一步采用双萤光素报告基因实验显示miR-25对HMGB1有靶向调控作用,提示miR-25可能通过下调HMGB1表达发挥其降低细胞凋亡的作用。本研究转染shRNA-HMGB1沉默HMGB1的表达,发现对该细胞进行缺氧/复氧处理,其 HMGB1表达降低,凋亡蛋白Bcl-2的表达显著升高,cleaved caspase-3的蛋白水平降低,细胞凋亡明显减少。由此可见,在H9c2细胞的HMGB1参与了细胞凋亡的调节,HMGB1表达降低减少了细胞凋亡。在缺氧/复氧诱导的心肌细胞损伤的过程中,miR-25高表达抑制了HMGB1的表达,而HMGB1表达减低能减少心肌H9c2细胞凋亡。因此我们推断miR-25可经HMGB1途径参与心肌H9c2细胞凋亡。
然而,由于miRNA的调控是一个复杂网络系统,一个miRNA可以调控多个靶基因,同时不同的miRNA可以作用同一个基因。Vergoulis等[15]通过基因测序技术推测,细胞周期蛋白依赖性激酶抑制物1C(cyclin-dependent kinase inhibitor 1C,CDKN1C)基因可能是miR-25调控的靶基因之一。Ward等[4]推测miR-25抗急性冠脉综合征患者心肌细胞凋亡的功能是依靠调控CDKN1C表达,激活细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2, CDK2)实现的。尽管Ward等和Vergoulis等没有从实验中证实推测结果,但大量的研究发现miR-25可以靶向调控TRAIL死亡受体,抑癌基因FBXW7及CDKN1C等,从而参与细胞凋亡的调控[16]。本研究仅仅证实miR-25可经HMGB1途径调控心肌H9c2细胞凋亡,但未能从更多途径去探讨miR-25调控细胞凋亡的功能,应对此继续深入研究。

