白藜芦醇对糖尿病大鼠心功能障碍及酸性鞘磷脂酶-神经酰胺通路的影响*
刘耕科, 方伟进
(中南大学湘雅三医院药学部, 临床药理中心, 湖南 长沙 410013)
糖尿病易并发心血管疾病,特别是糖尿病心肌病(diabetic cardiomyopathy,DCM)是导致糖尿病患者死亡的重要原因之一。DCM可导致糖尿病患者心功能障碍及心肌细胞肥大、凋亡等重构病理变化[1-3],临床表现为心律失常、心绞痛和心力衰竭等[4]。目前,临床上尚无针对DCM的有效防治措施。大量研究表明,心肌线粒体功能障碍、心肌细胞代谢紊乱和钙稳态失调等可能与DCM的发生发展密切相关[5],但导致DCM的具体机制尚未阐明。神经酰胺(ceramide)是神经鞘磷脂的基本单位,同时也是重要脂质信号分子。研究发现,ceramide含量增加是导致胰岛素抵抗与肥胖的重要因素[6-7],通过减少ceramide水平可有效缓解高脂诱导的心脏脂毒性[8]。在体内,ceramide可由酸性鞘磷脂酶(acid sphingomyelinase,ASMase)水解神经鞘磷脂产生,目前已经证实,在糖尿病和炎症等慢性疾病中,ASMase表达及活性增强,ASMase被激活后可从溶酶体转位至细胞外膜,定位在富含鞘磷脂的膜区域,不断水解鞘磷脂,形成大量ceramide并向胞外释放。研究表明,ASMase-ceramide通路参与胰岛素抵抗和糖尿病等代谢性疾病以及心血管疾病等的发生发展过程[9],但其是否构成DCM的发生机制尚不清楚;此外,目前尚没有明确以ASMase-ceramide通路为靶点的干预措施。而本课题组前期研究发现,白藜芦醇(resveratrol,RSV)对糖尿病心脏发挥保护作用,但白藜芦醇对ASMase-ceramide通路的影响如何,是否与心脏保护作用有关,还需进一步证实。本研究通过建立2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠模型观察ASMase-ceramide通路的变化情况,然后给予白藜芦醇进行治疗,通过进一步检测心肌线粒体功能变化观察白藜芦醇的心血管保护作用是否与ASMase-ceramide通路有关。
材 料 和 方 法
1 动物
无特定病原体(specific pathogen free,SPF)级健康雄性Sprague-Dawley (SD)大鼠20只,6~8周龄,体重(150±20) g,由中南大学实验动物中心提供,合格证号为SYXK(湘)2015-0017。
2 主要试剂
链脲佐菌素(streptozotocin,STZ)和白藜芦醇购自Sigma;兔抗鼠过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor-γ co-activator-1α,PGC-1α)和GAPDH多克隆抗体购自Santa Cruz;兔抗鼠ASMase多克隆抗体购自Bioworld Technology;空腹血糖(fasting blood glucose,FBG)及血脂测定试剂盒[包括总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和甘油三酯(triglyceride,TG)试剂盒]购自浙江东瓯生物工程有限公司;RIPA裂解液、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒及ATP检测试剂盒均购自碧云天生物技术研究所;其余试剂均为国产分析纯。
3 主要方法
3.1糖尿病大鼠模型制备及分组 先将体重为(150±20) g的健康雄性SD大鼠用高脂饲料(猪油 10%、蛋黄粉10%、胆固醇1%、胆酸盐0.125%、基础饲料79%)饲养4周,然后一次性腹腔注射小剂量STZ(35 mg/kg),在 STZ 注射3 d后用临床常规尿糖试纸检测尿糖,尿糖为中-强阳性者再检测血糖,凡连续2次隔日测得随机血糖≥16 mmol/L 者认为糖尿病模型建立成功,血糖不符合要求的大鼠则被剔除。实验共分为4组:正常对照组(control组;先基础饲料喂养4周,然后一次性腹腔注射等容量的柠檬酸缓冲液作对照,再继续用基础饲料饲养12周);T2DM组(制备方法如上所述,血糖≥16 mmol/L 的大鼠继续高脂饲养12 周);T2DM+RSV组(血糖≥16 mmol/L 的大鼠继续高脂饲养12 周,同时灌胃给予白藜芦醇100 mg·kg-1·d-1治疗12周);RSV组(正常对照组大鼠灌胃给予相同剂量RSV处理12周),每周根据体重计算给药剂量。
3.2血糖和血脂水平测定 各组大鼠血脂含量(包括TC、TG和LDL-C)的测定均参照试剂盒的方法进行,采用比色法检测糖化血红蛋白,采用胆固醇氧化酶-过氧化物酶-4-氨基安替比林和酚法(CHOD-PAP法)检测TC,采用甘油磷酸氧化酶-过氧化物酶-4-氨基安替比林和酚法(GPO-PAP法)检测TG,采用磷钨酸镁沉淀法(PTA-Mg2+法)和聚乙烯硫酸沉淀法(PVS法)检测LDL。
3.3M-型超声心动图检测大鼠心脏心功能与结构变化 大鼠麻醉(腹腔注射10 %水合氯醛 0.3 mL/100 g)、脱毛、仰卧固定于鼠板上,运用 Vevo 2100 超声心动仪(VisualSonics Inc)30-MHz 小动物超声探头置于大鼠左侧胸前,2D 超声显示心脏沿二尖瓣口与心尖方向的左室长轴截面,在左心室乳头肌水平,应用 M 模式超声观察各组大鼠心脏形态和功能的情况,主要检测指标有:左室收缩末期内径(left ventri-cular internal dimension at end-systole,LVIDs)、左室舒张末期内径(left ventricular internal dimension at end-diastole,LVIDd)、短轴缩短率(fractional shortening,FS)和射血分数(ejection fraction,EF)等;以上参数均连续测量3次取其平均值。
3.4ATP含量测定 心肌组织中的ATP含量采用萤光素酶法测定:取各组大鼠心肌组织30 mg,剪碎,加入9倍体积RIPA裂解液,冰上间歇机械匀浆;4 ℃、12 000×g离心10 min,留上清,待用;再取50 μL ATP检测试剂,用ATP检测稀释液稀释100倍,制成ATP检测工作液,然后将组织上清液和ATP检测工作液以1∶1比例混合,使用多功能酶标仪读取荧光值。用标准品以相同方法做出标准曲线后,计算出各组大鼠心肌组织中ATP含量。
3.5神经酰胺含量测定 参考前期实验方法[10-11]检测心脏组织中ceramide含量。首先将2 mL甲醇分别加入神经酰胺标准品中,振荡混匀后使其彻底溶解,置于-20 ℃ 冰箱备用,使用时根据不同的浓度稀释。各个不同浓度的神经酰胺标准品溶液进样,并绘制各个浓度神经酰胺的标准曲线,计算线性回归方程和相关系数。
3.6油红O染色和天狼星红染色 从甲醛固定液中取出心脏,先依次放入70%~95%等不同浓度梯度的乙醇中脱水,经二甲笨透明30 min后开始浸蜡、包埋,最后进行切片,切片厚度为3 μm。切片经脱蜡至水后,分别参考相关文献[12-13]进行心脏组织油红O染色和天狼星红染色,观察心脏组织中脂肪堆积和心肌纤维化情况。
3.7心肌组织超氧化物歧化酶(superoxide dismutase,SOD)活性及丙二醛(malondialdehyde,MDA)含量测定 各组样本经相应处理后,用南京建成生物工程研究所提供的试剂盒检测SOD活性和MDA含量。
3.8Western blot检测心肌组织的蛋白表达 取大鼠心肌组织各30 mg,剪碎,加入9倍体积RIPA裂解液,冰上机械匀浆,4 ℃、12 000 r/min离心10 min,取上清测蛋白含量;每个样本取30 μg蛋白,经SDS-PAGE电泳分离蛋白,电转至PVDF膜上,脱脂奶粉室温封闭1 h,I抗4 ℃摇晃过夜,加辣根过氧化酶标记的II抗室温孵育2 h,最后进行ECL化学发光法显色,经凝胶成像系统(Bio-Rad)扫描后进行图像数据分析。
4 统计学处理
采用SPSS 19.0统计软件进行分析。数据用均数±标准误(mean±SEM)表示,采用单因素方差分析和Newman-Keuls检验比较组间差异,以P<0.05为差异有统计学意义。
结 果
1 白藜芦醇改善糖尿病大鼠心功能障碍
与control组比较,T2DM组大鼠空腹血糖、甘油三酯、胆固醇和低密度脂蛋白胆固醇等水平均显著升高(P<0.05),见表1。同时,颈动脉插管结果显示,T2DM组大鼠反映心功能的室内压最大上升与下降速率(dp/dtmax,dp/dtmin)显著降低(P<0.05),见表2; 此外,超声心动图结果也显示,与control组相比,T2DM组大鼠的心脏射血分数和短轴缩短率显著下降(P<0.05)、LVIDs和LVIDd明显增大(P<0.05),见图1。给予白藜芦醇治疗12周可显著降低T2DM组大鼠的空腹血糖、甘油三酯、胆固醇和低密度脂蛋白胆固醇水平(P<0.05),见表1;显著增加室内压最大上升与下降速率(P<0.05),见表2;显著升高射血分数和短轴缩短率(P<0.05)等,见图1。以上结果提示,糖尿病大鼠模型成功建立,且白藜芦醇可改善糖尿病大鼠糖、脂代谢紊乱及心功能障碍。
2 白藜芦醇抑制糖尿病大鼠心脏ASMase-cera-mide通路活化、减少脂肪堆积并改善心肌纤维化
本研究观察了各组大鼠心脏组织中脂肪堆积情况,结果显示T2DM组大鼠心脏组织中脂肪堆积较control组显著增多(P<0.05),并导致糖尿病大鼠出现显著心肌纤维化,见图 2A、B。通过进一步检测ASMase-ceramide通路变化情况发现,T2DM组大鼠心脏组织中ASMase蛋白表达及ceramide水平均较control组显著增加(P<0.05);给予白藜芦醇治疗12周可显著减少糖尿病心脏组织中脂肪堆积、显著降低ASMase蛋白表达及ceramide含量(P<0.05),并显著改善心肌纤维化程度,见图 2C、D。

表1 各组大鼠血糖和血脂变化情况
*P<0.05vscontrol group;#P<0.05vsT2DM group.
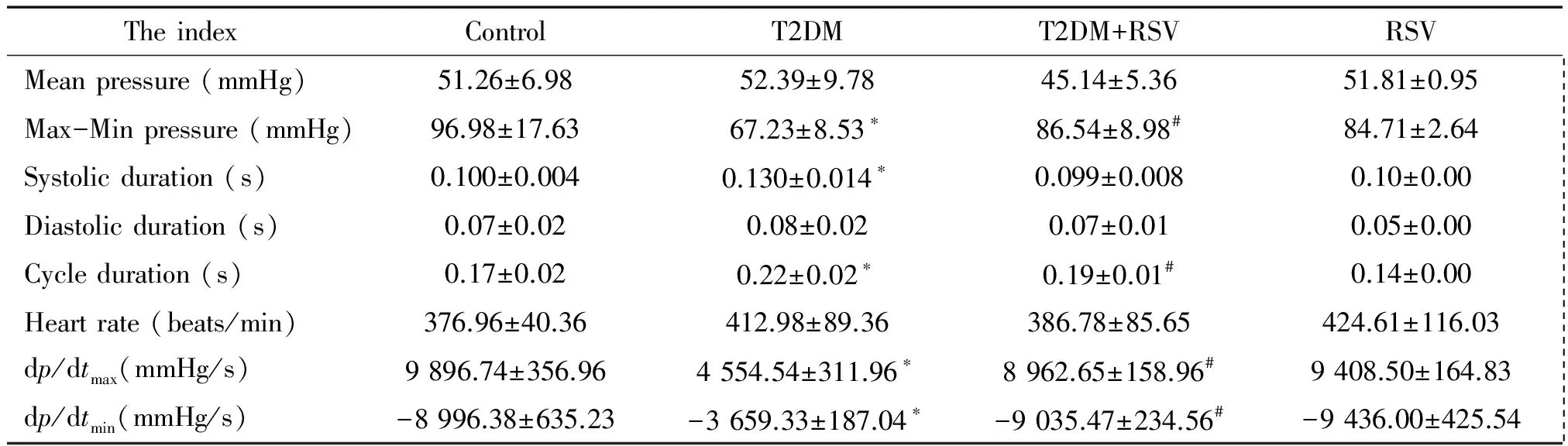
表2 各组大鼠血流动力学变化情况
*P<0.05vscontrol group;#P<0.05vsT2DM group.

Figure 1. Resveratrol ameliorated cardiac dysfunction in type 2 diabetic hearts. A: the representative images of left ventricular hemodynamic studies, which were performed by cannulation of the right carotid artery with a polyethylene Millar pressure catheter; B: transthoracic echocardiography in groups at 12 weeks; C: assessments of ejection fraction (EF), fraction shortening (FS), left ventricular internal dimension at systole (LVIDs) and left ventricular internal dimension at diastole (LVIDd). Mean±SEM.n=5.*P<0.05vscontrol group;#P<0.05vsT2DM group.
图1白藜芦醇改善糖尿病大鼠心功能障碍

Figure 2. Resveratrol ameliorated cardiac lipid accumulation and cardiac fibrosis in type 2 diabetic hearts. A: Oil red staining was performed to observe cardiac lipid accumulation (×200); B: Sirius red staining was performed to detect cardiac fibrosis (×200); C: the protein level of ASMase was detected by western blot; D: ceramide level was examined by high-perfor-mance liquid chromatography. Mean±SEM.n=5.*P<0.05vscontrol group;#P<0.05vsT2DM group.
图2白藜芦醇降低心脏组织中脂肪堆积、抑制ASMase-ceramide通路活化,并改善心肌纤维化
3 白藜芦醇改善糖尿病大鼠的心肌氧化应激和线粒体功能异常
与control组比较,T2DM组大鼠心脏组织中SOD活性显著降低、MDA水平显著升高(P<0.05),提示糖尿病心脏出现氧化应激。为了进一步观察对心肌线粒体功能的影响,本实验检测了各组大鼠心脏ATP含量及调控线粒体功能的重要转录因子PGC-1α的蛋白表达,结果发现T2DM组大鼠心肌的ATP含量明显减少、PGC-1α蛋白表达显著降低(P<0.05),见图 3C、3D;给予白藜芦醇治疗12周显著增加了糖尿病时降低的SOD活性、ATP含量以及PGC-1α蛋白表达,并降低了MDA的水平(P<0.05),见图3。

Figure 3. Resveratrol inhibited oxidative stress and improved mitochondrial dysfunction in diabetic rats. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05vsT2DM group.
图3白藜芦醇抑制糖尿病心脏氧化应激并改善心肌线粒体功能障碍
讨 论
自1972年首次报道DCM至今,大量的流行病学调查及相关基础和临床研究使人们对DCM的病理过程有了逐步清晰的认识,认为其主要与心肌胰岛素抵抗、心肌线粒体功能障碍和心肌细胞内钙稳态失调有关。但截止目前,关于DCM的致病因子及发病机制尚不十分清楚,同样缺乏有效的防治手段。白藜芦醇是一种多酚类化合物,广泛存在于花生、葡萄(红葡萄酒)、虎杖和桑椹等植物中,前期大量的研究已经证实,白藜芦醇可通过减轻炎症反应和氧化应激发挥心血管保护作用[14],白藜芦醇还可通过抑制ROS/ERK/TGF-β/periostin通路改善糖尿病心肌纤维化[15],通过激活PI3K/Akt/FoxO3a通路抑制心肌细胞凋亡,并可以上调PGC-1α蛋白表达或活性改善线粒体功能[16],从而阻断DCM的发生发展[17]。本研究发现给予白藜芦醇治疗12周不仅可显著改善糖尿病引起的大鼠糖、脂代谢紊乱,心功能障碍以及心肌纤维化等病理变化,而且显著减少2型糖尿病时心脏组织中脂肪的过度堆积。现已证实,正常成年人心脏所需的能量60%以上来自脂肪酸线粒体代谢,30%来自葡萄糖氧化。糖尿病时心肌胰岛素抵抗使胰岛素信号转导损害,以致其下游分子葡萄糖转运体4(glucose transporter 4,Glut4)不能活化转位至胞浆膜上,使心肌细胞对葡萄糖的摄取和利用减少;而脂肪酸转运体(FAT/CD36)表达及活性则上调,对脂肪酸摄取和利用增加[18],使糖尿病心肌能量代谢底物更加转向以脂肪酸代谢产能为主,这一方面增加心肌耗氧量,但ATP合成却没有增加,降低心脏做功效率;另一方面导致游离脂肪酸堆积、氧化应激,诱发脂毒性,并反过来进一步损伤胰岛素信号转导,同时破坏心肌生理性自噬,最终导致心脏结构与功能病理性改变。而本研究发现白藜芦醇在改善了DCM的同时,减少了心脏组织中脂肪堆积,提示白藜芦醇对DCM的保护作用可能与改善心肌脂毒性密切相关。
最新的前瞻性研究显示,血浆ceramide水平不仅与心血管疾病的发生率显著呈正相关[19],还是冠心病和急性冠脉综合征等患者死亡的重要预后因子,是不依赖于C反应蛋白和其它脂质分子,如低密度脂蛋白和胆固醇等的重要独立危险因素[20]。同时,ceramide还通过活化蛋白激酶Cζ诱导机体胰岛素抵抗及脂毒性[21]。同样地,ASMase作为ceramide的重要合成酶,也参与机体各种代谢性疾病及心血管疾病的发生过程[9]。有研究表明,敲除ASMase可活化AKT,增加肝脏对糖的摄取,改善糖耐量,并抑制高脂、高胆固醇饮食诱导的肝脏甘油三酯堆积。在缺血再灌注导致损伤的心肌组织中ceramide水平显著升高,使用ASMase抑制剂丙咪嗪可通过降低神经酰胺水平、减少心肌细胞凋亡改善心肌缺血再灌注损伤[9];这些研究都提示ASMase-ceramide通路对调节机体代谢紊乱及心血管疾病有重要作用。但ASMase-ceramide通路是否参与DCM的发生发展,以及是否与白藜芦醇对DCM的保护作用有关,尚不清楚。本实验发现在糖尿病大鼠心脏组织中ASMase的蛋白表达及ceramide含量较对照组显著增加,提示ASMase-ceramide通路参与DCM的发生过程,而给予白藜芦醇可显著降低糖尿病大鼠心脏组织中ASMase的蛋白表达及ceramide的含量并伴随心功能改善,表明ASMase-ceramide通路介导白藜芦醇对DCM的治疗作用。除此之外,本研究还发现,白藜芦醇在改善心肌脂毒性的同时,降低了糖尿病大鼠血糖水平,虽然未到正常水平,但仍提示白藜芦醇一定程度上改善了机体对胰岛素的敏感性,而这一效应正是伴随白藜芦醇显著降低ASMase的蛋白表达及ceramide含量产生的,再结合国外学者关于ASMase-ceramide通路介导胰岛素抵抗的结论,可以推测白藜芦醇改善胰岛素敏感性及降低血糖的效应与此有关。
根据以前研究结果,线粒体可能是ceramide介导糖尿病心肌病变的重要靶点[22],比如,高脂诱导的ceramide生成增多可导致心肌细胞氧化应激、线粒体功能障碍,甚至细胞死亡[23]。Ceramide还可以在线粒体外膜形成孔道,促进细胞色素C及相关促凋亡蛋白释放,并激活caspase 9,导致细胞死亡。本研究同样观察到,糖尿病大鼠心脏组织中出现氧化应激,表现为SOD活性降低,MDA水平升高;同时,心肌ATP含量明显减少,调控线粒体功能的重要转录因子PGC-1α蛋白表达显著降低,这些结果都提示线粒体功能障碍。而给予白藜芦醇后糖尿病大鼠的心肌线粒体功能得到明显改善,这也与本室以前的研究结果相一致[16]。Beaudoin等[24]也证实白藜芦醇可显著降低心肌细胞内脂质代谢产物堆积、抑制线粒体活性氧簇的生成,并改善心功能及心肌重构,然而,结合本实验结果,不难发现,白藜芦醇抑制氧化应激、减轻心肌脂毒性、改善心肌线粒体功能进而治疗DCM的效果可能与抑制ASMase-ceramide通路有密切关系。
综上所述,本研究发现白藜芦醇可显著改善糖尿病诱导的心功能障碍和心肌纤维化,且这种改善作用可能与其抑制ASMase-ceramide通路并改善心肌线粒体功能有关。

