Zacopride对血管紧张素Ⅱ诱发的心肌纤维化的影响*
张 研, 张海楠, 许 静, 吕艺蓁, 张 瑾, 彭 菁,李 盼, 乔 希, 刘清华, 4△
(山西医科大学 1病理生理教研室, 2第一临床医学院, 3公共卫生学院,4细胞生理学省部共建教育部重点实验室, 山西 太原 030001)
心脏成纤维细胞(cardiac fibroblasts,CFb)是心肌间质主要细胞成分,占心脏细胞总数70%,在维持心脏正常结构和功能方面起重要作用[1-2]。心脏成纤维细胞的增殖和胶原合成在心肌纤维化中具有至关重要的作用,是病理性心肌纤维化和心室重构的关键性调节因子[3]。在高血压性心脏病、缺血性心肌病、冠心病和心力衰竭等心血管疾病中心肌纤维化是心肌重构发生发展的重要机制之一[4]。除了积极治疗原发病,抗纤维化治疗也是不容忽视的重要策略。因此,揭示心室重构及心衰产生的分子机制,有效预防和逆转心肌纤维化,成为诸多心血管疾病的研究和防治的重要目标。
心室成纤维细胞增殖及间质纤维化可造成心室壁僵硬,顺应性降低,舒缩功能障碍。除此之外,心肌纤维化还可导致心脏电生理重构,诱导室性心律失常的发生[5]。既往关于电生理重构的研究大多集中在心肌细胞的离子通道[6],而对成纤维细胞离子通道在心肌纤维化的发生与发展中的作用了解甚少,有待进一步研究。心脏成纤维细胞没有电兴奋,但是它们能够极化静息膜电位(resting membrane potential,RMP)[7]。已知在人和大鼠心脏成纤维细胞膜上,表达广泛的离子通道[8-9],其中内向整流钾通道(inwardly rectifying potassuim channels,IK1,IKir)主要决定成纤维细胞静息膜电位。本课题组发现并报道了首个IK1选择性激动剂扎考必利(zacopride,Zac)[10],它可通过特异性增强大鼠心室肌IK1改善异丙肾上腺素诱发的心室重构[11]。此外,Zac不仅可以逆转心室肌肥厚,还可以拮抗心肌纤维化。Kir2.1是心脏成纤维细胞IK1通道的主要亚单位,我们已证明Zac激动IK1的有效靶点就是Kir2.1 的同源聚合体[12],提示Zac也可能通过改变心室成纤维细胞IK1而改变间质重构。本研究将在细胞水平模拟心肌纤维化,以血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)诱导心脏成纤维细胞活化和胶原表达模型为对象,观察Zac对成纤维细胞IK1通道表达及细胞活力和凋亡的影响,探讨Zac抑制心室间质纤维化可能的机制,从而为抗心室重构治疗寻找新的药物作用靶点。
材 料 和 方 法
1 动物
新生1~3 d的SD乳鼠,雌雄不限,购自山西医科大学实验动物中心,许可证号为SYXK(晋)2015-0001。
2 主要试剂
Zacopride和Ang Ⅱ 购自Tocris;氯喹(chloroquine,Chlo)、卡托普利(captopril,Cap)和小鼠抗Kir2.1单克隆抗体购自Sigma;兔抗GAPDH单克隆抗体购自Cell Signaling Technology;DMEM培养基、青霉素和链霉素购自HyClone;胎牛血清(fetal bovine serum,FBS)、胰蛋白酶和Ⅱ型胶原酶购自Gibco;其余均为国内生产分析纯产品。
3 主要方法
3.1乳鼠心室成纤维细胞原代培养 取20 只1~3 d新生乳鼠,用75% 乙醇浸泡消毒。在无菌条件下用弯剪剪开胸壁立即取出心脏,并放入冰冷的PBS液中,切取心室,初步洗去心室内的血液后,转移入EP管中,剪成(1~3) mm×1 mm×1 mm的碎块,静置5 min后,弃上清以去除红细胞。采用0.08% 胰酶和0.04%Ⅱ型胶原酶(现用现配,混合比例为1 ∶2),进行多次消化,每次37 ℃,消化6~8 min,吸取上层的细胞悬液,加入到50 mL离心管(预先加入25 mL含15% FBS的DMEM培养基)中,终止胰酶作用,重复消化直至组织块消化干净。收集的细胞悬液800 r/min离心10 min,重悬后200 目滤网过滤,所得细胞培养48 h以使成纤维细胞贴壁,弃去未贴壁的细胞,贴壁细胞继续在含15% FBS的DMEM培养液内培养,待细胞长满瓶底后,用0.25% 胰酶消化传代,实验取传代2~4代细胞。原代培养的成纤维细胞随机分成6组:正常对照(control)组、Ang Ⅱ(1 μmol/L)组、Ang Ⅱ+Zac (1 μmol/L)组、Ang Ⅱ+Zac+BaCl2(1 μmol/L)组、Ang Ⅱ+Zac+Chlo (0.3 μmol/L)组和Ang Ⅱ+Cap (10 μmol/L)组,各组细胞分别加药处理后,培养24 h,于显微镜下观察细胞形态。
3.2CCK-8法检测细胞活力 在96 孔板中配置100 μL的细胞悬液。将培养板在37 ℃、5% CO2条件的培养箱预培养24 h。按上述分组向培养板加入不同浓度的待测物质。将培养板在培养箱孵育24 h。向每孔加入10 μL CCK-8检测液,将培养板在敷箱中孵育2~4 h,用酶标仪测定在450 nm处的吸光度(A)值。
3.3ELISA法检测Ⅰ型胶原和Ⅲ型胶原含量 取第3 代CFb制成细胞悬液,以2.5×108/L的细胞浓度接种于24 孔板,每孔 1 mL。各因素处理后,分别在培养的 48 h后离心吸取细胞上清液按照ELISA 试剂盒说明检测Ⅰ型胶原和Ⅲ型胶原的含量。
3.4流式细胞术检测凋亡率 各组细胞加药培养24 h后,用0.25%胰蛋白酶(不含EDTA)消化细胞,收集细胞并制成1×108/L的细胞悬液,800 r/min离心10 min,弃上清液,PBS 洗涤样品细胞,过滤,离心,弃上清。根据AnnexinⅤ-FITC/PI双标记试剂盒说明加入染料,避光30 min,上机检测。
3.5Western blot 法检测蛋白的表达 提取各组心脏成纤维细胞在冰上加入裂解液,超声破碎细胞,利用Eppendorf进一步匀浆(12 000 r/min,30 min,4 ℃)。抽取上清液进行分装。用Bradford比色法测定蛋白浓度,计算上样量,配置12.5%分离胶和5 %浓缩胶上样后进行电泳,电泳结束后转移至PVDF 膜,室温封闭2 h后加入Ⅰ 抗(Kir2.1抗体稀释1.5 ∶1 000;GAPDH抗体稀释1 ∶5 000),4 ℃ 过夜。TBST清洗3次,每次10 min,后加辣根过氧化物酶标记的Ⅱ抗(1∶2 000),室温孵育1 h,再次清洗3次,每次10 min。化学增强发光试剂反应,压片曝光,放入显影液、定影液,结果采用ImageJ图像分析系统对条带进行处理分析。
4 统计学处理
数据以均数±标准误(mean±SEM)表示,采用SPSS 17. 0统计软件进行单因素方差分析,组间两两比较采用SNK-q法,以P<0.05为差异有统计学意义。
结 果
1 细胞形态学观察
在倒置显微镜下可见,与对照组相比,分离和培养的乳鼠心脏成纤维细胞,经1 μmol/L的Ang Ⅱ 孵育24 h后细胞显著增殖,生长密集,呈火焰状;Zac组细胞数量减少,表明Zac可抑制其增殖,并且与Ang Ⅱ+Cap组无明显差异;分别用IK1的相对特异性阻断剂BaCl2和Chlo均可以逆转其效应;表明Zac可显著降低Ang Ⅱ诱发的心脏成纤维细胞增殖,见图1。
2 Zac对心脏成纤维细胞活力的影响
CCK-8 比色法检测不同药物干预心脏成纤维细胞24 h 后各组细胞活力的变化。如图2 所示,心脏成纤维细胞给予Ang Ⅱ 处理24 h 后,与对照组相比A值显著增加,Zac处理后可显著抑制其上升,差异有统计学意义(P<0.05);用IK1阻断剂BaCl2和Chlo后,A值降低,说明Zac对Ang Ⅱ诱导的CFs 活力有抑制作用。
3 Zac对心脏成纤维细胞分泌Ⅰ型胶原和Ⅲ型胶原含量的影响
各处理因素作用24 h后,Ang Ⅱ模型组细胞Ⅰ 型胶原和Ⅲ型胶原含量明显高于对照组(P<0.05);Zac可抑制Ang Ⅱ 诱导的胶原合成增加(P<0.05);适当剂量氯喹和BaCl2选择性阻断IK1可消除Zac 的作用,见图3。

Figure 1. The effect of Zac on the morphological changes of the neonatal rat cardiac fibroblasts observed under microscope (×200).
图1Zac对乳鼠心脏成纤维细胞形态的影响
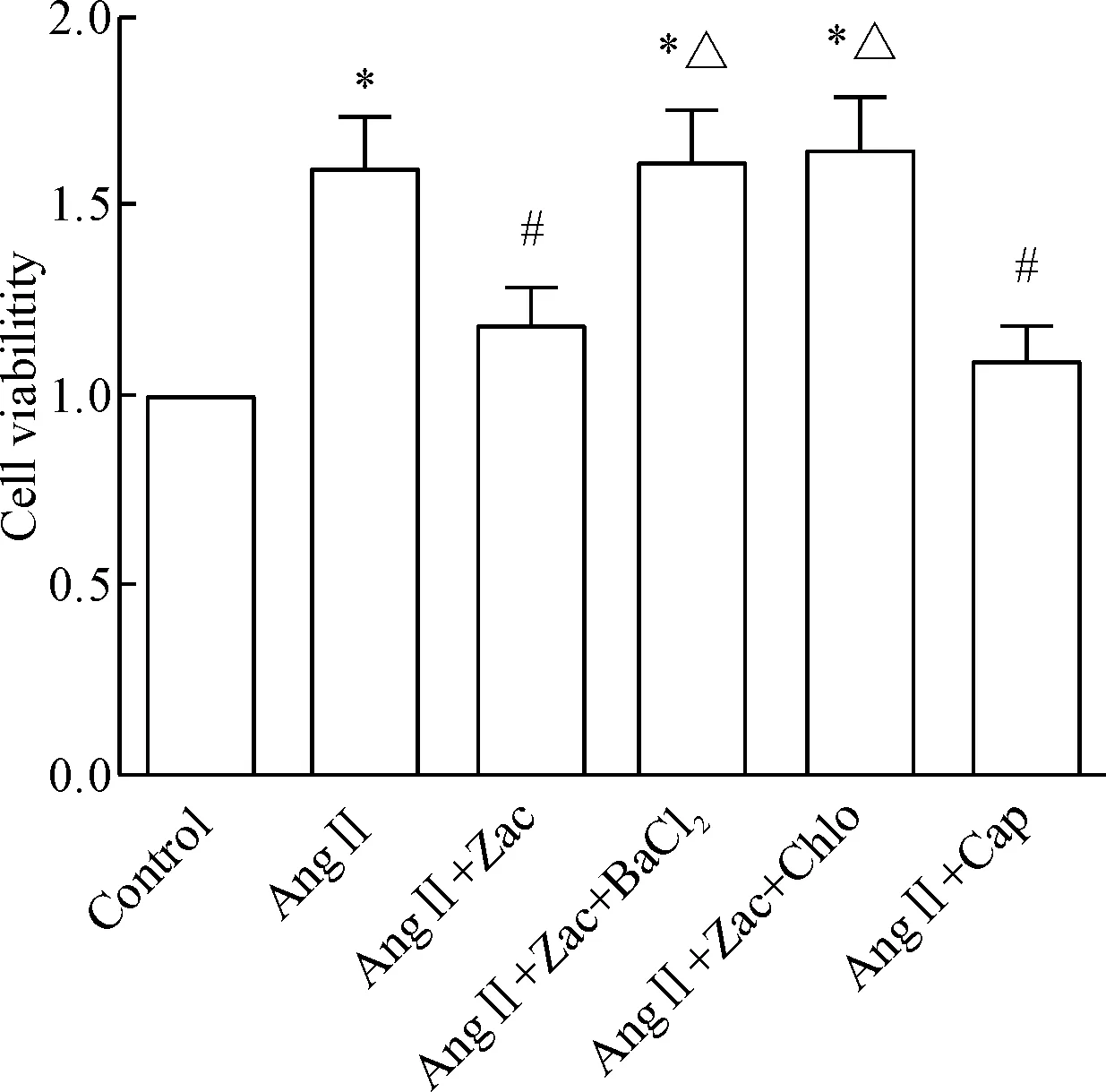
Figure 2. The changes of the viability of AngⅡ-treated cardiac fibroblasts detected by CCK-8 assay. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsAngⅡ group;△P<0.05vsAngⅡ+Zac group.
图2Zac对AngⅡ诱导的CFb活力的影响
4 Zac对心脏成纤维细胞凋亡的影响
乳鼠心肌成纤维细胞凋亡流式检测结果显示,与对照组和Ang Ⅱ组相比,Zac干预后明显增加成纤维细胞的凋亡(P<0.05);运用BaCl2和Chlo可阻断Zac的效应,说明Zac促成纤维细胞凋亡是通过特异性激动IK1介导的,促凋亡可能是其发挥抗心肌纤维化的重要机制,见图4。
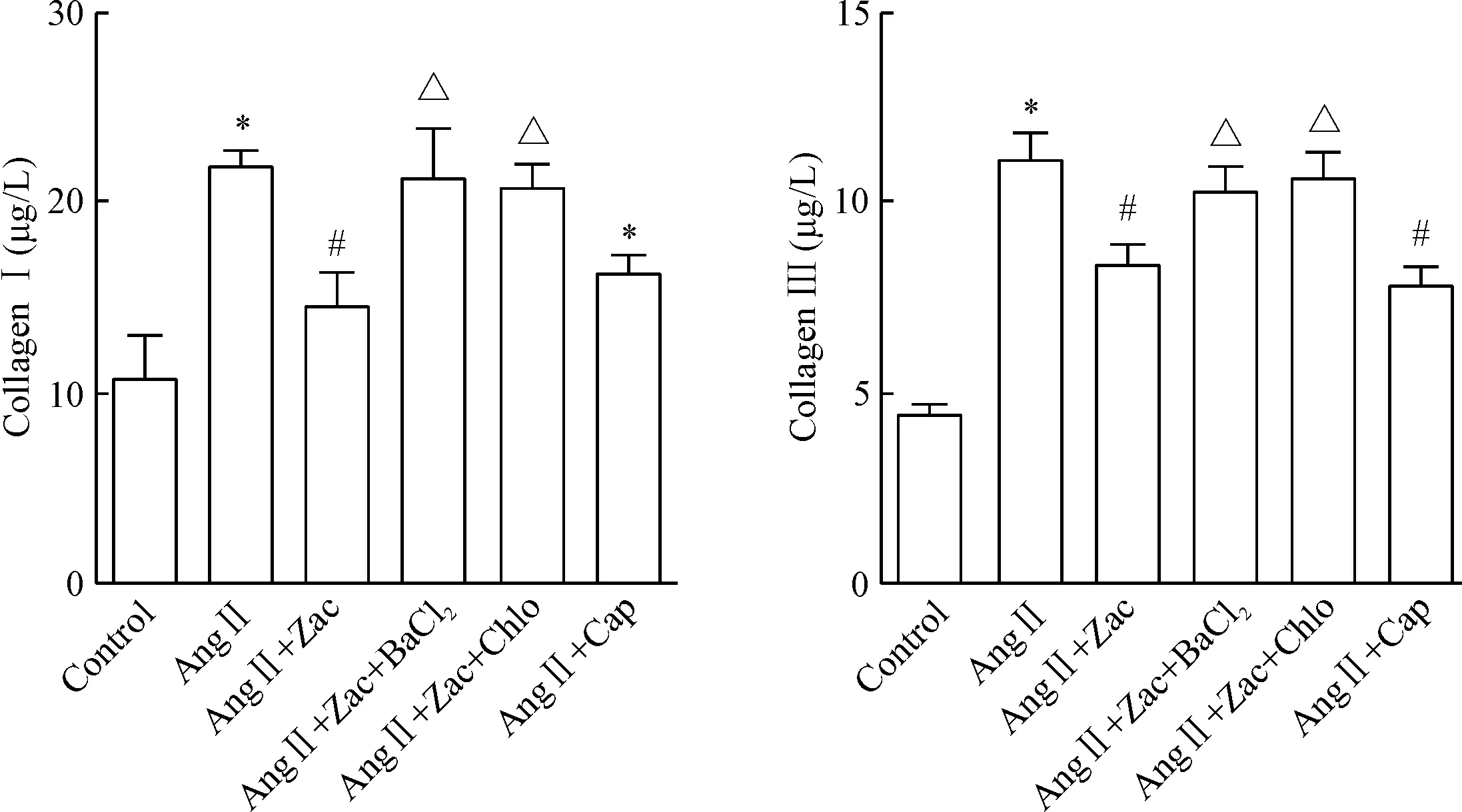
Figure 3. The effects of Zac on secretion of type Ⅰ collagen and type Ⅲ collagen in the cardiac fibroblasts. Mean±SEM.n=5.*P<0.05vscontrol group;#P<0.05vsAng Ⅱ group;△P<0.05vsAng Ⅱ+ Zac group.
图3Zac对AngⅡ诱导的心脏成纤维细胞胶原合成的影响
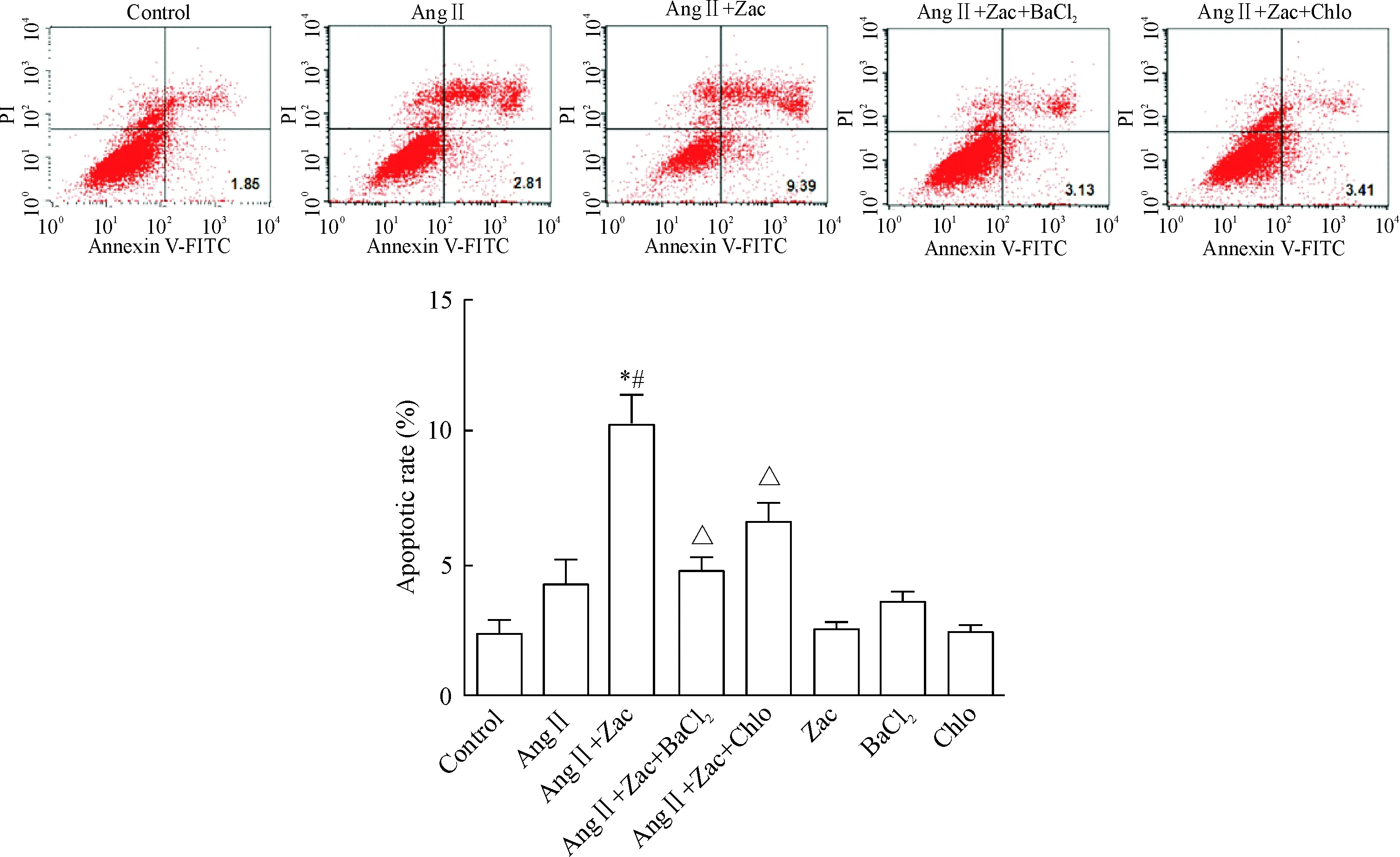
Figure 4. Zac promoted the apoptosis of cardiac fibroblasts in neonatal rats. Mean±SEM.n=5.*P<0.05vscontrol group;#P<0.05vsAng Ⅱ group;△P<0.05vsAngⅡ+Zac group.
图4Zac可促进乳鼠心脏成纤维细胞凋亡
5 Zac对Kir2.1通道蛋白表达的影响
如图5所示,血管紧张素Ⅱ可明显抑制Kir2.1表达,Zac干预后可使Kir2.1表达增加(P<0.05);BaCl2和Chlo可阻断Zac的上述效应,说明Zac抑制心肌纤维化可能是通过选择性激动IK1通道介导的。卡托普利并不能增强AngⅡ处理后成纤维细胞中Kir2.1表达,提示其抗纤维化效应不是通过IK1通道介导的。
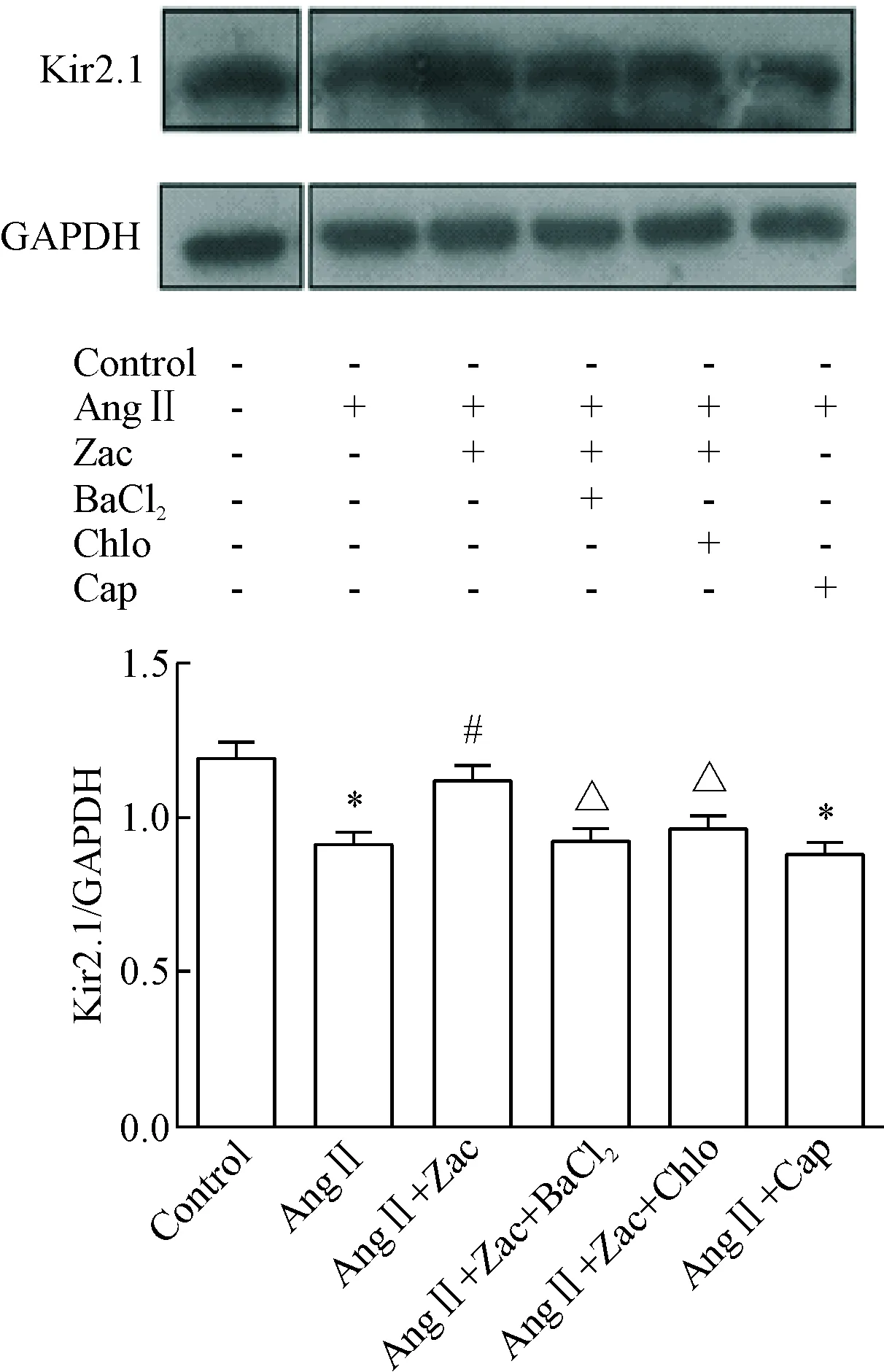
Figure 5. The effects of Zac on the protein expression of Kir2.1 in neonatal rat cardiac fibroblasts treated with Ang Ⅱ. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05vsAng Ⅱ group;△P<0.05 Ang Ⅱ+Zac group.
图5Zac对AngⅡ孵育乳鼠心脏成纤维细胞Kir2.1蛋白表达的影响
讨 论
心室重构不仅表现为心肌细胞的变化,同样还表现为间质细胞的变化。心肌间质主要是由成纤维细胞分泌的胶原纤维围绕着心肌细胞形成的胶原网络和散布其中的心肌间质细胞组成,对心肌细胞起着支架保护、连接固定、力学传导以及供给营养的作用[13]。纤维化是多种心脏病的共同特征,心脏成纤维细胞已经被证明对产生和调节纤维化有显著贡献[14]。心脏成纤维细胞过度增殖,将导致胶原蛋白过量积聚。生理状态下心肌胶原纤维如Ⅰ型、Ⅲ型胶原能确保相邻心肌细胞结构完整性,保障心肌细胞收缩并完成整体左室泵功能。心肌纤维化时主要表现为各型胶原比例失衡,胶原蛋白含量增加及其结构重排,进而影响心脏功能,最终导致心力哀竭的发生[15]。因此,维持心脏成纤维细胞正常比例与功能对保证心脏功能的正常进行具有重要作用。我们的研究发现,Zac可明显降低胶原的含量,抑制心肌成纤维细胞增殖,减轻纤维化。
血管紧张素Ⅱ是肾素-血管紧张素-醛固酮系统的主要作用因子之一,参与多种心脏疾病的病理发生过程,可诱导心肌细胞肥大和心肌间质纤维化,是调节心肌纤维化和心室重构的重要因素[16]。在各种心脏疾病过程中,Ang Ⅱ不仅刺激心肌细胞肥大、对心肌成纤维细胞增生及间质心肌纤维化也有作用,而后2种病理过程将增加非肌细胞间质的成分,造成心室壁僵硬,顺应性降低,舒缩功能障碍,最终引发心力衰竭[17]。同时局部Ang Ⅱ产生增加与心肌细胞凋亡和反应性间质性纤维化有关[18]。本研究中采用Ang Ⅱ孵育CFb 24 h,结果发现,Ang Ⅱ可以刺激CFb的细胞活力和胶原合成增加,促进心肌纤维化,并降低心脏成纤维细胞凋亡;同时应用Zac能够降低Ang Ⅱ诱发的CFb增殖和胶原合成,诱导凋亡,提示具有抗心肌纤维化作用。心脏成纤维细胞的电生理特性将影响其激发分泌耦合,成纤维细胞—肌细胞偶联以及成纤维细胞—成纤维细胞相互作用的能力。心肌细胞的静息膜电位通常约为-80 mV,但成纤维细胞具有更多的阳性静息膜电位。据报道,使用常规细胞内微电极记录,心脏成纤维细胞原位静息膜电位在-31~-16 mV之间[19]。然而对于哪些通道决定心脏成纤维细胞中的静息膜电位并不是完全了解。由Kir2.1(IK1的亚单位之一)编码的内向整流钾电流IK1可能有助于静息膜电位[19]。研究表明,在成年大鼠心室肌成纤维细胞和肌成纤维细胞中,Kir电流是RMP的主要决定因素[19]。有研究表明,通过操纵大鼠心室成纤维细胞中IK1电流振幅的静息膜电位的变化将影响肌成纤维细胞增殖;在狗快速起搏诱发的心力衰竭,心房成纤维细胞Kir2.1通道功能和表达上调,促进了成纤维细胞增生,进而形成心房重构和房颤的结构基础[20-21]。已知心衰时,心房肌细胞IK1上调是心房重构和致房颤的电生理学基础之一。这些结果说明心衰时心房成纤维细胞IK1与心房肌细胞具有相似的电生理学改变,都参与心房的电重构和结构重构,具有协同效应。与此相反,IK1下调是心衰时心室肌电重构的重要特征[22],激动IK1理论上具有抗心肌重构的作用。在本实验中,我们分离并培养乳鼠心室成纤维细胞,给予AngⅡ后可以下调Kir2.1,诱导成纤维细胞活力增加,经Zac干预能够上调Kir2.1,抑制其生长并诱导其凋亡。
综上所述,本研究建立AngⅡ致心肌纤维化和心室重构模型,利用IK1通道激动剂Zac和相对特异性IK1通道阻断剂氯喹与BaCl2,证明选择性激动IK1通道可能通过降低成纤维细胞的活力并诱导其凋亡而发挥抗心室重构效应,从而在细胞和分子水平为心室重构病理过程中心肌纤维化提供新的理论依据,也为防治和逆转心室重构开辟新的途径。

