水稻铵转运蛋白基因OsAMT1;2的启动子分析①
李素梅,施卫明
水稻铵转运蛋白基因的启动子分析①
李素梅1,施卫明2*
(1江苏省中国科学院植物研究所,南京 210014;2土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
AMT是介导植物铵态氮高亲和吸收的跨膜蛋白,已报道编码AMT蛋白的大部分基因的表达依赖外界氮水平和环境的调控,但调控的机制目前尚不清楚。水稻的基因在氮缺乏条件下强烈诱导表达,因此,本研究从水稻基因组DNA中PCR克隆基因上游1 940 bp的启动子序列,采用软件和试验分析启动子存在的顺式调控元件与外界氮调控的相关性。软件预测结果表明,启动子区域内除含有TATA-box和CAAT-box外,同时含有多种非生物胁迫、生物胁迫、激素响应和光响应相关的顺式作用元件,如Box-w1、MBS、MeJA、TATC和ERE应答元件。将启动子的5′端顺序删除获得5个不同缺失片段分别与GUS报告基因融合构成表达载体,通过农杆菌介导转入水稻成熟胚诱导的愈伤组织中获得转基因水稻,T1代植株水平上的GUS活性分析表明,最短启动子片段(–211 bp)能够启动GUS表达,但是GUS活性较低,对缺氮效应也不显著;中等长度启动子片段(–763 bp)的GUS活性提高,受缺氮诱导显著,且缺氮诱导不再随启动子长度增加而显著增强,说明应答氮响应的顺式作用元件位于–211 bp和–763 bp之间,非生物胁迫和激素相关的顺式作用元件多在这个区域内,是否与氮的调控存在相关性有待后续进一步证明。
铵转运蛋白AMT;启动子;顺式作用元件;GUS组织化学染色
一般说来在低温、淹渍及酸性土壤中,由于硝化作用被抑制,铵态氮成为植物的主要氮源。水稻是喜欢铵态氮的植物之一。植物根中铵态氮的高亲和吸收系统由跨膜蛋白AMT介导。拟南芥 AtAMT1;1是首个从植物中分离的铵转运蛋白[1],截至目前已经从拟南芥、水稻()、番茄()、百脉根()、油菜()、山杨(subsp.)、苜蓿()、绿藻()、小麦()、大豆()、高粱()等植物中分离到AMT蛋白,表明AMT蛋白广泛分布在单子叶和双子叶植物中,但是不同的植物中AMT蛋白基因数目不同。水稻中至少存在12个AMT蛋白[2-3],被分成5个不等数量的基因家族,的表达调控已经有很多研究报道[4-5],其中AMT1家族的3个基因的研究最为深入,包括异源体系的生物功能验证和基因的表达特征和调控。
早期的生理试验发现拟南芥根对铵态氮的吸收量与光照相关,到暗周期突然下降,而且吸收量与根中AMT的转录水平相关[6],暗周期期间补给蔗糖可提高AMT基因的转录水平[7],说明光周期影响AMT的表达。的表达也受到光周期的影响[8],同时在根部和地上部均有表达,但各自具有特异的组织表达特征,并专一性的受氮水平调控。(AF289477)是水稻AMT1家族中表达水平最高的基因,根中地上部均有同等表达,受低氮诱导表达[9];(AF289478)主要在根部表达,且低氮水平能强烈诱导其表达[5,10];(AF289479)主要在根中表达,低氮抑制其表达。研究也发现不仅受氮水平调控,随着幼苗的生长,它的表达水平也迅速提高以适应水稻的生长[10]。然而,AMT基因的表达调控机制尚不清楚。启动子是调控基因表达的重要顺式作用元件,在基因表达过程中起着重要作用,而受氮水平的表达调控比较显著。因此本研究从软件预测和启动子对报告基因GUS活性两方面研究启动子的顺式作用元件与氮调控的应答区域之间存在的可能关系,以期探索对水稻铵态氮吸收转运的顺式调控元件,为探明基因的表达调控机制奠定基础。
1 材料与方法
1.1 OsAMT1;2启动子区域序列分析
采用Plant CARE (http: //bioinformatics.psb.ugent. be/webtools /plantcare /html/)[11]对启动子顺式作用元件进行预测分析。
1.2 水稻受体材料、载体和菌株
以苗期水培条件下氮高效品种桂单4号为启动子克隆的基因组DNA来源,同时以含有2,4-D的培养基诱导灭菌的桂单4号成熟种子,分取3 ~ 4周培养后分化出的愈伤组织作为后续启动子融合GUS转化体系的受体材料。载有基因的pBI121作为表达载体,载体含有的p35S启动子与启动子序列进行替换。根癌农杆菌EHA101介导不同缺失启动子片段表达载体去转染诱导出的水稻愈伤组织,进行组织培养获得不同的转基因植株。
1.3 OsAMT1;2启动子克隆和不同长度片段表达载体构建
从NCBI(https://www.ncbi.nlm.nih.gov)中获得了所在基因组的序列,选取ATG前1 939 bp作为其启动子序列。根据启动子和pBI121载体的序列,利用Primer软件设计带有III和HI酶切位点的特异引物P1(ggcagcaagcaggtttagca)和P2(atagccaagtgtggcaaggt),以水稻桂单4号基因组DNA为模板进行PCR扩增。扩增条件为94℃预变性5 min,94℃变性30 s,58℃退火45 s,72℃延伸2 min,30个循环,72℃延伸10 min。PCR产物用10 g/kg琼脂糖凝胶电泳分离后,切胶回收目的片段,连入克隆载体pMD18进行测序。根据软件预测的顺式作用元件所在位置逐一删除部分启动子序列获得不同缺失片段的启动子,克隆到pBI121中替代p35S,构建不同缺失片段的启动子融合GUS的表达载体pAMTx。
1.4 转基因水稻的组织培养和分子检测
含有不同缺失片段启动子的表达载体分别转化农杆菌EHA101,筛选携带了表达载体的农杆菌与水稻愈伤组织共培养进行转染。与农杆菌共培养3 d的愈伤组织用无菌水洗去表面的菌体,在500 mg/L羧苄青霉素的选择压力下筛选培养转化子,分化的独立的新生T0株系分别用CTAB方法提取叶片中的基因组DNA,以基因组DNA为模板,设计T-DNA插入部分的GUS序列引物,以pBI121 质粒为阳性对照,未转化的桂单4号为阴性对照,进行PCR检测。PCR扩增程序为:94℃预变性5 min, 94℃ 45 s,52℃ 1 min,72℃2 min,30 个循环,72 ℃延伸10 min,预计所有的转基因植株和对照质粒均能够扩增出一个1.9 kb 的条带,扩增后取5 µL产物在10 g/kg的琼脂糖凝胶上进行电泳分析。
1.5 T1代转基因水稻植株不同氮水平的GUS活性组织染色和酶活分析
收获的不同缺失片段启动子的T1代水稻种子按照常规方式育种至根长2 cm时移植到尼龙网上,用改良的木村营养液(含0.5 mmol/L NH4NO3作为唯一氮源)进行培养,培养液pH 5.5、加硝化抑制剂二氰胺5.89 mg/L,每3 d更换一次营养液,置于植物生长室培养2周。2周后进行氮水平处理,一半以1 mmol/L NH4+-N为氮源,一半不加氮源,其他条件相同,培养3 d。取0.1 g根系提取可溶性蛋白按Jefferson等[12]的方法测定GUS酶活,同时取启动子最长片段的转基因水稻根系进行GUS染色分析。
2 结果与分析
2.1 OsAMT1;2启动子区域序列分析
起始密码子ATG上游1.9 kb的序列预测分析结果显示,启动子内除含有必需的核心元件CAAT-box和TATA-box外,还包含很多非生物和生物胁迫、激素以及光响应相关的元件(表1)。非生物胁迫相关调控元件包括厌氧诱导的ARE、干旱诱导的MBS和富含TC重复序列的胁迫响应顺式作用元件;生物胁迫相关调控元件包括真菌诱导的Box-W1、胚乳表达的GCN4和Skn-1、种子特异性调控的RY-element和生理周期调控的circadian;激素相关的调控元件包括茉莉酸甲酯调控的CGTCA和TGACG、乙烯响应的ERE、赤霉素响应的TATC box和玉米素代谢调节的O2-site;同时还发现了多个参与光响应的元件,G-box、GA、GATA、CATT、GT1、I-box、3-AF1、Box1、Box4、TCT、chs-CMA1a、chs-CMA3a和rbcs-CMA7a。通过对启动子的序列分析推测其可能是一个胁迫诱导型和光周期调控的启动子。
2.2 OsAMT1;2启动子克隆与不同长度序列启动GUS的表达载体构建
以桂单4号水稻基因组DNA为模板用特异性引物PCR扩增上游1.9 kb的启动子区域,所获得序列测序结果与Genbank进行比较分析,同源性达98%,确认是的启动子序列。结合预测的顺式调控元件将1.9 kb按不同长度删除获得5个启动子序列(图1A),克隆到表达载体pBI121中替换p35S(图1B),以此不同缺失片段的启动子分析报告基因GUS活性。
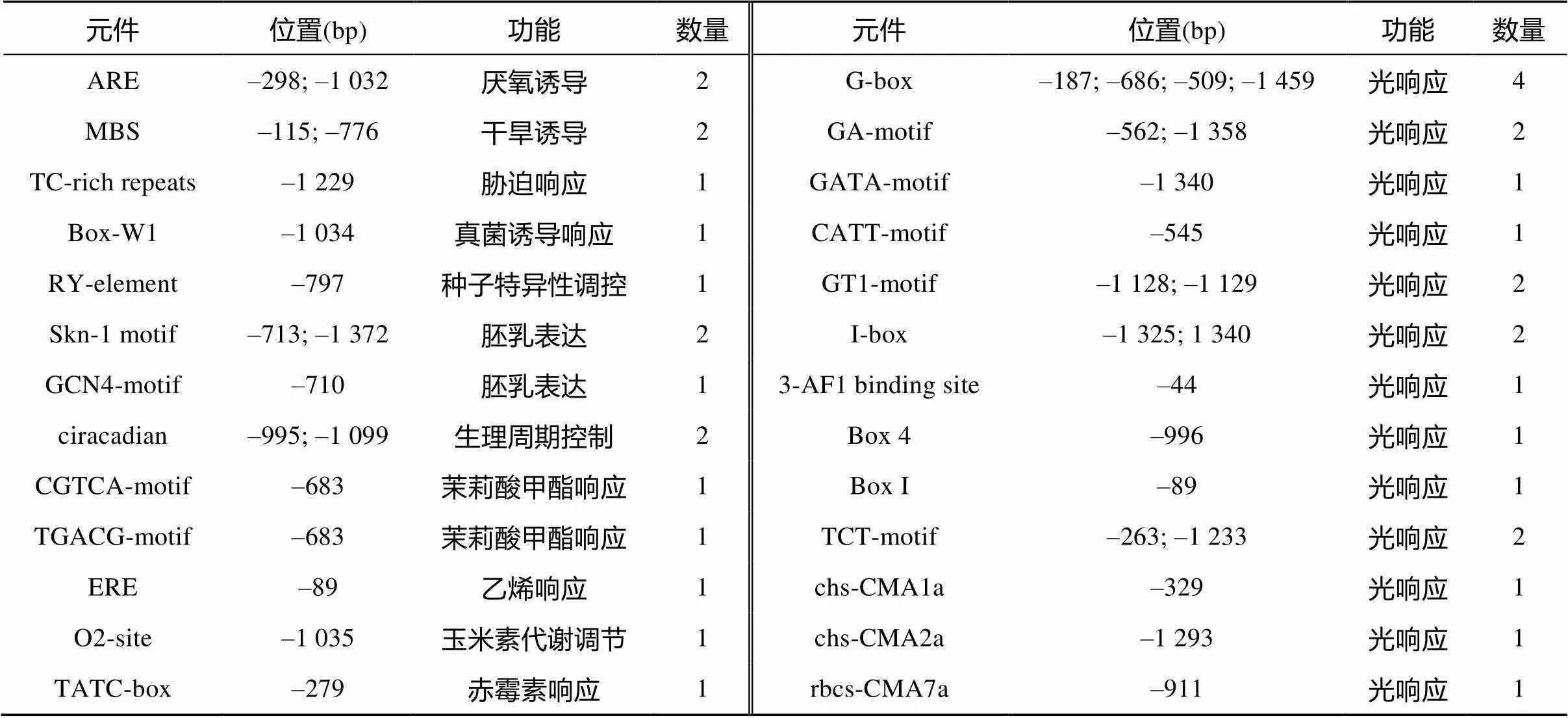
表1 水稻OsAMT1;2启动子区包含的顺式调控元件
2.3 表达载体的农杆菌转化及其验证
所有的pAMTx结构通过农杆菌EHA101介导转入诱导的水稻愈伤组织,组培过程中使用潮霉素进行多次筛选获得阳性愈伤组织,再分化和诱导培养至幼苗长出,取部分幼苗新叶提取基因组DNA进行PCR鉴定(图2),含有插入的片段的幼苗移植到土壤中,常规施肥管理至开花结果,收获T0代种子作为T1的幼苗供GUS活性和酶活分析,每个启动子结构片段至少保留3株独立的转基因株系。
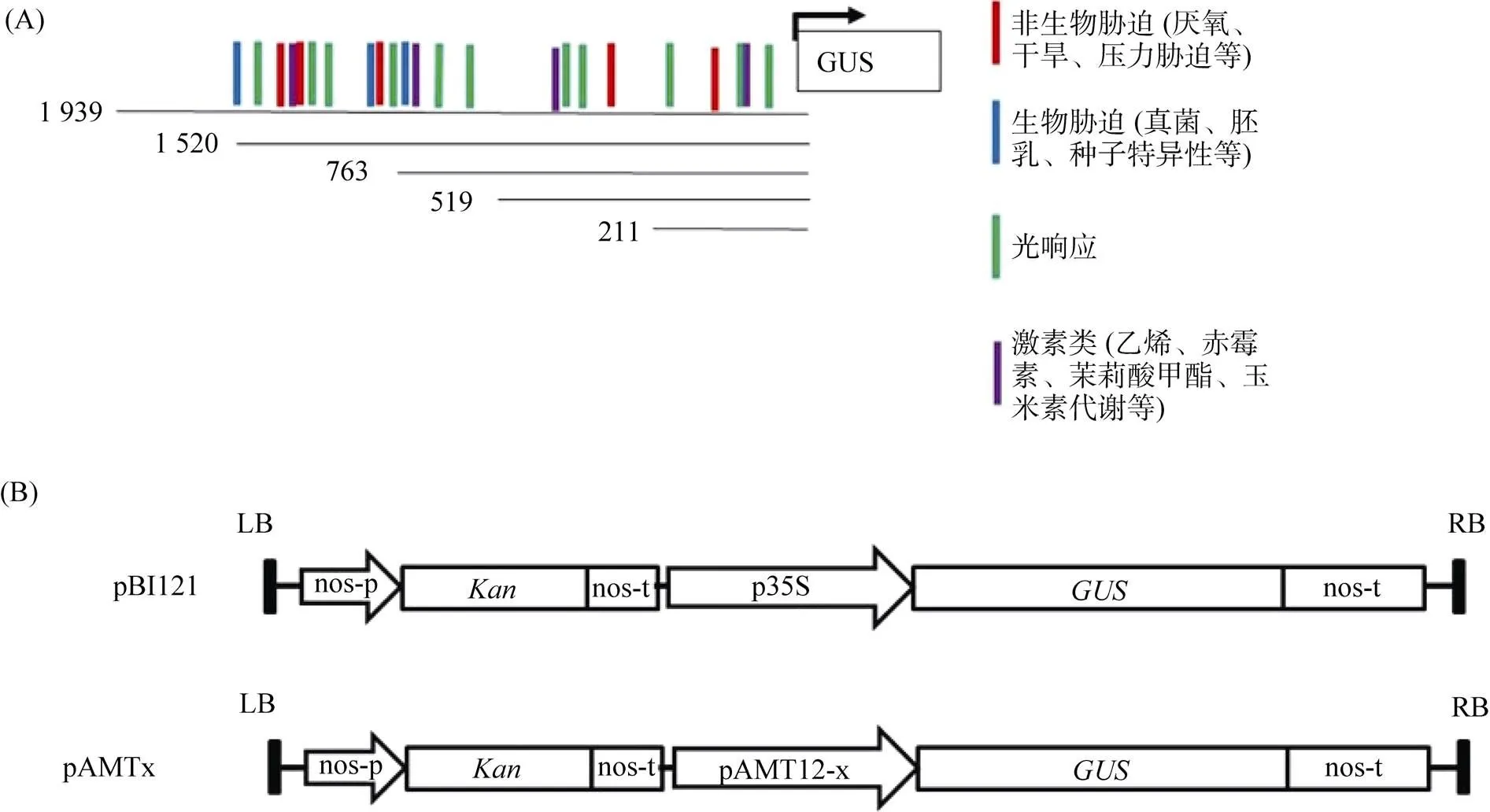
(A:不同长度的OsAMT1;2启动子序列,包含不同潜在的蛋白转录结合基序模块;B:pAMTx表达载体的T-DNA区结构图,其中,LB代表左边界序列,RB代表右边界序列,Kan代表卡那霉素筛选标记,GUS代表β葡萄糖醛酸酶,35S代表烟草花叶病毒35s启动子,nos-t代表胭脂氨酸合成酶终止子,x代表不同长度启动子。)

(图A中1~6、图B 中1~7为不同的转化株系;+ 阳性对照pBI121;–野生型植株基因组DNA)
2.4 转基因水稻株系的组织化学染色和酶活测定
构建的启动子表达载体转化获得的转基因株系,在缺氮处理培养下观察报告基因表达情况。最长启动子转基因水稻根系的GUS染色发现在有氮供应时,根系中报告基因在中柱表达,根尖未见表达(图3A),经缺氮处理后,报告基因的表达量显著上调,尤其新生根的根尖表达量迅速提高(图3B);纵向压片和横切片的结果与整根染色效果相同(图3C、D)。氮处理下的GUS酶活测定表明最短的启动子序列(–211 bp)可以启动GUS的表达,但是GUS活性较低,且受缺氮调控也不显著,当启动子长度达到–763 bp长度后启动的GUS酶活受到缺氮显著诱导表达,同时发现在763 ~ 1 939 bp范围内启动的GUS酶活没有显著差异(图4),也就是说–763 bp足够调控下游基因的表达。以上结果表明,启动子为缺氮诱导的特异型启动子。在正常条件下,启动子驱动下游基因集中在根系中柱表达,对铵态氮的吸收贡献很小;在缺氮条件下,启动子明显增强下游基因在皮层和根尖的表达量,从而增强植物对铵态氮的吸收。

(图A和C为对照,1 mmol/L NH4+-N培养的幼苗根系;图B和D缺氮处理培养3 d的幼苗根系)
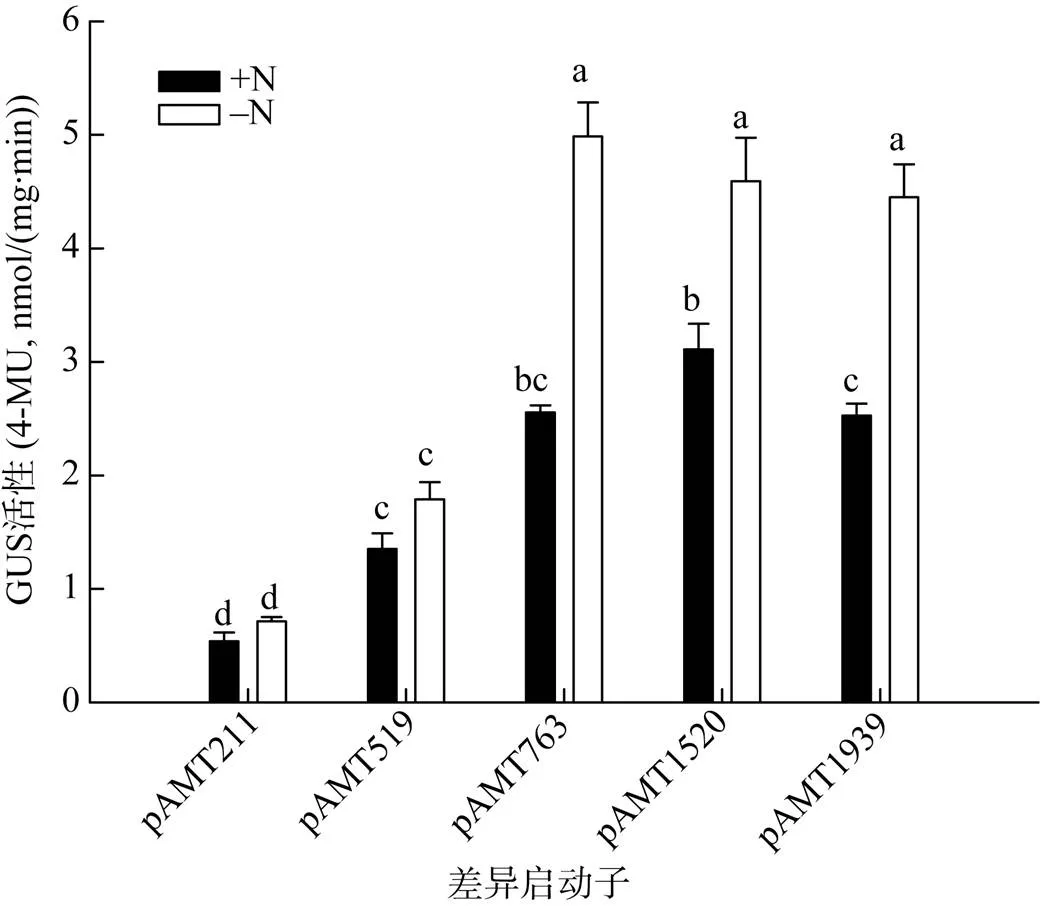
(图中不同小写字母表示处理间差异在P<0.05水平显著)
3 讨论
铵态氮是植物重要的氮素营养,过量吸收对细胞有毒害作用[13-14],因此铵态氮在根内的跨膜运输必须被精准控制[15-17],这个过程要求 AMT 的表达及转运活性在多个层面上被严格调控。外部铵态氮的有效性和植株体内氮素营养状况是影响 AMT 基因表达的主要因素[4,18],蔗糖、CO2浓度、光周期、菌根共生系统对其 mRNA 水平的转录调节也有影响[17]。在转录水平调控上,不同家族成员之间的表达调控模式也不尽相同,通过严谨的调控网络有效地调控铵态氮的吸收,以适应外界环境的变化和自身生长的需求。分析发现启动子的顺式作用元件中存在一些非生物和生物调控元件、激素相关以及光响应调控元件(表1),说明的表达调控可能与启动子中的这些顺式作用元件存在相关性。
氮素缺乏强烈诱导表达量的增加[10],启动的GUS 活性再次证明了的缺氮诱导效应(图4),且诱导效应自–763 bp 后不再随启动子的长度增加有显著地增加,而非生物胁迫和激素相关的顺式作用元件多分布在–211 bp和–763 bp区域内(图1),缺氮诱导可能与这些调控元件相关。因为根系适应缺氮或低氮条件会增加根系生物量以扩大吸收面积获取营养[18],茉莉酸甲酯调控的CGTCA和 TGACG、乙烯响应的 ERE 和赤霉素响应的 TATC-box 均是诱导细胞分裂生长的顺式调控元件,诱导根系加速生长抵抗对环境氮源不足的防御。其次根系的快速增生寻找养分与干旱条件下植物具有更加发达的根系以寻找水分的目的一致,这可能是启动子分别在–115 bp和–776 bp存在两个干旱诱导的MBS顺式作用元件的原因。AMT受光周期影响的报道很多,早前的研究发现光周期对AMT的调控是通过光合同化产物完成的[4],氧化磷酸戊糖代谢是糖信号控制AMT表达的可能途径[20],最新报道的的表达也受到光周期的调控[9],这与启动子中存在多个光响应的顺式作用元件相关。此外,菌根共生系统可以影响多种植物中家族基因的表达[21-25]。的启动子中也存在真菌诱导元件,或许也存在潜在的菌根共生的诱导表达作用。
AMT基因在mRNA水平的表达调控除了与上述因素有关外,还涉及到一些效应因子和转录因子,如激酶CIPK23与AtAMT1;1和AtAMT1;2相互作用抑制铵态氮的吸收[26],转录因子OsDOF18诱导AMT的表达调控根系铵态氮吸收[27]。AMT在蛋白水平上也进行有效的调控,拟南芥AtAMT1;3和AtAMT1;1的同源或异源多聚体的活性都受到C末端的调控[28],AMT蛋白C端磷酸化是AMT变构调节蛋白活性的机制,可以通过磷酸化直接调控AMT/Mep蛋白的转运活性[29]。
4 结论
通过软件预测和融合的报告基因GUS活性的结果表明,水稻铵转运蛋白启动子区域内除了含有TATA-box和CAAT-box外,同时含有多种非生物胁迫、生物胁迫、激素响应和光响应相关的顺式作用元件,如Box-w1、MBS、MeJA、TATC和ERE应答元件。启动子的不同缺失片段启动的GUS活性分析指出,–211 bp能够启动GUS表达,但是GUS活性较低,对缺氮效应也不显著,而–763 bp的GUS活性提高,且受缺氮诱导显著,同时发现自–763开始缺氮诱导不再随启动子长度增加而显著增强,说明应答氮响应的顺式作用元件位于–211 bp和–763 bp之间,可能与这个区域内存在的非生物胁迫和激素相关的顺式作用元件相关。
[1] Ninnemann O, Jauniaux J C, Frommer W B. Identification of a high affinity NH4+transporter from plants[J]. EMBO Journal, 1994, 13: 3464–3471
[2] Li B Z, Mike M, Li S M, et al. Molecular basis and regulation of ammonium transporter in rice[J]. Rice Science, 2009, 16: 314–322
[3] 邓若磊, 谷俊涛, 路丈静, 等. 水稻铵转运蛋白基因和的特征分析、功能和表达[J]. 中国农业科学, 2007, 40(11): 2395–2402
[4] 赵首萍, 赵学强, 施卫明. 不同铵硝比例对水稻铵吸收代谢基因表达的影响[J]. 土壤学报, 2006, 43(3): 436-442
[5] 曹玉, 李素梅, 施卫明, 等. 水稻吸铵基因和在不同生育期中的表达量差异及其在酵母细胞中吸铵功能初析[J]. 土壤, 2009, 41(4): 612-619
[6] Gazzarrini S, Lejay L, Gojon A, et al. Three functional transporters for constitutive, diurnally regulated, and starvation-induced uptake of ammonium into Arabidopsis roots[J]. Plant Cell, 1999, 11: 937–948
[7] Lejay L, Gansel X, Cerezo M, et al. Regulation of root ion transporters by photosynthesis: Functional importance and relation with hexokinase[J]. Plant Cell, 2003, 15: 2218–2232
[8] Kumar A, Silim S N, Okamoto M, et al. Differential expression of three members of the AMT1 gene family encoding putative high-affinity NH4+transporters in roots ofsubspecies indica[J]. Plant Cell and Environment, 2003, 26: 907–914
[9] Ranathunge K, El-Kereamy A, Gidda S, et al.transgenic rice plants with enhanced NH4+permeability show superior growth and higher yield under optimal and suboptimal NH4+conditions[J]. Journal of Experimental Botany, 2014, 65(4): 965–979
[10] Li S M, Li B Z, Shi W M. Expression patterns of nine ammonium transporters in rice in response to N status[J]. Pedosphere, 2012, 22(6): 860–869
[11] Lescot M, Déhais P, Moreau Y, et al. PlantCARE: A database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, Database Issue, 2002, 30(1):325–327
[12] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions: Beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. The EMBO Journal, 1987, 6(13): 3901–3907
[13] 邹娜, 李保海, 强晓敏, 等. 高铵胁迫对拟南芥根系向重性的影响及机制初探[J]. 土壤, 2013, 45(1): 166-171
[14] 李青, 李保海, 施卫明. 高铵胁迫对拟南芥幼苗侧根生长的影响及机制探索[J]. 土壤, 2011, 43(3): 374-381
[15] Pastor V, Gamir J, Camanes G, et al. Disruption of the ammonium transporteralters basal defenses generating resistance againstand[J]. Frontiers in Plant Science, 2014, 5: 231-247
[16] Bao A, Liang Z, Zhao Z, et al. Overexpressing of, a high affinity ammonium transporter gene, modifies rice growth and carbon–nitrogen metabolic status[J].International Journal of Molecular Sciences. 2015, 16: 9037–9063
[17] Loque D, von Wiren N. Regulatory levels for the transport of ammonium in plant roots[J]. Journal of Experimental Botany, 2004, 55: 1293–1305
[18] Sohlenkamp C, Wood C C, Roeb G W, et al. Characterization of Arabidopsis, a high-affinity ammonium transporter of the plasma membrane[J]. Plant Physiology, 2002, 130: 1788–1796
[19] Shi W M, Xu W F, Li S M, et al. Responses of two rice cultivars differing in seedling stage nitrogen use efficiency to growth under low-nitrogen conditions[J]. Plant and Soil, 2010, 326: 291–302
[20] Lejay L, Wirth J, Pervent M, et al. Oxidative pentose phosphate pathway–dependent sugar sensing as a mechanism for regulation of root ion transporters by photosynthesis[J]. Plant Physiology, 2008, 146: 2036–2053
[21] Hong J J, Park Y S, Bravo A, et al. Diversity of morphology and function in arbuscular mycorrhizal symbioses in[J]. Planta, 2012, 236: 851–865
[22] Koegel S, Ait Lahmidi N, Arnould C, et al. The family of ammonium transporters (AMT) in: Two AMT members are induced locally, but not systemically in roots colonized by arbuscular mycorrhizal fungi[J]. New Phytologist, 2013, 198: 853–865
[23] Pérez-Tienda J, Corrêa A, Azcón-Aguilar C, et al. Transcriptional regulation of host NH4+transporters and GS/GOGAT pathway in arbuscular mycorrhizal rice roots[J]. Plant Physiology Biochemistry, 2014, 75: 1–8
[24] Ruzicka D R, Hausmann N T, Barrios-Masias F H, et al. Transcriptomic and metabolic responses of mycorrhizal roots to nitrogen patches under field conditions[J]. Plant and Soil, 2012, 350: 145–162
[25] Straub D, Ludewig U, Neuhäuser B. A nitrogen dependent switch in the high affinity ammonium transport in[J]. Plant Molecular Biology, 2014, 86: 485–494
[26] Straub T, Ludewig U, Neuhäuser B. The kinase CIPK23 inhibits ammonium transport in[J]. Plant Cell, 2017, 29(2): 409–422
[27] Wu Y, Yang W, Wei J, et al. Transcription factorcontrols ammonium uptake by inducing ammonium transporters in rice roots[J]. Molecules Cells, 2017, 40(3): 178–185
[28] Yuan L, Gu R, Xuan Y, et al. Allosteric regulation of transport activity by heterotrimerization ofArabidopsis ammonium transporter complexes in vivo[J]. Plant Cell, 2013, 25: 974–984
[29] van den Berg B, Chembath A, Jefferies D, et al. Structural basis for Mep2 ammonium transceptor activation by phosphorylation[J]. Nature Communication, 2016, 7: 11337
Promoter Analysis of Rice Ammonium Transporters
LI Sumei1, SHI Weiming2*
(1 Institute of Botany, Jiangsu Province and Chinese Academy of Sciences, Nanjing 210014, China; 2 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
AMT is transmembrane protein mediated high-affinity ammonium uptake in plants. It has been reported that the expression of most genes encoding AMT protein depends on external nitrogen level and environmental condition, but the mechanism of expression regulation is unclear. The expression ofwas greatly induced by nitrogen-deficiency. Therefore, the sequence ofpromoter was cloned by using PCR from rice genome DNA and analyzed by using software and experimental analysis fusion GUS reporter gene. Software predicted results showed that the promoter region contained not only the TATA box and CAAT box, but also a variety of cis-elements of abiotic stress, biological stress, hormone and light response, such as Box-w1, MBS, MeJA, TATC and ERE.promoter was deleted along with 5′ end to construct five different pAMT12-x-GUS expression vector, which subsequently were transformed into rice callus to establish different transgenic rice lines. The GUS activity of T1 generation plants showed that the shortest promoter fragment (–211 bp) could start the GUS expression, but GUS activity was low and the effect of nitrogen-deficiency was not significant. The GUS activity and inductive effect of nitrogen-deficiency significantly increased when –763 bp promoter fragment fusion with GUS, additionally the inductive effect no longer significantly enhanced with the increase of the promoter length. The cis-element of abiotic stress and hormones related lies between –211 bp and –763 bp, whether correlation between nitrogen regulation and cis-elements of abiotic stress and hormones remains to be further probed.
Ammonium transporter;promoter; Cis-acting elements; GUS activity
国家自然科学青年基金项目(30800702)资助。
(wmshi@issas.ac.cn)
李素梅(1978—),女,安徽合肥人,博士,助理研究员,研究方向为氮素吸收转运机制。E-mail:smli321@163.com
10.13758/j.cnki.tr.2018.03.003
Q786;Q945.12
A

